神経疾患とミトコンドリア
神経疾患とミトコンドリアダメージ
アルツハイマー病やパーキンソン病等の神経疾患では、ミトコンドリアのオートファジー(マイトファジー)が障害され、損傷したミトコンドリアを効果的に除去できないことが病因の一つとして報告されている。
| マイトファジー | ミトコンドリアの分裂異常 | ROS | ミトコンドリア膜透過性遷移孔 | ミトコンドリア膜電位 | ATP | |
| 検出キット | MD01 Mitophagy Detection Kit | MT10/MT11/MT12 MitoBright LT Green/Red/Deep Red | R252/R253 ROS Assay Kit |
- | MT09:JC-1 MT13:MT-1 | A550 ATP Assay Kit-Luminescence |
| アルツハイマー病(AD) | ↓ | ✓ | ↑ | ↑ | ↓ | ↓ |
| パーキンソン病(PD) | - | - | ||||
| ハンチントン病(HD) | - | - | - | |||
| 筋萎縮性側索硬化症(ALS) | - | ↓ |
Refernce :
Role of Mitochondria in NeurodegenerativeDiseases: From an Epigenetic Perspective
マイトファジー / オートファジー関連製品
| 製品名 | 色素1 色素名と蛍光特性 |
色素2 色素名と蛍光特性 |
|---|---|---|
| Mitophagy Detection Kit | Mtphagy Dye Ex: 500-560 nm, Em: 670-730 nm |
Lyso Dye Ex: 350-450 nm, Em: 500-560 nm |
| Mtphagy Dye | Mtphagy Dye Ex: 500-560 nm / Em: 690-750 nm |
|
| Autophagic Flux Assay Kit* | DAPRed Ex: 500-560 nm / Em: 690-750 nm |
DALGreen Ex: 350-450 nm / Em: 500-560 nm |
*Autophagic Flux Assay Kit はネガティブコントロールとしてオートファジー阻害剤(Bafilomycin A1)を同梱しています
神経疾患と細胞死
| 神経疾患 | 細胞死の種類 | トリガー因子 | エフェクター因子 | 特徴 |
|
ALS、PD:神経細胞のアポトーシスは、p53遺伝子、lnc RNA、FUS遺伝子変異、ミトコンドリア機能障害などのメカニズムが関与する。 |
Apoptosis | DNAダメージ 成長因子↓ DAMPsとレセプターの結合(TNFR,TRAIL,FAS) |
Caspase-3/7 |
・Caspase-3活性化 |
|
AD:脂質過酸化はシナプス消失と関連している PD: 鉄の蓄積と鉄代謝に関連する変異が神経変性と関連している。 |
Ferroptosis |
GPX4 ↓ |
過酸化脂質 | ミトコンドリアの萎縮 |
|
PDは銅含有量の減少と銅トランスポーター(CTR-1)の機能障害によって特徴づけられる。 |
Cuproptosis | 動の蓄積によりFDX1 ↑ SLC31A1 ↑ | タンパク質毒性ストレス | DLATの凝集 Fe-S クラスター ↓ |
|
AD:RIPK1/RIPK3/MLKLを介したネクロトーシスは、炎症と神経細胞死を引き起こす。ADにおけるRIPK3/MLKLの増加は神経細胞密度の低下と相関する。 HD: 変異ハンチンチンはHippo経路を通じてネクロトーシスを誘導し、これを標的とすることで運動機能の低下を防ぎ、RIP3レベルを低下させる。 |
Necroptosis | TNF TLR ZBP1 IFN |
RIPK1 |
カスパーゼ非依存的な細胞死 膜破壊による炎症応答 (細胞外ATPなどのDAMPsが放出) |
Reference:
神経疾患とLLPS
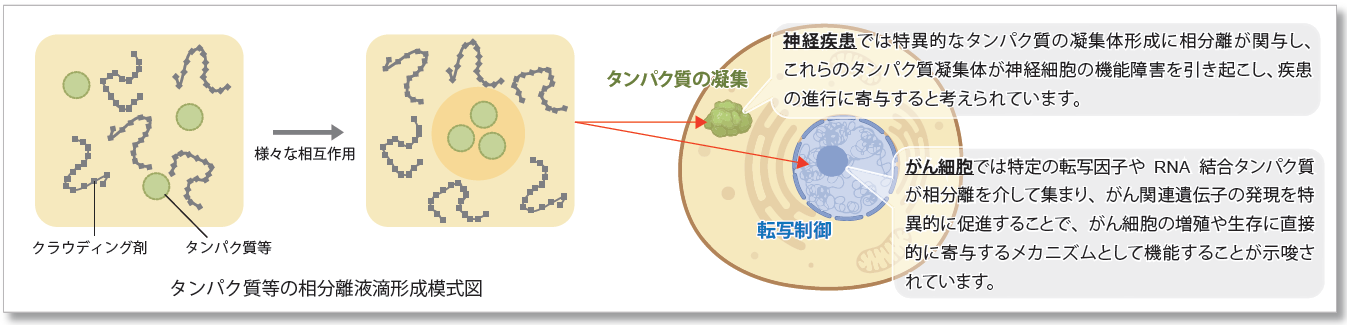
液‐液相分離( liquid-liquid phase separation: LLPS)は細胞内で特定の分子が局所的に集まり、液体のような性質を持つ生体分子の凝集体(液滴)を形成する現象です。近年、LLPS が細胞内での多くの生物学的プロセスに影響を与えることが明らかになり注目を浴びています。 相分離によって形成される液滴の研究はまだ初期段階ですが、これらの生物学的な現象がどのようにして細胞の機能や疾患の発症に影響を与えるかを解明することは、新しい治療法の開発につながる重要な鍵と考えられています。
参考文献 E. Dolgin, Nature, 2018, DOI: 10.1038/d41586-018-03070-2.
タンパク質の凝集は神経変性疾患の特徴です。病的封入体に見られる多くのタンパク質は、可逆的な分子自己集合プロセスであるLLPSを起こすことが知られています。最近の報告から、調節不全に陥ったLLPSが神経変性におけるタンパク質凝集の前兆として作用する可能性が示唆されており、その基礎となるメカニズムを解明し、調節のための戦略を構築することが新たな治療戦略として注目されています。


参考文献: Zbinden, A. Developmental Cell, 2020, DOI: 10.1016/j.devcel.2020.09.014.
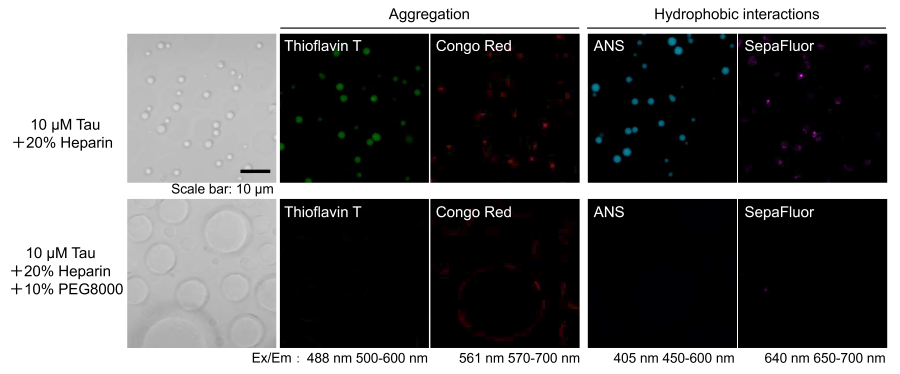
実験例:Tauタンパク質液滴の性質に与えるクラウディング剤の影響
LLPS Characterization-dye Setを用いてTauタンパク質液滴の性質の検討を行った。Tauタンパク質に足場となるヘパリンを添加すると、Tauタンパク質液滴が観察され、アミロイド染色色素であるThioflavin T及びCongo Red両色素で陽性を示した。
また、疎水場環境で蛍光を発するANS、SepaFluoいずれの色素でも本液滴は陽性となり、アミロイド様の凝集構造を示すことが示唆されました。
一方、クラウディング剤PEG8000を添加した系においては、 Tauタンパク質液滴の肥大化が認められ、すべての色素で蛍光シグナルの減弱が認められました。
これらの結果からクラウディング剤による相分離液滴形成の促進が、Tauタンパク質液滴の性質に影響を与える可能性が示唆されました。
<実験条件>
Tau 441(WT):10 μmol/l
Heparin:20%
PEG8000:10 %
Buffer: 10 mmol/l HEPES (pH 7.4), 150 mmol/l NaCl
Dye:10 μmol/l Thioflavin T, Congo Red, ANS, 100 nmol/l SepaFluor
Incubate (37℃):7 days
Fluorescence microscope :Zeiss LSM800
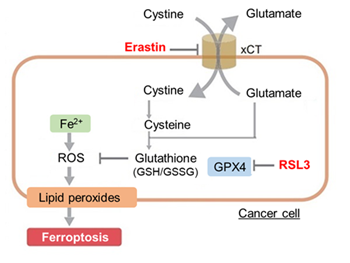
実験例:薬剤誘導による細胞死の各指標の変化
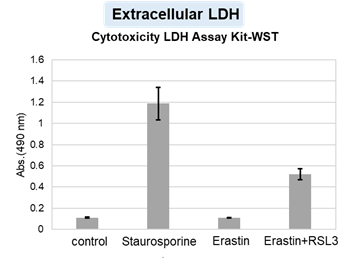
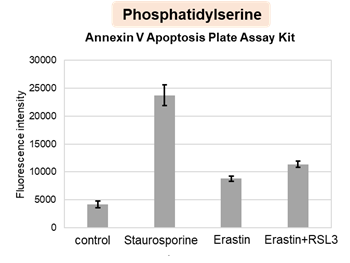
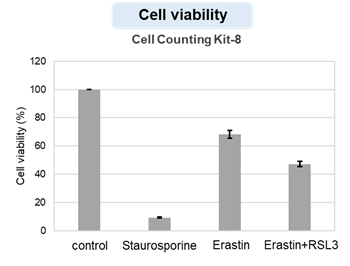
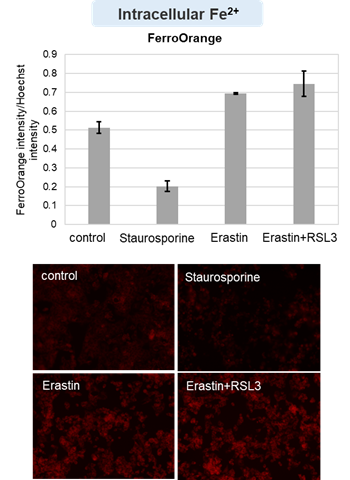
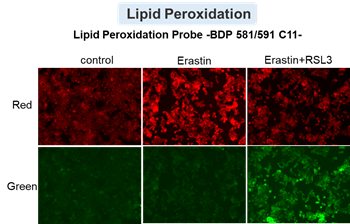
アポトーシス誘導剤であるStaurosporinまたはフェロトーシス誘導剤であるErastin、RSL3で処理したHepG2細胞の細胞外LDH、ホスファチジルセリン、細胞生存率、細胞内Fe2+、脂質過酸化の変化を解析しました。
その結果、Staurosporinで処理したアポトーシス誘導細胞ではホスファチジルセリンの増加、細胞生存率の低下並びに細胞外LDHが増加し細胞死が起きていることが確認できました。一方でフェロトーシス指標である細胞内Fe2+は変化がありませんでした。フェロトーシス誘導剤であるErastinで処理した細胞では細胞内Fe2+の増加と細胞生存率の低下が確認されましたが、細胞外LDHと脂質過酸化(脂質過酸化:赤色蛍光の減少と緑色蛍光の増加)は増加しませんでした。Erastinに加えてRSL3を同時に処理し、より強力にフェロトーシスを誘導した細胞では、フェロトーシスの指標である細胞内Fe2+と脂質過酸化の増加並びに細胞生存率の低下が確認され、死細胞が増加しました。一方で、ホスファチジルセリンはアポトーシス誘導細胞と比較し、フェロトーシス誘導時には増加率が低い結果となりました。これらの結果から、細胞死の指標を組み合わせて評価することで細胞死を見分けられることがわかりました。
<使用製品>
細胞外LDH :Cytotoxicity LDH Assay Kit-WST(製品コード:CK12)
ホスファチジルセリン:Annexin V Apoptosis Plate Assay Kit(製品コード:AD12)
細胞生存率 :Cell Counting Kit-8(製品コード:CK04)
細胞内Fe2+ :FerroOrange(製品コード:F374) *Hoechst 33342の蛍光強度で補正
脂質過酸化 :Lipid Peroxidation Probe -BDP 581/591 C11-(製品コード:L267)
<実験条件>
細胞:HepG2細胞(2×104 cells/well)
薬剤:Staurosporin(5 μmol/l), Erastin(25 µmol/l), Erastin+RSL3(どちらも25 µmol/l)
*無血清培地に希釈して添加
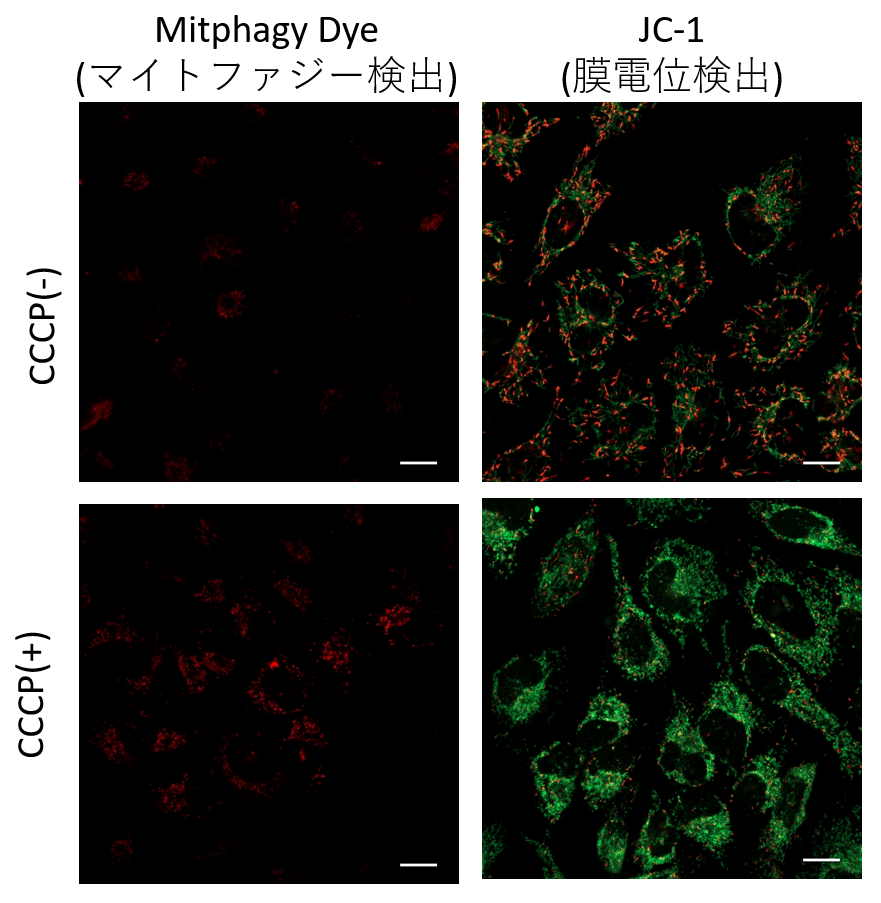
実験例:マイトファジー誘導とミトコンドリア膜電位変化の検出
Parkin発現HeLa細胞を用いて、CCCP(carbonyl cyanide m-chlorophenyl hydrazone)添加の有無によるミトコンドリアの状態を、マイトファジー検出キット(Mitophagy Detection Kit:MD01)及びミトコンドリア膜電位検出キット(JC-1 MitoMP Detection Kit: MT09)にて評価しました。
結果、CCCP未処理の細胞ではマイトファジーは殆ど検出されず、またミトコンドリア膜電位が正常に維持されていることが確認されました。一方、CCCPを添加した細胞では、ミトコンドリア膜電位の低下(JC-1の赤色蛍光減少)とマイトファジーの誘導(Mtphagy Dyeの蛍光増大)を確認しました。
<実験条件>
■HeLa細胞へのParkin プラスミドの導入
HilyMax(製品コード:H357)を用いてHeLa細胞へParkin プラスミドを導入(Parkin プラスミド/HilyMax reagent : 0.1 μg/0.2 μl)
し,一晩培養後の細胞を用いて下記検出を行った。
■マイトファジー検出
Parkin発現HeLa細胞に0.1 μmol/l Mtphagy working solution を添加し37 ℃で30分間インキュベートした。その後、細胞をHBSSにて洗浄し、10 μg/ml CCCP/MEM 溶液を添加し、37 ℃にて2時間インキュベートした。処理した細胞を、蛍光顕微鏡にて観察した。
■ミトコンドリア膜電位検出
Parkin発現HeLa細胞に10 μg/ml CCCP/MEM 溶液を添加し、37℃にて1.5時間インキュベートした。そこへ終濃度2 μmol/lとなるように4 μmol/l JC-1 working solutionを添加し、37 ℃で30分間インキュベートした。インキュベート後、HBSSを用いて細胞を洗浄しImaging Buffer solutionを添加後、蛍光顕微鏡にて観察した。
<検出条件>
■マイトファジー検出
Ex: 561 nm, Em: 570-700 nm
■ミトコンドリア膜電位検出
Green Ex: 488 nm, Em: 500-550 nm
Red Ex: 561 nm, Em: 560-610 nm