Mitophagy Detection Kit

マイトファジー検出キット
-
製品コードMD01 Mitophagy Detection Kit
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 1 set | ¥46,000 | 344-91901 |
| 1 set | ・Mtphagy Dye ・Lyso Dye |
5 μg x 1 30 μg x 1 |
|---|
性質
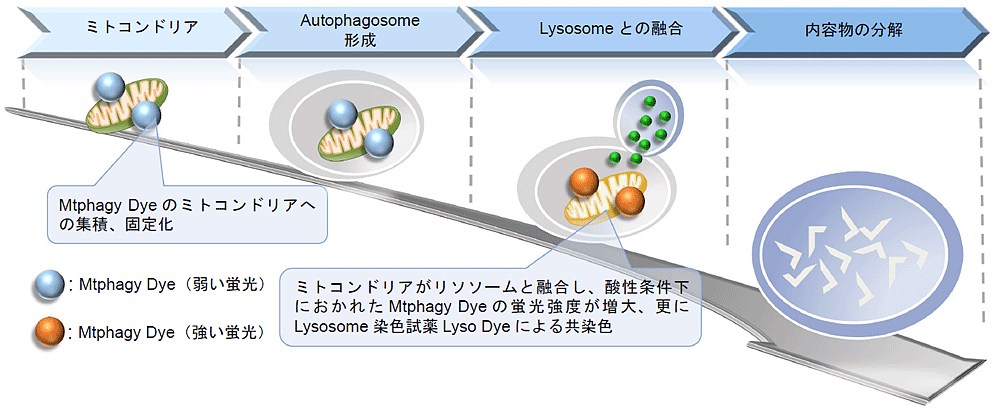
ミトコンドリアはエネルギー産生の場として知られ、細胞内で重要な機能を持つオルガネラの一つである。近年では、アルツハイマー病やパーキンソン病の原因の一つに不良化したミトコンドリアの蓄積が報告され、マイトファジーがその中で重要な役割をもった機構であることが明らかになってきている。マイトファジーは酸化ストレスやDNA損傷等により不良化したミトコンドリアを選択的に除去するシステムであり、不良ミトコンドリアはオートファゴソームにより隔離され、リソソームと融合し消化される。
Mtphagy Dyeは、生細胞膜を透過し細胞内のミトコンドリアに集積した後、化学結合によりミトコンドリアに固定化される。周辺の環境によりMtphagy Dyeの蛍光強度は低い状態にあるが、マイトファジーが誘導されてミトコンドリアがリソソームと融合すると、酸性条件下におかれたMtphagy Dyeの蛍光強度が増大する。本キットはマイトファジーを検出するMtphagy Dyeとリソソームを染色するLyso Dyeで構成されている。
特長
1) 低分子蛍光試薬を添加するだけでマイトファジーを簡便に検出
2) 蛍光顕微鏡による生細胞イメージングが可能
3) 付属のリソソーム染色試薬との共染色が可能
マイトファジー / オートファジー関連製品
| 製品名 | 色素1 色素名と蛍光特性 |
色素2 色素名と蛍光特性 |
|---|---|---|
| Mitophagy Detection Kit | Mtphagy Dye Ex: 500-560 nm, Em: 670-730 nm |
Lyso Dye Ex: 350-450 nm, Em: 500-560 nm |
| Mtphagy Dye | Mtphagy Dye Ex: 500-560 nm / Em: 690-750 nm |
|
| Autophagic Flux Assay Kit* | DAPRed Ex: 500-560 nm / Em: 690-750 nm |
DALGreen Ex: 350-450 nm / Em: 500-560 nm |
*Autophagic Flux Assay Kit はネガティブコントロールとしてオートファジー阻害剤(Bafilomycin A1)を同梱しています
技術情報
マイトファジーの検出例
 |
Mtphagy Dye (マイトファジー染色) 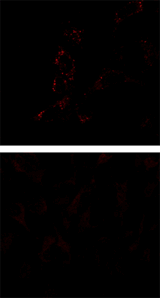 |
Lyso Dye (リソソーム染色) 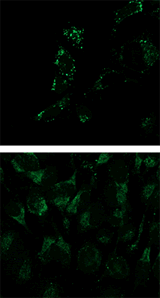 |
MitoBright Deep Red (ミトコンドリア染色試薬) 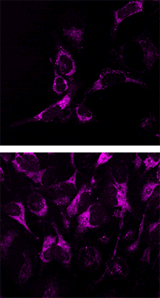 |
重ね合せ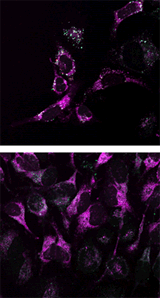 |
Parkin発現HeLa細胞(上段)および未発現HeLa細胞(下段)にCCCP(carbonyl cyanide m-chlorophenyl hydrazone)を添加した。Parkinを発現した細胞をCCCPで刺激することでマイトファジーを誘導し、蛍光イメージングにより検出した。また、ミトコンドリア染色色素(MitoBright Deep Red※)と共染色することにより、リソソームに取り込まれたミトコンドリア(白色)と取り込まれていないミトコンドリア(紫色)を識別することが可能となった(写真: 右)。
<フィルター>
Mtphagy Dye:
561 nm (Ex)、650 LP nm (Em)
Lyso Dye:
488 nm (Ex)、502-554 nm (Em)
MitoBright Deep Red:
640 nm (Ex)、656-700 nm (Em)
※ MitoBright Deep Redは現在販売しておりません。
滞留性を高めた改良品 MitoBright LT Deep Red (製品コード:MT12)をご参照ください。
マイトファジーのリアルタイム観察
HeLa細胞をCCCP処理し、マイトファジー検出試薬(MtphagyDye)及びミトコンドリア染色試薬(MitoBright LT Green)にて共染色しタイムラプス撮影(6時間)しました。
|
<検出条件> |
技術や使用製品に関する補足
長期滞留性・血清培地中で使用可能
【ミトコンドリア染色試薬】
飢餓誘導条件下での検出例
 |
Mtphagy Dye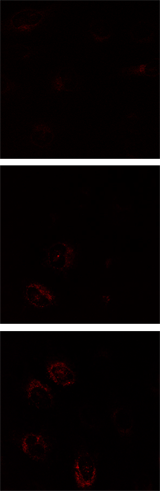 |
Lyso Dye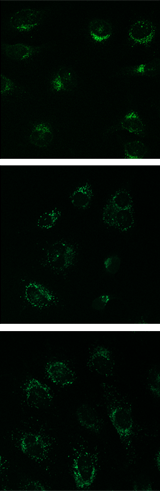 |
重ね合せ |
誘導条件①:Krebs’ Buffer (Pepstatin A及びGlucagon含有)
誘導条件②:DMEM培地 (アミノ酸不含、Pepstatin A及びE-64d含有)
<フィルター>
Mtphagy Dye: 561 nm (Ex)、650 LP nm (Em)
Lyso Dye: 488 nm (Ex)、502-554 nm (Em)
HeLa 細胞へMtphagy Dye を添加後、飢餓誘導条件下にて6 時間インキュベート。その後Lyso Dye 添加によりリソソームの共染色を行った結果、飢餓誘導したHeLa 細胞において、Mtphagy Dye の蛍光の増大がみられた。
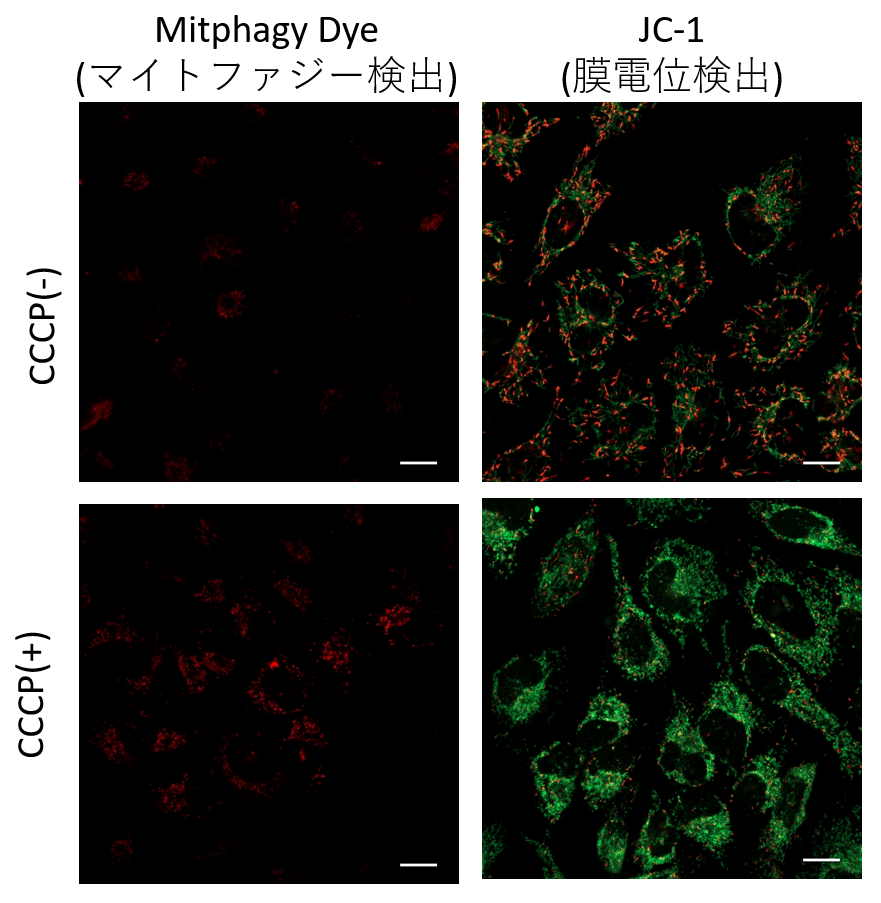
マイトファジー誘導とミトコンドリア膜電位変化の検出
Parkin発現HeLa細胞を用いて、CCCP(carbonyl cyanide m-chlorophenyl hydrazone)添加の有無によるミトコンドリアの状態を、マイトファジー検出キット(Mitophagy Detection Kit:MD01)及びミトコンドリア膜電位検出キット(JC-1 MitoMP Detection Kit: MT09)にて評価しました。
結果、CCCP未処理の細胞ではマイトファジーは殆ど検出されず、またミトコンドリア膜電位が正常に維持されていることが確認されました。一方、CCCPを添加した細胞では、ミトコンドリア膜電位の低下(JC-1の赤色蛍光減少)とマイトファジーの誘導(Mtphagy Dyeの蛍光増大)を確認しました。
<実験条件>
■HeLa細胞へのParkin プラスミドの導入
HilyMax(製品コード:H357)を用いてHeLa細胞へParkin プラスミドを導入(Parkin プラスミド/HilyMax reagent : 0.1 μg/0.2 μl)
し,一晩培養後の細胞を用いて下記検出を行った。
■マイトファジー検出
Parkin発現HeLa細胞に0.1 μmol/l Mtphagy working solution を添加し37 ℃で30分間インキュベートした。その後、細胞をHBSSにて洗浄し、10 μg/ml CCCP/MEM 溶液を添加し、37 ℃にて2時間インキュベートした。処理した細胞を、蛍光顕微鏡にて観察した。
■ミトコンドリア膜電位検出
Parkin発現HeLa細胞に10 μg/ml CCCP/MEM 溶液を添加し、37℃にて1.5時間インキュベートした。そこへ終濃度2 μmol/lとなるように4 μmol/l JC-1 working solutionを添加し、37 ℃で30分間インキュベートした。インキュベート後、HBSSを用いて細胞を洗浄しImaging Buffer solutionを添加後、蛍光顕微鏡にて観察した。
<検出条件>
■マイトファジー検出
Ex: 561 nm, Em: 570-700 nm
■ミトコンドリア膜電位検出
Green Ex: 488 nm, Em: 500-550 nm
Red Ex: 561 nm, Em: 560-610 nm
Mtphagy Dye, Lyso Dyeの蛍光特性
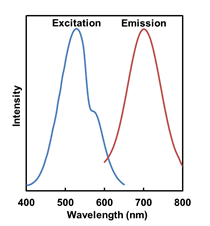 Mtphagy Dyeの 励起・蛍光スペクトル |
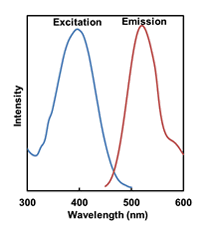 Lyso Dyeの 励起・蛍光スペクトル |
取扱条件/SDS
| 性状: | |
|---|---|
| Mtphagy Dye: | 試験適合 |
| Lyso Dye: | 試験適合 |
参考文献
| 文献No. | 対象サンプル | 装置 | 引用(リンク) |
|---|---|---|---|
| 1) |
細胞(HeLa) |
フローサイトメーター | J. Koniga, C. Otta, M. Hugoa, T. Junga, A. L. Bulteaub, T. Grunea and A. Hohna, "Mitochondrial contribution to lipofuscin formation", Redox Biology, 2017, 11, 673. |
| 2) | 細胞(KB) | 蛍光顕微鏡 | K. Kameyama, "Induction of mitophagy-mediated antitumor activity with folate-appended methyl-β-cyclodextrin", International Journal of Nanomedicine, 2017, 12, 3433. |
| 3) |
細胞(SH-SY5Y, 初代ラット皮質神経細胞) |
蛍光顕微鏡 | E. F. Fang, T. B. Waltz, H. Kassahun, Q. Lu, J. S. Kerr, M. Morevati, E. M. Fivenson, B. N. Wollman, K. Marosi, M. A. Wilson, W. B. Iser, D. M. Eckley, Y. Zhang, E. Lehrmann, I. G. Goldberg, M. S. Knudsen, M. P. Mattson, H. Nilsen, V. A. Bohr and K. G. Becker, "Tomatidine enhances lifespan and healthspan in C. elegans through mitophagy induction via the SKN-1/Nrf2 pathway", Scientific Reports, 2017, 7, (46208), DOI: 10.1038/srep46208. |
| 4) | 細胞(HeLa、Parkin発現HeLa) | 蛍光顕微鏡 | H. Iwashita, S. Torii, N. Nagahora, M. Ishiyama, K. Shioji, K. Sasamoto, S. Shimizu and K. Okuma, "Live Cell Imaging of Mitochondrial Autophagy with a Novel Fluorescent Small Molecule", ACS Chem. Biol., 2017, 12, (10), 2546. |
| 5) |
細胞(Cardiomyocytes) |
フローサイトメーター | Y. Feng, NB. Madungwe, CV. da Cruz Junho and JC. Bopassa, "Activation of G protein-coupled oestrogen receptor 1 at the onset of reperfusion protects the myocardium against ischemia/reperfusion injury by reducing mitochondrial dysfunction and mitophagy.", Br. J. Pharmacol., 2017, 174, (23), 4329. |
| 6) |
細胞(HCT116) |
蛍光顕微鏡 | K. M. Elamin, K. Motoyama, T. Higashi, Y. Yamashita, A. Tokuda and H. Arima, "Dual targeting system by supramolecular complex of folate-conjugated methyl-β-cyclodextrin with adamantane-grafted hyaluronic acid for the treatment of colorectal cancer.", Int. J. Biol. Macromol., 2018, doi: 10.1016/j.ijbiomac.2018.02.149. |
| 7) |
細胞(Parkin-HeLa) |
プレートリーダー | N. Furuya, S. Kakuta, K. Sumiyoshi, M. Ando, R. Nonaka, A. Suzuki, S. Kazuno, S. Saiki and N. Hattori, "NDP52 interacts with mitochondrial RNA poly(A) polymerase to promote mitophagy.", EMBO Rep. ., 2018, doi: 10.15252/embr.201846363. |
| 8) |
細胞(NKT) |
フローサイトメーター | L. Zhu, X. Xie, L. Zhang, H. Wang, Z. Jie, X. Zhou, J. Shi, S. Zhao, B. Zhang, X. Cheng and S. Sun, "TBK-binding protein 1 regulates IL-15-induced autophagy and NKT cell survival", Nature Communications., 2018, 9, (1), doi:10.1038/s41467-018-05097-5. |
| 9) |
細胞(HeLa) |
フローサイトメーター | K. Araki, K. Kawauchi, W. Sugimoto, D. Tsuda, H. Oda, R. Yoshida and K. Ohtani, "Mitochondrial protein E2F3d, a distinctive E2F3 product, mediates hypoxia-induced mitophagy in cancer cells", Commun Biol., 2019, DOI: 10.1038/s42003-018-0246-9. |
| 10) |
細胞(Bovine Sertoli) |
蛍光顕微鏡 | E. Adegoke, S. Adeniran, Y. Zeng, X. Wang, H. Wang, C. Wang, H. Zhang, P. Zheng and G. Zhang , "Pharmacological inhibition of TLR4/NF-κB with TLR4-IN-C34 attenuated microcystin-leucine arginine toxicity in bovine Sertoli cells.", J Appl Toxicol., 2019,doi: 10.1002/jat.3771. |
| 11) |
組織(マウス) |
蛍光顕微鏡 | E. F. Fang, Y. Hou, K. Palikaras, B. A. Adriaanse, J. S. Kerr, B. Yang, S. Lautrup, M. M. Hasan-Olive, D. Caponio, X. Dan, P. Rocktaschel, D. L. Croteau, M. Akbari, N. H. Greig, T. Fladby, H. Nilsen, M. Z. Cader, M. P. Mattson, N. Tavernarakis and V. A. Bohr, "Mitophagy inhibits amyloid-β and tau pathology and reverses cognitive deficits in models of Alzheimer's disease.", Nat. Neurosci. ., 2019,DOI:10.1038/s41593-018-0332-9. |
| 12) |
細胞(HepG2) |
蛍光顕微鏡 | Iwasawa, T. Shinomiya, N. Ota, N. Shibata, K. Nakata, I. Shiina, and Y. Nagahara , "Novel Ridaifen-B Structure Analog Induces Apoptosis and Autophagy Depending on Pyrrolidine Side Chain", Biological and Pharmaceutical Bulletin., 2019, 42, (3), 401-410, doi: 10.1248/bpb.b18-00643. |
| 13) |
細胞(U2OS) |
蛍光顕微鏡 プレートリーダー |
T. Namba, "BAP31 regulates mitochondrial function via interaction with Tom40 within ER-mitochondria contact sites ", Sci Adv., 2019, 5, (6), 1386. |
| 14) | 細胞(ラット:INS-1) | 蛍光顕微鏡 | A. Inamura, S. M. Hirayama, and K. Sakurai, Loss of Mitochondrial DNA by Gemcitabine Triggers Mitophagy and Cell Death', Biol. Pharm. Bull.., 2019, 42, 1977. |
| 15) |
細胞(HRCEpiC, HRPTEpic) |
プレートリーダー | Y. Zhao and M. Sun, Metformin rescues Parkin protein expression and mitophagy in high glucose-challenged human renal epithelial cells by inhibiting NF-κB via PP2A activation., Life Sci.., 2020, DOI:10.1016/j.lfs.2020.117382. |
| 16) |
細胞(RAES) |
蛍光顕微鏡 | N. Liu, J. Wu, L. Zhang, Z. Gao, Y. Sun, M. Yu, Y. Zhao, S. Dong, F. Lu and W. Zhang , "Hydrogen Sulphide modulating mitochondrial morphology to promote mitophagy in endothelial cells under high‐glucose and high‐palmitate ", J. Cell. Mol. Med., 2017, 21, (12), 3190. |
| 17) |
細胞(BAECs) |
蛍光顕微鏡 | N. Kajihara, D. Kukidome, K. Sada, H. Motoshima, N. Furukawa, T. Matsumura, T. Nishikawa and E. Araki, "Low glucose induces mitochondrial reactive oxygen species via fatty acid oxidation in bovine aortic endothelial cells", J Diabetes Investig, 2017, 8, (6), 750. |
| 18) |
細胞(HT22) |
蛍光顕微鏡 | M. Jin, H. Ni and L. Li, "Leptin Maintained Zinc Homeostasis Against Glutamate-Induced Excitotoxicity by Preventing Mitophagy-Mediated Mitochondrial Activation in HT22 Hippocampal Neuronal Cells.", Front Neurol, 2018, 9, (9), 332. |
| 19) |
細胞(BMDMs) |
フローサイトメーター | D. Bhatia, K. P. Chung, K. Nakahira, E. Patino, M. C. Rice, L. K. Torres, T. Muthukumar, A. M. Choi, O. M. Akchurin and M. E. Choi , "Mitophagy-dependent macrophage reprogramming protects against kidney fibrosis", JCI Insight, 2019, 4, (23), e132826. |
| 20) |
細胞(U2OS) |
蛍光顕微鏡 | J. Zheng, D. L. Croteau, V. A. Bohr and M. Akbari, "Diminished OPA1 expression and impaired mitochondrial morphology and homeostasis in Aprataxin-deficient cells. ", Nucleic Acids Res., 2019, 47, (8), 4086. |
| 21) |
細胞(HT22) |
蛍光顕微鏡 | D. D. Wang, M. F. Jin, D. J. Zhao and H. Ni, "Reduction of Mitophagy-Related Oxidative Stress and Preservation of Mitochondria Function Using Melatonin Therapy in an HT22 Hippocampal Neuronal Cell Model of Glutamate-Induced Excitotoxicity", Front Endocrinol (Lausanne), 2019, 10, 550. |
| 22) |
細胞(CD4+T-cells, HeLa) |
蛍光顕微鏡 フローサイトメーター |
A. Bektas, S. H. Schurman, M. G. Freire, A. Bektas, S. H. Schurman, M. G. Freire, C. A. Dunn, A. K. Singh, F. Macian, A. M. Cuervo, R. Sen and L. Ferrucci, "Age-associated changes in human CD4+ T cells point to mitochondrial dysfunction consequent to impaired autophagy.", Aging (Albany NY)., 2019, 11, (21), 9234-9263. |
| 23) |
細胞(ALM) |
フローサイトメーター | T. Nechiporuk, S.E. Kurtz, O. Nikolova, T. Liu, C.L. Jones, A. D. Alessandro, R. C. Hill, A. Almeida, S. K. Joshi, M. Rosenberg, C. E. Tognon, A. V. Danilov, B. J. Druker, B. H. Chang, S. K McWeeney and J. W. Tyner, "The TP53 Apoptotic Network Is a Primary Mediator of Resistance to BCL2 Inhibition in AML Cells.", Cancer Discov., 2019, 9, (7), 919. |
| 24) |
細胞(PK-15) |
蛍光顕微鏡 | Y. Zhang, R. Sun, X. Li and W. Fang, "Porcine Circovirus 2 Induction of ROS Is Responsible for Mitophagy in PK-15 Cells via Activation of Drp1 Phosphorylation", Viruses., 2020, 12, (3), 289. |
| 25) |
細胞(HCE) |
蛍光顕微鏡 | Y. Huo, W. Chen, X. Zheng, J. Zhao, Q. Zhang, Y. Hou, Y. Cai, X. Lu and X. Jin , "The protective effect of EGF-activated ROS in human corneal epithelial cells by inducing mitochondrial autophagy via activation TRPM2.", J. Cell. Physiol., 2020, DOI: 10.1002/jcp.29597. |
| 26) |
細胞(ラット:心筋細胞) |
蛍光顕微鏡 | Y. Sun, F. Lu, X. Yu, B. Wang, J. Chen, F. Lu, S. Peng, X. Sun, M. Yu, H. Chen, Y. Wang, L. Zhang, N. Liu, H. Du, D. Zhao and W. Zhang, "Exogenous H2S Promoted USP8 Sulfhydration to Regulate Mitophagy in the Hearts of db/db Mice.", Aging Dis., 2020, 11, (2), 269. |
| 27) |
細胞(HCFs) |
蛍光顕微鏡 | R. Tanaka, M. Umemura, M. Narikawa, M. Hikichi, K. Osaw, T. Fujita, U. Yokoyama, T. Ishigami, K. Tamura and Y. Ishikawa, "Reactive fibrosis precedes doxorubicin-induced heart failure through sterile inflammation.", ESC Heart Fail., 2020, 7, (2), 588. |
| 28) |
細胞(VSMCs) |
蛍光顕微鏡 | C. Duan, L. Kuang, X. Xiang, J. Zhang, Y. Zhu, Y. Wu, Q. Yan, L. Liu and T. Li, "Drp1 regulates mitochondrial dysfunction and dysregulated metabolism in ischemic injury via Clec16a-, BAX-, and GSH- pathways ", Cell Death Dis., 2020, 11, 251. |
| 29) |
細胞(Bovine Sertoli) |
蛍光顕微鏡 | E. O. Adegoke, W. Xue, N. S. Machebe, S. O. Adeniran, W. Hao, W. Chen, Z. Han, Z. Guixue and Z. Peng, "Sodium Selenite inhibits mitophagy, downregulation and mislocalization of blood-testis barrier proteins of bovine Sertoli cell exposed to microcystin-leucine arginine (MC-LR) via TLR4/NF-kB and mitochondrial signaling pathways blockage.", Ecotoxicol. Environ. Saf., 2018, 116, 165. |
| 30) |
細胞(HeLa) |
蛍光顕微鏡 | D. Takahashi, J. Moriyama, T. Nakamura, E. Miki, E. Takahashi, A. Sato, T. Akaike, K. I. Nakama and H. Arimoto, "AUTACs: Cargo-Specific Degraders Using Selective Autophagy. ", Mol. Cell, 2019, 76, (5), 797. |
| 31) |
細胞(primary hepatocyte) |
蛍光顕微鏡 | H. Kim, J. H. Lee and J. W. Park, "IDH2 deficiency exacerbates acetaminophen hepatotoxicity in mice via mitochondrial dysfunction-induced apoptosis.", Biochim Biophys Acta Mol Basis Dis, 2019, 1865, (9), 2333. |
| 32) |
細胞(C3H10T1/2s) |
蛍光顕微鏡 | M. S. Rahman and Y. S. Kim, "PINK1-PRKN mitophagy suppression by Mangiferin promotes a brown-fat-phenotype via PKA-p38 MAPK signalling in murine C3H10T1/2", Metabolism, 2020, 101, 154228. |
| 33) |
細胞(NHEKs) |
蛍光顕微鏡 | S. Ikeoka and A. Kiso , "The Involvement of Mitophagy in the Prevention of UV-B-Induced Damage in Human Epidermal Keratinocytes ", J. Soc. Cosmet. Chem. Jpn., 2020, 54(3), 252. |
| 34) | 細胞(MIN6-M9) | 蛍光顕微鏡 | R. Inoe, T. Tsuno, Y. Togashi, T. Okuyama, A. Sato, K. Nishiyama, M. Kyohara, J. Li, S. Fukushima, T. Kin, D. Miyashita, Y. Shiba, Y. Atobe, H. Kiyonari, K. Bando, A. S. Shapiro, K. Funakoshi, R. N. Kulkarni, Y. Terauchi, and J. Shirakawa, "Uncoupling protein 2 and aldolase B impact insulin release by modulating mitochondrial function and Ca2+ release from the ER", 2022, iScience, doi:10.1016/j.isci.2022.104603. |
よくある質問
-
Q
既存法に対する利点を教えてください。
-
A
pHセンサーKeimaタンパク質を用いた検出方法と比較して、本キットは低分子蛍光試薬を用いるため、蛍光タンパク質を発現させる必要がありません。また、一般的なライブセルイメージング用の蛍光試薬と同様の操作方法で染色、観察することができます。
-
Q
DMSO stock solutionは、どのくらい安定ですか?
-
A
Mtphagy Dye、Lyso Dyeともに、調製後、-20℃で保存してください。調製後1か月間安定です。使用量に応じて小分けして保存することをお勧めします。
-
Q
Working solutionは、どのくらい安定ですか?
-
A
保存できません。用時調製してください。
-
Q
蛍光顕微鏡の推奨フィルターを教えてください。
-
A
各試薬に応じて以下のフィルターを推奨します。
Mtphagy Dye: 励起(500~560 nm)、蛍光(670~730 nm)
Lyso Dye: 励起(350~450 nm)、蛍光(500~560 nm)
取扱説明書の「励起/蛍光スペクトル」及び「蛍光顕微鏡による測定例」もご参考ください。
-
Q
多重染色時の注意点を教えてください。
-
A
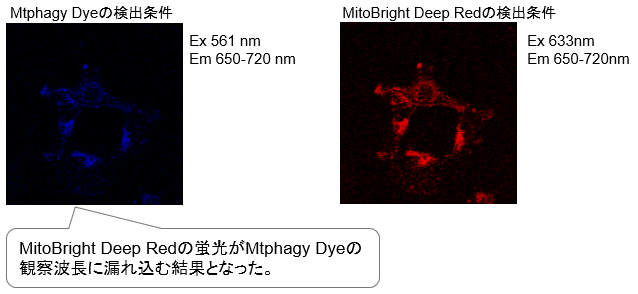
Mtphagy Dyeは一般的なRed系の蛍光色素に比べストークスシフトが長いため、Deep Redの蛍光色素と共染色する時には特に注意が必要です。
つまりMtphagy Dyeは500–560 nmで励起し、670-730 nmで蛍光を検出するため、Deep Redの蛍光検出波長と重なります。そのため、Deep Redの色素が励起されない波長でMtphagy Dyeを励起し、一方でMtphagy Dyeが励起されない波長でDeep Redの色素を励起する必要があります。
[漏れ込みの事例]
① MitoBright Deep Redのみを添加した細胞(Mtphagy Dyeは添加していない条件)を用意した。
② MitoBright Deep Redの励起・蛍光波長で観察し、蛍光が観察されるかを確認した(下右図)。
③ Mtphagy Dyeの励起・蛍光波長で観察し、蛍光が観察されるかを確認した(下左図)。
④ ③にてMitoBright Deep Red由来の蛍光が観察された(下左図)。※上記の様に蛍光の漏れ込みが確認された場合、下記をご参照ください。
[漏れ込み時の対処法]
○励起フィルター変更による対処
上記の確認例にある通りEx 561 nmではMitoBright Deep Redも励起されていることから、Mtphagy Dyeの励起波長をより500 nmに近いレーザーまたはフィルターに変更しMitoBright Deep Redが励起されない条件に設定する。
○励起強度および蛍光検出感度の調整による対処
MitoBright Deep Redの蛍光がMtphagy Dyeの観察波長に漏れ込んでいる場合、蛍光が観察されないレベルまで励起強度または観察時の感度を下げる。
その後、変更したそれぞれの観察条件でMtphagy Dyeの蛍光が検出できることを確認する。
[漏れ込みの確認方法]
Mtphagy Dye、Lyso Dye(リソソーム染色試薬)、MitoBright Deep Red(ミトコンドリア染色試薬)を用いた三重染色時の確認
1. 細胞を3つのdishまたはwellに準備する。
(Mtphagy Dye、Lyso Dye、MitoBright Deep Redは、それぞれ異なるdishまたはwell中の細胞に加え染色する)
2. Mtphagy DyeおよびMitoBright Deep Redをそれぞれの細胞に添加する。(血清不含培地中)
3. 37℃で30分間培養する。
4. マイトファジー誘導条件(飢餓培養など)にて培養する。
5. Lyso Dyeを上記2.で使用していない細胞へ添加する。(血清不含培地中)
6. 37℃で30分間培養する。
7. それぞれの試薬に滴した励起波長、蛍光波長で観察する。
8. 使用している試薬以外の観察波長で、蛍光の漏れ込みがないことを確認する。
[観察条件]
Lyso Dye:Ex 350-450 nm、Em 500-560 nm
Mtphagy Dye: Ex 500-560 nm、Em 670-730 nm
MitoBright Deep Red: Ex 640 nm、Em 656-700 nm
-
Q
Lyso Dyeの染色原理を教えてください。
-
A
Lyso Dyeは、正常なリソソームに集積後、リソソーム中の酸性条件によって蛍光強度が増大する原理となっています。Lyso Dyeは染色条件によって細胞外へ漏れやすいため、マイトファジー誘導後の観察直前に染色することを推奨しております。
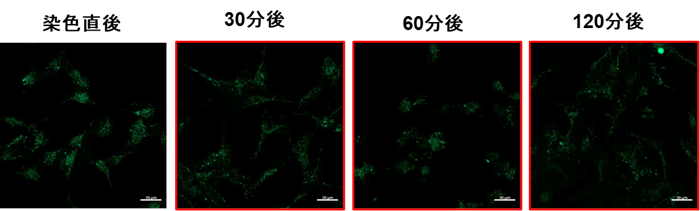
染色直後から30分後には徐々に蛍光強度の低下が確認されました。(細胞種:SH-SY5Y細胞)
リソソーム滞留性を高めた蛍光試薬として下記製品がございます。
[L261] LysoPrime Green - High Specificity and pH Resistance
-
Q
落射型顕微鏡で観察できますか?
-
A
落射型顕微鏡でも観察可能ですが、マイトファジーの輝点を明瞭に撮像されたい場合は、
共焦点レーザー顕微鏡にて観察されることを推奨しております。
落射型顕微鏡にて観察されたい場合は以下の点にご注意ください。(1) 高倍率(40倍以上)のレンズにて観察してください。
(2) 培地中のフェノールレッドによってバックグラウンドが観察されます。
フェノールレッド不含の培地またはHBSSをご使用ください。
-
Q
フローサイトメトリーでの測定は可能ですか?
-
A
可能です。
SH-SY5Y細胞でMtphagy Dyeを使用した実験例をご案内します。<操作>
1. SH-SY5Y細胞(8×105 cells/well)を6 well plateに播種し、一晩培養した。
2. 血清不含培地で2回洗浄した。
3. 血清不含培地で調製した100 nmol/l Mtphagy Dye working solutionを添加し30分間インキュベートした。
4. 血清不含培地で2回洗浄後、10 µmol/l Oligomycinと1 μmol/l Antimycinを含む培養培地を添加し、24時間培養した。
5. 上清を除去し、PBSで1回洗浄した。
6. トリプシンで細胞を剥がし、培養培地1 mlで回収する。
7. 300×gで5分間遠心し、培養培地に懸濁させた。
8. 懸濁液をフローサイトメーターを用いて解析した。
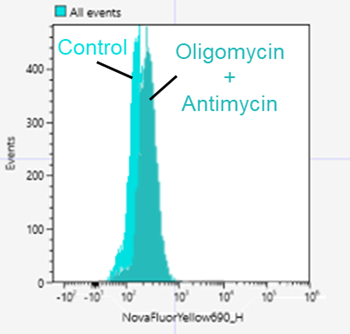
<測定条件>
使用装置: SONY社製 SA3800
Nova fluor Yellow 690(励起波長:561nm, 蛍光波長:655-735 nm)
※PE-AF610またはAPC-Cy5.5で測定実績があります。
取扱条件
| 保存条件: 冷蔵,遮光 , 取扱条件: 窒素置換,吸湿注意 |