ROS Assay Kit -Photo-oxidation Resistant DCFH-DA-
耐光性トータルROS検出キット
- ROS 発生の継時変化が観察可能
- 染色後のPFA固定化や免疫染色法の共染色が可能
- 色素の高感度化により多くの測定装置に対応
-
製品コードR253 ROS Assay Kit -Photo-oxidation Resistant DCFH-DA-
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 100 tests | ¥38,500 | 345-09981 |

モニタリング動画を公開中
実験例:「活性化マクロファージの死細胞におけるROS生産のライブセルハイコンテントイメージング」をご参照ください。
| 100 tests | ・Photo-oxidation Resistant DCFH-DA Dye ・Loading Buffer (10x) |
100 nmol×1 1.0 ml×1 |
|---|
性質
ROS (Reactive oxygen species) は主にミトコンドリアでの ATP 合成過程で発生する反応性の高い酸素種です。 情報伝達のシグナル物質としての役割や、マクロファージなどの免疫機能の一部として重要である一方、DNA やタンパク質に対し酸化剤として作用することで様々な疾病や老化を引き起こす要因となります。 細胞内の ROS を検出するには、一般的に低分子蛍光色素 DCFH-DA が広く使われていますが、感度が低く染色後に細胞から漏れ出てしまう点や、観察光によって自動酸化され発蛍光してしまう点で課題があります1)。
ROS Assay Kit -Photo-oxidation Resistant DCFH-DA- は、これらの課題を克服した製品です。既存の DCFH-DA より感度が高く、細胞内に取り込まれた後にタンパク質と共有結合するため細胞外に漏れ出ることはありません。また、観察光による自動酸化が抑えられているため経時的な ROS 検出が可能です。さらには、キット付属の Buffer を使って染色することで、より確実に細胞内の ROS 検出を行う事ができます。
1) M. Afzal, et al.,"Method to overcome photoreaction, a serious drawback to the use of dichlorofluorescin in evaluation of reactive oxygen species" BBRC, 2003, 304, 619–624.
マニュアル
技術情報
ROS測定の大きな課題
測定のバラつき、高いバックグラウンド、撮像時のピントが合わない状況は、色素が観察光により偽応答していることが原因として考えられます。本キットではこちらの課題を解決できる可能性があります。

※照射する励起光が強すぎる場合や長時間の励起光照射を行うと、自動酸化によりバックグラウンドが高くなる場合があります。
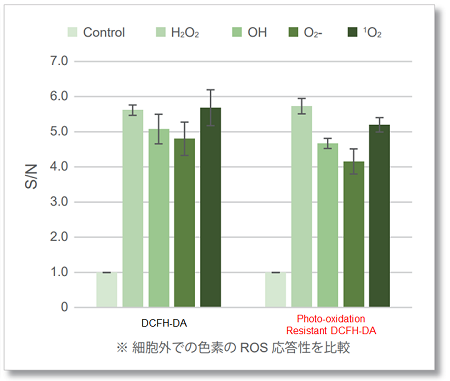
活性酸素種に対する反応選択性
Photo-oxidation Resistant DCFH-DAは活性酸素種(ROS)に対して、DCFH-DAと同様の反応性を示します。
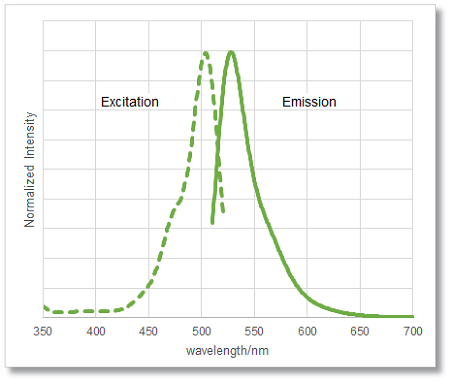
また、DCFH-DAと同様の蛍光特性(λex:505 nm、λem:525 nm)を持つため、同じ励起・蛍光波長での検出が可能です。
比較表:既存試薬との性能
弊社ROS Assay Kit -Highly Sensitive DCFH-DA-を含む、一般的に知られている既存色素との比較表を下記に示します。
| 同仁化学研究所 | T社 | |||
|---|---|---|---|---|
| 品コード | R253 | R252 | - | - |
| 製品名 |
本製品 |
D色素 | C色素 | |
|
耐光性 |
◎ |
× |
× |
× |
| 固定化操作 |
◎ |
× |
× |
○ |
|
感度 |
○ |
◎ |
△ |
△ |
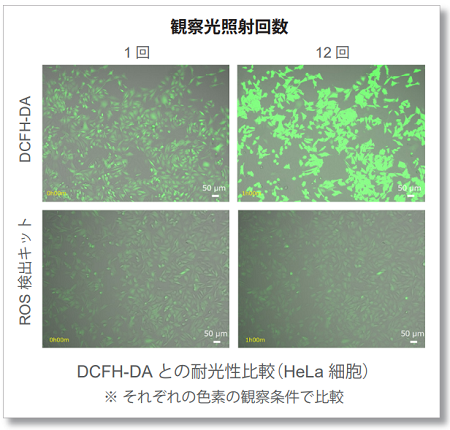
タイムラプス撮影: 観察光照射による自動酸化の低減
刺激をしていないHeLa細胞に既存色素またはPhoto-oxidation Resistant DCFH-DAで染色し、5分おきに励起光を照射しタイムラプスイメージングを行いました。結果、DCFH-DAは励起光が照射されるにつれ蛍光強度が増加しましたが、Photo-oxidation Resistant DCFH-DAは観察時の励起光による 自動酸化を大幅に抑制していることが分かりました。
タイムラプス撮影
<Experimental Conditions>
Cell Line: HeLa (without stimulation)
Epifluorescence microscope (BZ-X800, KEYENCE)
GFP Filter: Ex = 450 - 490 nm, Em = 500 - 550 nm
Time interval: 5 min.
Exposure time: 1.5 sec.
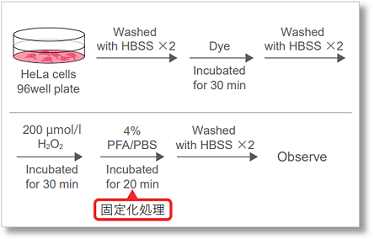
染色後の固定化操作に対応可能
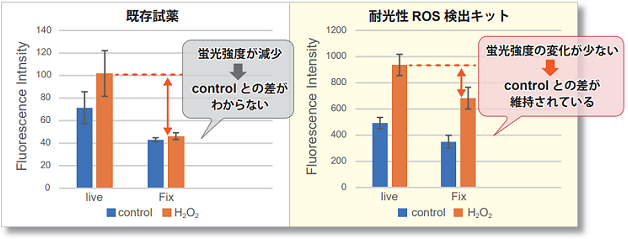
一般的に、細胞に固定化処理を行うと細胞内に存在する試薬の多くは細胞外へ漏出します。これは生細胞染色と比べて固定化細胞での ROS 検出 が難しくなる要因の一つとなります。本キットを用いて染色した HeLa 細胞に過酸化水素を添加後、PFA で固定化を行い、コントロール細胞と比 較をしました。結果、滞留性を高めた本キットは、固定化後もコントロールとの差を維持できることが判りました。
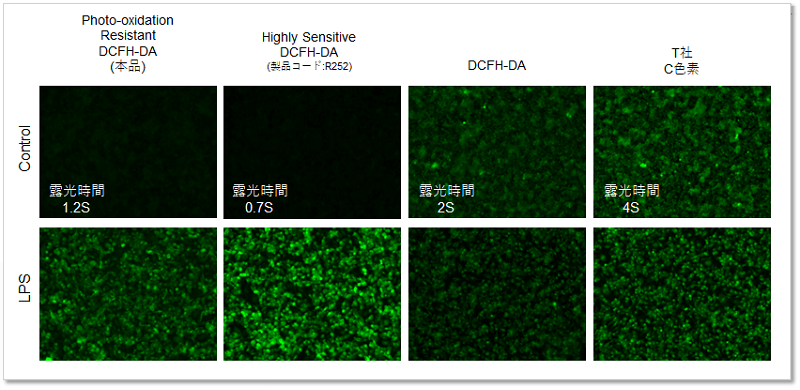
検出感度の比較
RAW264.7細胞にリポポリサッカライド (Lipopolysaccharide: LPS)処理したマクロ―ファージ細胞を既存色素またはPhoto-oxidation Resistant DCFH-DAで染色し、細胞内ROSの検出能を比較しました。 結果、いずれの検出装置においてもROS Assay Kit -Photo-oxidation Resistant DCFH-DA-を含む同仁化学製品は既存色素よりも高感度に細胞内のROSを検出できることがわかりました。
①蛍光顕微鏡での検出
※各蛍光色素の最適な観察条件で比較
<検出条件>
GFPフィルター: Ex = 450 - 490 nm, Em = 500 - 550 nm)
②蛍光プレートリーダーでの検出
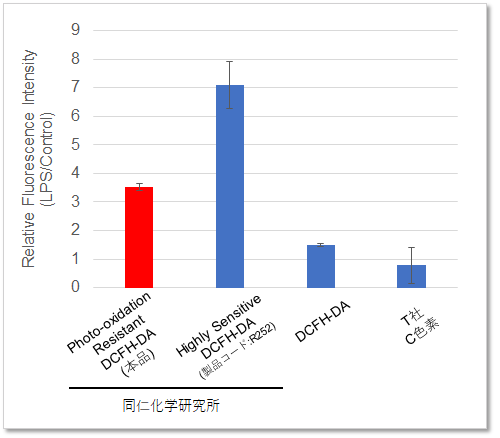
<検出条件>
Ex = 490 - 520 nm, Em = 510 - 540 nm
③フローサイトメーターでの検出
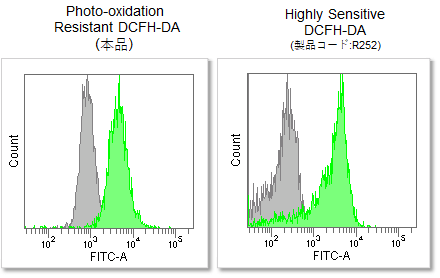
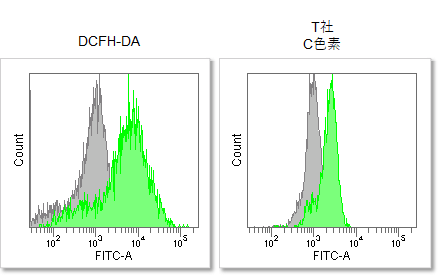
<検出条件>
Ex = 488 nm, Em = 515 - 545 nm
実験例:LPS処理したマクロファージの経時的なROS検出
ROS Assay Kit -Photo-oxidation Resistant DCFH-DA-を用いて染色したRAW264.7 細胞を、LPS(Lipopolysaccharide)処理し細胞内ROSの変化をタイムラプスイメージングしました。結果、LPS処理によって細胞内のROSが経時的に増加することがわかりました。さらに、得られた結果を数値化したところ、LPS添加後10時間からROSが顕著に増加する結果が得られました。

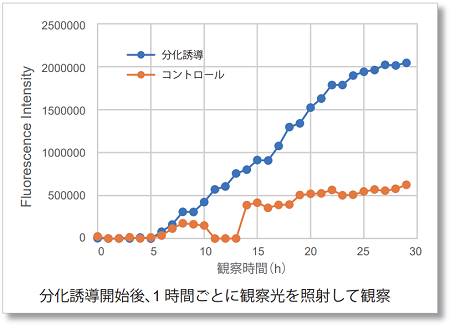
撮影動画
<検出条件>
細胞内ROS(Photo-oxidation Resistant DCFH-DA Dye): GFPフィルター(Ex = 450 - 490 nm, Em = 500 - 550 nm)
<実験操作>
(1)96-well black plate に RAW264.7 細胞 (2×105 cells/ml, DMEM, 10% fetal bovine serum, 1% penicillin-streptomycin) を播種
(2) インキュベーター内(37℃、5% CO2存在下)で一晩培養
(3) 培地を取り除き、HBSSで細胞を2回洗浄後、Photo-oxidation Resistant DCFH-DA Dye Working Solution を添加
(4) インキュベーター内 (37℃、 5% CO2存在下)で30 分間インキュベート
(5) Working solutionを除去し、HBSSを用いて細胞を2回洗浄後にDMEM 培地で希釈した 500 ng/ml 濃度の LPS/DMEMを添加
(6) 蛍光顕微鏡でタイムラプスイメージングを実施
(7) 時間毎の蛍光輝度を算出し数値化
実験例:ミトコンドリアマーカーTom 20 との共染色
本キットを用いて染色した HeLa 細胞に過酸化水素を添加後、 Tom20 抗体を用いた免疫染色法との共染色により、ROS 応答とミ トコンドリアの形態異常を同時に観察しました。結果、ROS 応答と ミトコンドリア形態の状態を鮮明に観察でき、既存色素では困難であった、免疫染色法との共染色ができることがわかりました。
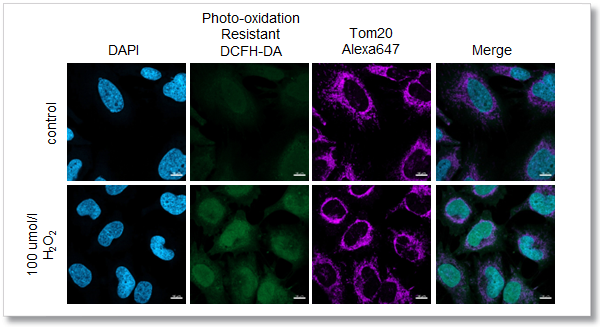
<検出条件>
共焦点レーザー顕微鏡
(青) DAPI: Ex = 405 nm, Em = 450-495 nm
(緑) Photo-oxidation Resistant DCFH-DA: Ex = 488 nm, Em = 500-550 nm
(紫) Alexa Fluor 647: Ex = 633 nm, Em = 640-700 nm
スケールバー:10 µm
実験例:活性化マクロファージにおけるROS生産のライブセルハイコンテントイメージング
免疫細胞は、炎症反応により異物を分解して体を正常に保つ役割を果たしています。異物によって刺激された免疫細胞は、ミトコンドリアでROS(Reactive Oxygen Species)を生産し、活性化マクロファージに分化して異物を分解します。一方で、過剰な炎症は、自己免疫疾患、アレルギー、糖尿病、アルツハイマー病など様々な疾病を引き起こす要因となることから、ROSを指標にして抗炎症薬のスクリーニングが行われています。
<実験>
Lipopolysaccharide (LPS) によって刺激されたマクロファージは、ミトコンドリアで ROS を生産して病原体や死細胞を貪食します。LPS によるマクロファージの刺激によって誘発される炎症反応を、ROS を指標として評価しました。ROSの検出には、ROS Assay Kit -Photo-oxidation Resistant DCFH-DA-を用い、ニコン倒立顕微鏡(Ti2-E)にて細胞の形態とROSの産生を確認しました。さらにVolume Contrast画像(後述)より細胞あたりのROSの変化を経時的に検出しました。
<結果>
細胞形態の観察、細胞数の測定
LPS刺激により、細胞あたりの細胞面積が増加しました(図1A)。また、コントロール細胞よりも細胞数の増加が抑制される結果が得られました(図1B)。
ROSの検出
視野全体の細胞数を測定し細胞あたりの蛍光強度を算出すると、撮影開始21時間後のLPS 1000 ng/mlは、500 ng/mlと比較し蛍光強度が高くLPS濃度が高い程細胞あたりのROS産生量が増加する結果が得られました(図2)。さらに、タイムラプス画像を観察すると、細胞分裂による細胞数の増加と、マクロファージによる死細胞の貪食による細胞数の減少及びROSの増加を確認しました(図3)。
従来のROS検出試薬は、励起光による自動酸化により経時変化測定や再現性の高い実験は困難でしたが、本実験に用いたROS Assay Kit -Photo-oxidation Resistant DCFH-DA-は、励起光による色素の自動酸化を低減し、さらに色素が細胞内に結合するため、ROSが産生された領域に特異的に蛍光が検出され、バックグラウンドが低く精度の高い解析が可能でした。また、色素の細胞内滞留性が高く、撮影開始から48時間後の画像でも高い蛍光強度が検出され、長時間にわたるROSの経時的な検出が可能になりました。
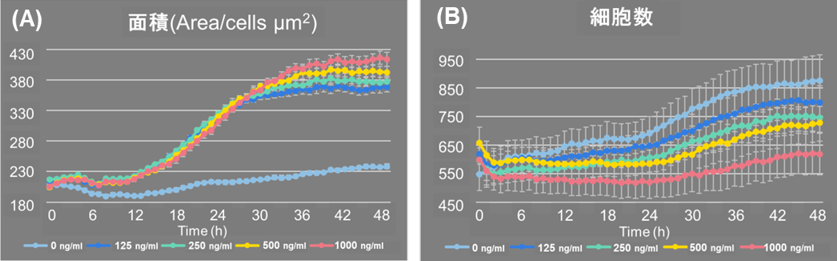
図1. LPS添加後の細胞数と細胞あたりの細胞面積の変化
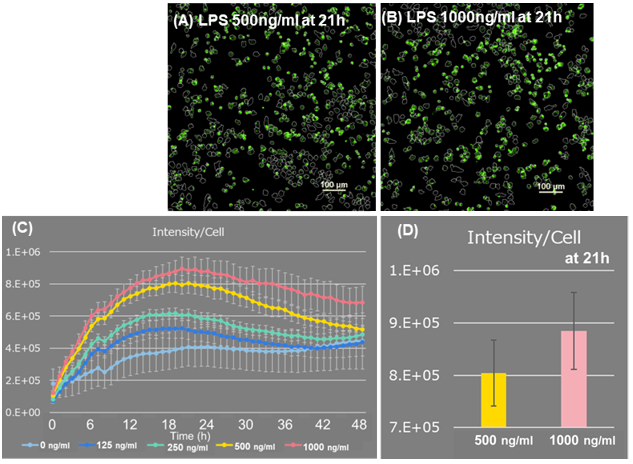
図2. ROSの蛍光強度解析
(A, B) LPS を添加後、21時間の蛍光画像 Scale bar: 100μm
(C, D) 1細胞あたりのROSの輝度値
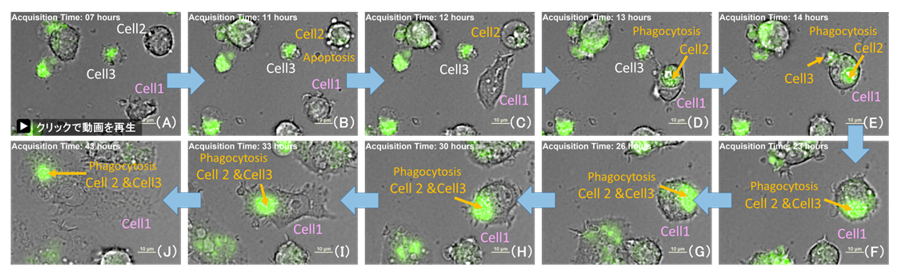
図3. 活性化マクロファージによる死細胞のファゴサイトーシス
LPS 500 ng/ml を添加したウェルのタイムラプス画像。緑:ROS, Scale bar:10μm
Cell2はアポトーシスを起こし(B)、1時間後に死細胞の形態を示した(C)。
Cell1は死滅したCell2とCell3を貪食し、ROSを増加させた(C-F)
※動画は下記をご覧ください。
*<細胞数の補正(Volume contrast(VC)画像))>
本実験では、細胞数の補正に「顕微鏡アドオンモジュール Volume Contrast」を用いました。
焦点面の異なる3枚の明視野画像から蛍光画像のような位相分布画像を構築できるVolume contrast(VC)画像を用いることで、
背景と細胞領域の識別を容易にし、また色素や励起光による毒性を受けずに細胞数の補正を行うことができました。
<使用装置>
ハイコンテンツアナリシス(HCA)顕微鏡システム
(株式会社ニコン https://www.microscope.healthcare.nikon.com/ja_JP/ )
※染色操作と解析法の詳細は、
株式会社ニコン「APPLICATION NOTE :活性化マクロファージにおけるROS生産のライブセルハイコンテントイメージング」よりご覧いただけます。
参考文献
| 文献No. | 対象サンプル | 装置 | 他の測定指標 (試薬) | 引用(リンク) |
|---|---|---|---|---|
| 1 | 細胞 (HaCaT, D66H) | 蛍光顕微鏡 (核染色: Hoechst33342) |
SOD, Lipid peroxidation, GSH/GSSG | Y. Chen, Z. Wang, Y. Song, N. Chen, J. Guo, W. Liu, K. Guo, X. Ling and L. Zhang,"4‐octyl itaconate improves the viability of D66H cells by regulating the KEAP1‐NRF2‐GCLC/HO‐1 pathway", J Cell Mol Med., 2022, doi: 10.1111/jcmm.17708. |
| 2 | 細胞 (髄核細胞) | 蛍光顕微鏡 (核染色: Hoechst33342) |
ミトコンドリア膜電位(MT-1) | K. Suyama, D. Sakai, S. Hayashi, N. Qu, H. Terayama, D. Kiyoshima, K. Nagahori and M. Watanabe,"Bag-1 Protects Nucleus Pulposus Cells from Oxidative Stress by Interacting with HSP70", Biomedicines., 2023, doi: 10.3390/biomedicines11030863. |
| 3 | 細胞 (HCC) | 蛍光顕微鏡 | GSH/GSSG, γH2AX, 細胞周期 | H. Liu, W. Zhang, L. Jin, S. Liu, L. Liang and Y. Wei,"Plumbagin Exhibits Genotoxicity and Induces G2/M Cell Cycle Arrest via ROS-Mediated Oxidative Stress and Activation of ATM-p53 Signaling Pathway in Hepatocellular Cells", Int. J. Mol. Sci., 2023, doi: 10.3390/ijms24076279. |
| 4 | 細胞 (ヒト臍帯血CD34+ 前駆細胞) |
フローサイトメーター | γH2AX | M. Sakurai, K. Ishitsuka, T. Ito, A. C. Wilkinson, T. Kimura, E. Mizutani, H. Nishikii, K. Sudo, H. J. Becker, H. Takemoto, T. Sano, K Kataoka, S. Takahashi, Y. Nakamura, D. G. Kent, A. Iwama, S. Chiba, S. Okamoto, H. Nakauchi and S. Yamazaki, "Chemically defined cytokine-free expansion of human haematopoietic stem cells", Nature, 2023, doi:10.1038/s41586-023-05739-9. |
よくある質問
-
Q
1キットで測定可能なサンプル数を教えてください。
-
A
測定可能なサンプル数は以下をご参考ください。
・ 96-well plate:1枚
・ ibidi 8-well plate:6枚
・ 35 mm dish:5枚
・ 6-well plate:5ウェル
-
Q
ポジティブコントロールになる実験例はありますか?
-
A
取扱説明書に過酸化水素処理をしたHeLa細胞による検出例を掲載しております。実験例2の項目の操作1-5をご参考ください。
-
Q
Working SolutionはLoading Buffer以外でも調製できますか?
-
A
染色時の細胞へのダメージを軽減するため付属のLoading Bufferを推奨しますが、Hanks’ HEPESやHBSSでも調製できます。
培地で調製する場合は無血清培地をご使用ください。
-
Q
染色後の洗浄には、HBSSの代わりにPBSを使用できますか?
-
A
細胞へのダメージを軽減するためHBSSを推奨しております。
HBSSがお手元にない場合は培地での洗浄をお勧めします。
-
Q
フローサイトメーターで使用する際、細胞を剥がす操作はどの段階で行えば良いですか?
-
A
取扱説明書 操作6の後(薬剤処理しHBSSで洗浄した後)に細胞を剥がす操作(トリプシン処理)を行ってください。
トリプシン処理後は、培地を添加し反応を止めた後、遠心しHBSSで1回洗浄後、さらに遠心しHBSSで細胞を懸濁して測定サンプルとしてください。
取扱条件
| 保存条件: 冷蔵 , 取扱条件: 吸湿注意 |