JC-1 MitoMP Detection Kit
ミトコンドリア膜電位検出キット
-
製品コードMT09 JC-1 MitoMP Detection Kit
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 1 set | ¥27,300 | 349-09401 |
| 1 set | JC-1 Dye Imaging Buffer (10x) |
100 nmol x1 11 ml x1 |
|---|
概要
JC-1 MitoMP Detection Kitは、ミトコンドリア膜電位を測定できるキットです。
従来、JC-1は染色溶液調製の際、溶けづらい等の課題がありますが、本キットは溶液調製方法によりそれを克服しております。さらに、本キットに含まれるImaging Bufferを用いることにより、蛍光バックグラウンドを抑えながら細胞にダメージを与えにくい状態で、細胞を観察することができます。
本キットは、従来よりミトコンドリア膜電位検出に使用されているJC-1色素と解析用のバッファーが含まれています。初めての方も使い易いよう、難溶性色素の溶解プロトコルをはじめ、様々なアプリケーションをご用意しています。
ミトコンドリア形態観察・ミトコンドリア膜電位観察のコツ
実験成功のための「購入前の抑えるポイント・実験のコツ」について、実際に小社で取得したデータを用い動画で判りやすく解説しています。
-
① ミトコンドリア形態・動態観察のコツ [2:10~]
1.染色方法の選定
低分子蛍光色素・蛍光タンパクの遺伝子発現・免疫染色法 2.染色色素の特性を理解する
蛍光特性、染色後の結合性、染色の方法 3.観察時の確認事項と検討方法
蛍光の漏込・Z軸の情報・タイムラプスイメージング
-
② ミトコンドリア膜電位観察のコツ [16:17~]
-
既存の低分子色素「JC-1, TMRE,TMRM, MT-1」について 1.各色素の特性
2.耐光性とタイムラプスイメージング
3.固定化操作の影響
マニュアル
技術情報
ミトコンドリア膜電位を測る意義と各試薬の比較
ミトコンドリアは、ATP 等のエネルギー産生の場であり、その活性の変化や機能障害ががんや老化、神経変性疾患などと密接に関連しています。そのためミトコンドリアの状態を理解することが重要であり、その指標としてエネルギー産生に伴い生じる膜電位差が評価されています。
ミトコンドリア膜電位の測定には、古くからJC-1が用いられており最も汎用されています。またTMREも広く使用されています。小社ではJC-1の使いにくさを改良したJC-1 MitoMP Detection Kitとさらに詳細にミトコンドリア膜電位を解析したい方向けの製品(MT-1 MitoDetection Kit)をラインアップしております。ご自身のご研究に併せてご選択ください。
| 化合物(製品名) | 特徴 |
固定化 |
感度 | モニタリング | 装置の対応 | 検出 |
|---|---|---|---|---|---|---|
|
JC-1 |
※初めての方へオススメ ・JC-1の溶けにくいを解消 ・キット化で簡便な測定 ・論文実績が最も多い |
× | △ | × |  |
緑 Ex :450-490 nm Em:500-550 nm 赤 Ex :530-560 nm Em:570-640 nm |
|
MT-1 |
※より詳細に解析したい方へオススメ |
〇 | 〇 | 〇 |  ※プレートリーダーの実績有 |
赤 Ex :530-560 nm Em:570-640 nm |
| TMRE | ・ミトコンドリア膜電位の検出に広く使用されている | × | 〇 | × |  |
赤 Ex :530-560 nm Em:570-640 nm |
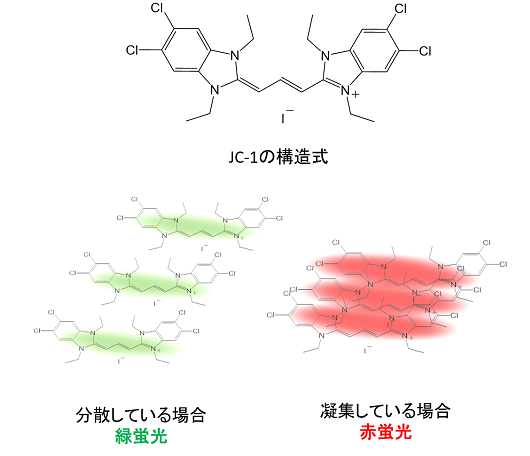
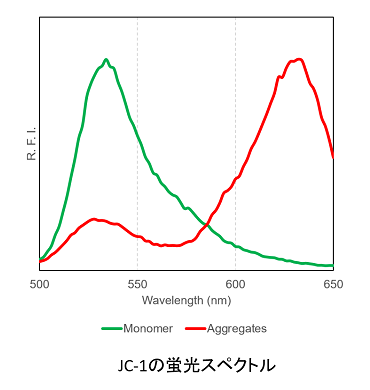
JC-1の化学構造と性質
JC-1は、ミトコンドリアが正常で膜電位差が保たれた状態では凝集し赤色の蛍光を発し、膜電位が低下すると、JC-1 が単量体として存在し緑色の蛍光を発します。この赤色と緑色の蛍光強度の変化をミトコンドリアの状態として評価することができます。
JC-1の化学構造は左図に示すジアゾールをベースとしたシアニン骨格の蛍光色素です。構造内に持つカチオン性の電位は、ミトコンドリア内膜の電位と親和性があるため、ミトコンドリア膜電位に応じて色素がミトコンドリアへ蓄積します(左:JC-1の構造式)。ミトコンドリア内における蓄積されたJC-1の濃度が低い場合は緑蛍光を発し、濃度が高い場合は、色素が凝集し赤色蛍光を示します(右:JC-1の蛍光スペクトル)。この性質を利用し、JC-1はミトコンドリア膜電位を表現します。
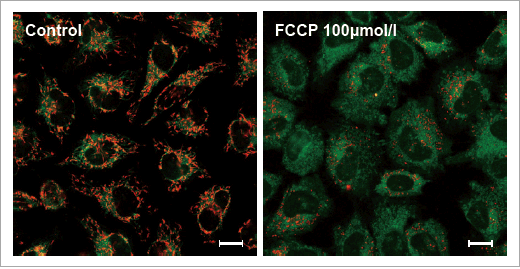
実験例:脱分極による評価
HeLa 細胞を脱分極剤であるcarbonylcyanide-p-trifluoromethoxyphenylhydrazone(FCCP)にて処理し、本キットで膜電位の変化を評価しました。
結果、未処理の細胞では、ミトコンドリア全体が赤く染まり、FCCP で処理した細胞は赤色蛍光の減少が確認されました。
|
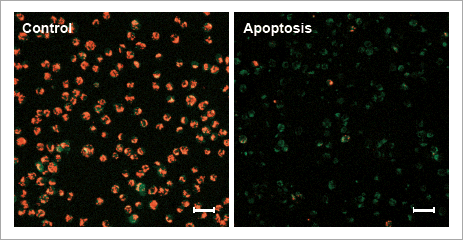
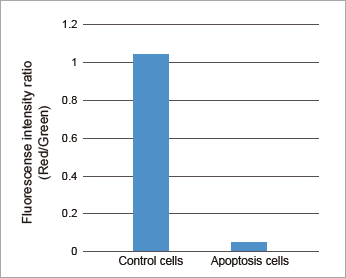
実験例:アポトーシス誘導時の評価
下記、評価例の操作方法は、本品の取扱説明書にてご覧いただけます。
蛍光顕微鏡
アポトーシス誘導により変化した膜電位を色の変化で明瞭にイメージング
|
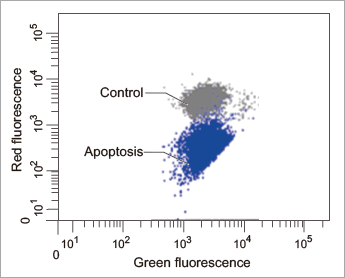
フローサイトメーター
個々の細胞の膜電位変化を定量解析 (汎用のフィルターに対応)
|
プレートリーダー
ウェル中のすべての細胞を対象に膜電位の変化を確認 (多検体処理に対応)
|
実験例:ミトコンドリアスーパーオキサイドと膜電位の同時測定
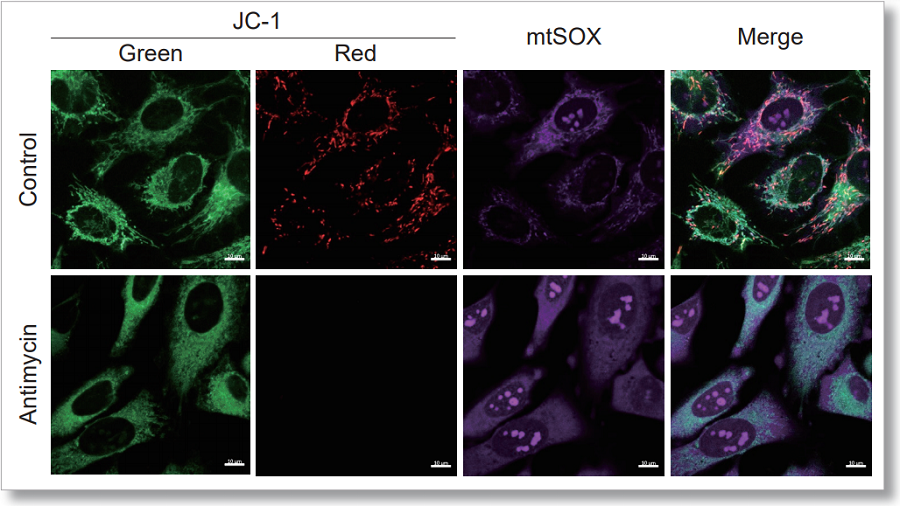
HeLa細胞をHBSSにて洗浄後、JC-1 MitoMP Detection Kitと小社スーパーオキサイド検出試薬(mtSOX Deep Red : 製品コードMT14)を用いて共染色し、発生したミトコンドリアROSと膜電位を同時に観察しました。
その結果、いずれの条件でもミトコンドリアROSの発生に伴うミトコンドリア膜電位の低下を同時に観察することが出来ました。
<実験操作>
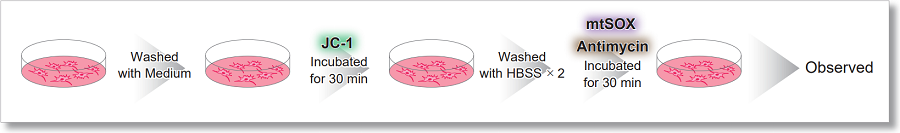
検出条件(共焦点レーザー蛍光顕微鏡)
JC-1 :緑 Ex = 488, Em = 490-520 nm, 赤 Ex = 561, Em = 560-600 nm
mtSOX :Ex = 633 nm, Em = 640-700 nm
スケールバー:10 µm
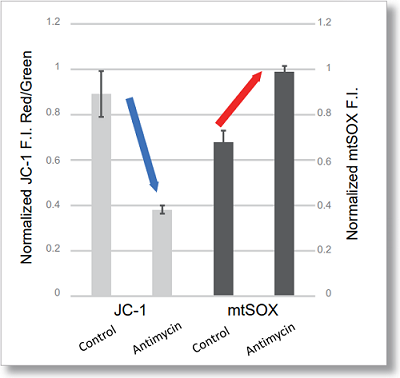
検出条件(マイクロプレートリーダー)Tecan, Infinite M200 Pro
JC-1 :緑 Ex = 480-490 nm, Em = 525-545 nm, 赤 Ex = 530-540 nm, Em = 585-605 nm
mtSOX :Ex = 545-555 nm, Em = 665-685 nm
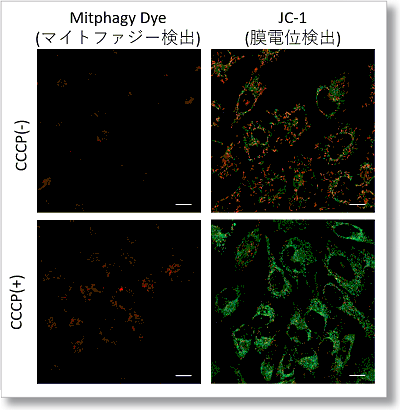
実験例:マイトファジー誘導とミトコンドリア膜電位変化の検出
Parkin発現HeLa細胞を用いて、CCCP(carbonyl cyanide m-chlorophenyl hydrazone)添加の有無によるミトコンドリアの状態を、マイトファジー検出キット(Mitophagy Detection Kit:MD01)及びミトコンドリア膜電位検出キット(JC-1 MitoMP Detection Kit: MT09)にて評価しました。
結果、CCCP未処理の細胞ではマイトファジーは殆ど検出されず、またミトコンドリア膜電位が正常に維持されていることが確認されました。一方、CCCPを添加した細胞では、ミトコンドリア膜電位の低下(JC-1の赤色蛍光減少)とマイトファジーの誘導(Mtphagy Dyeの蛍光増大)を確認しました。
|
実験条件
HeLa細胞へのParkin プラスミドの導入
HilyMax(製品コード:H357)を用いてHeLa細胞へParkin プラスミドを導入(Parkin プラスミド/HilyMax reagent : 0.1 μg/0.2 μl)
し,一晩培養後の細胞を用いて下記検出を行った。
マイトファジー検出
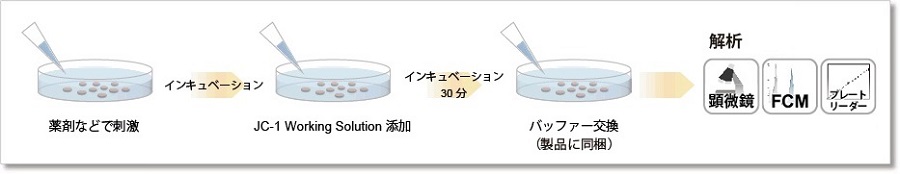
Parkin発現HeLa細胞に0.1 μmol/l Mtphagy working solution を添加し37 ℃で30分間インキュベートした。その後、細胞をHBSSにて洗浄し、10 μg/ml CCCP/MEM 溶液を添加し、37 ℃にて2時間インキュベートした。処理した細胞を、蛍光顕微鏡にて観察した。
ミトコンドリア膜電位検出
Parkin発現HeLa細胞に10 μg/ml CCCP/MEM 溶液を添加し、37℃にて1.5時間インキュベートした。そこへ終濃度2 μmol/lとなるように4 μmol/l JC-1 working solutionを添加し、37 ℃で30分間インキュベートした。インキュベート後、HBSSを用いて細胞を洗浄しImaging Buffer solutionを添加後、蛍光顕微鏡にて観察した。
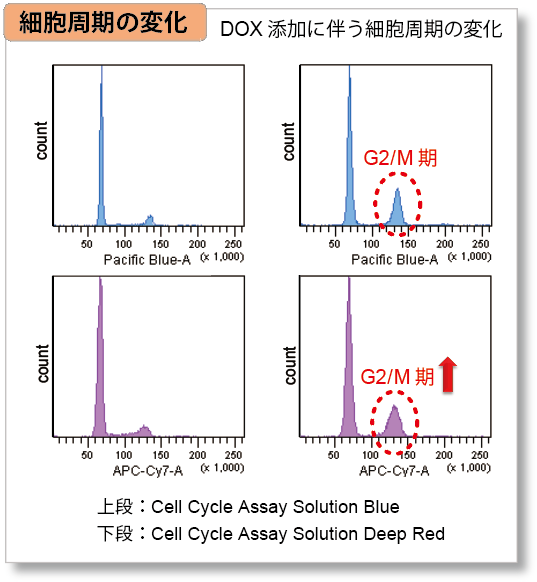
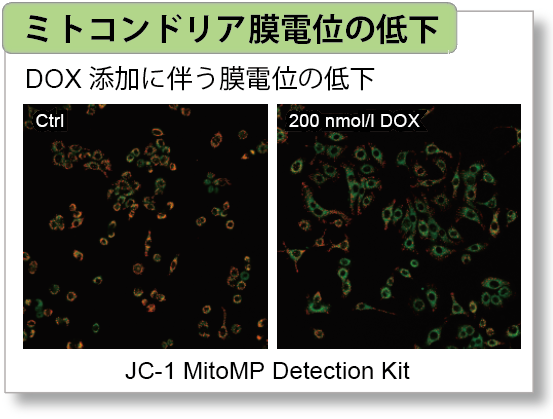
実験例:ミトコンドリア膜電位、老化、細胞周期との関連性
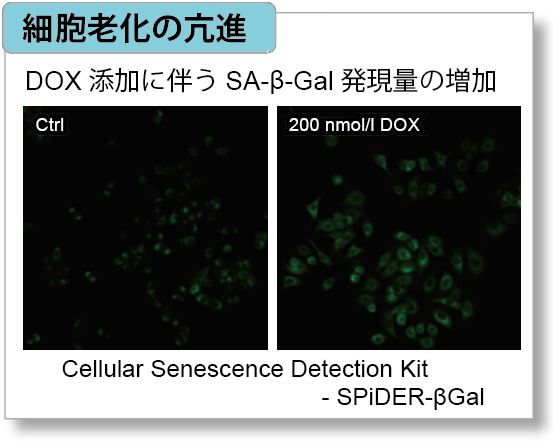
細胞周期のG2/M 期に作用して細胞増殖を停止させ、細胞老化を誘導することが知られているDoxorubicin(DOX) をA549 細胞へ添加後、Cell Cycle Assay Solution Blue (製品コード:C549)/ Deep Red(製品コード:C548)でA549 細胞における細胞周期の変化と、Cellular Senescence Detection Kit - SPiDER-βGal(製品コード:SG03)で細胞老化、本製品でミトコンドリア膜電位の変化を確認しました。
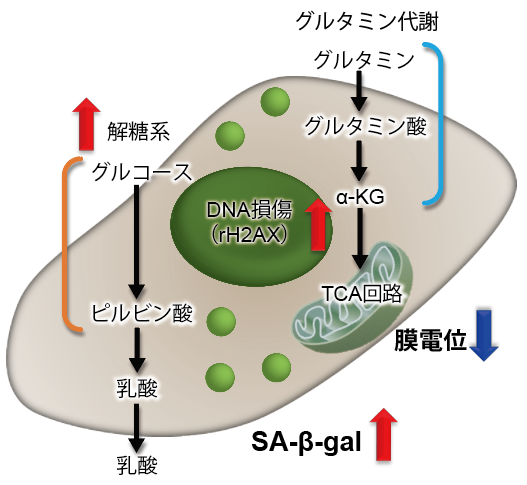
実験例:老化誘導によるA549細胞の代謝シフト
細胞老化が誘導されると、SA-β-galの発現亢進や不可逆的な細胞増殖停止といった現象が見られる他、DNAダメージが蓄積した老化細胞では、ミトコンドリア機能の低下によりエネルギー産生を解糖系にシフトします。そこで、A549細胞をDoxorubicinで処理し老化誘導した際のSA-β-gal発現亢進およびエネルギー産生経路(NAD量、ミトコンドリア膜電位、ATP量、Lactate放出量)のシフトを確認しました。
その結果、DNA損傷が認められましたが、SA-β-gal(Senescence Assosiated -β- Galactosidase)産生量が増加し、細胞内 NAD+ 量が低下したことからミトコンドリア膜電位が低下し、エネルギー生産経路が酸化的リン酸化から解糖系へシフトしたことが確認されました。
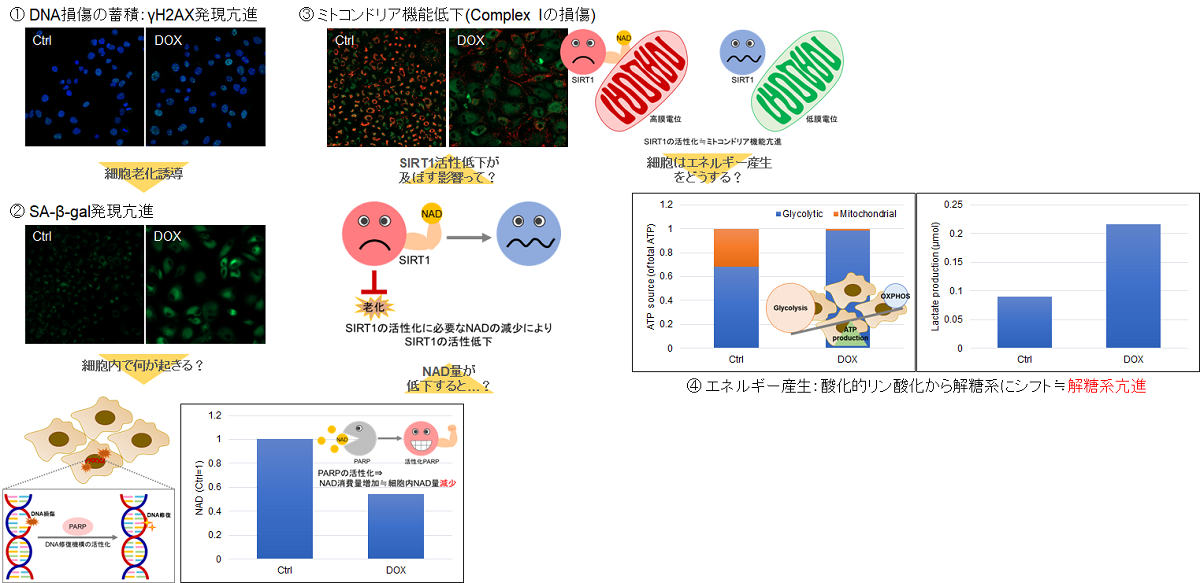
<使用製品>
DNAの損傷:DNA Damage Detection Kit - γH2AX (製品コード:G265)
SA-β-gal発現量:Cellular Senescence Detection Kit - SPiDER-βGal (製品コード:SG03)
NAD+量:NAD/NADH Assay Kit-WST (製品コード:N509)
ミトコンドリア膜電位:JC-1 MitoMP Detection Kit (製品コード:MT09)
代謝シフト(ATP量, Lactate放出量):Glycolysis/OXPHOS Assay Kit (製品コード:G270)
参考文献
細胞種別の参考文献を掲載しています。(細胞名:英数順)
| 文献No. | 対象サンプル | 装置 | 引用(リンク) |
|---|---|---|---|
| 1 | 細胞 (A549) |
蛍光顕微鏡 | K. Li, S. Sun, L. Xiao and Z. Zhang,"Bioactivity-guided fractionation of Helicteres angustifolia L. extract and its molecular evidence for tumor suppression", Front Cell Dev Biol.,2023, doi: 10.3389/fcell.2023.1157172. |
| 2 | 細胞 (A549) |
フローサイトメーター | C. N. D’Alessandro-Gabazza, T. Yasuma, T. Kobayashi, M. Toda1, A. M. Abdel-Hamid, H. Fujimoto, O. Hataji, H. Nakahara, A. Takeshita, K. Nishihama, T. Okano, H. Saiki, Y. Okano, A. Tomaru, V. F. D’Alessandro, M. Shiraishi, A. Mizoguchi, R. Ono, J. Ohtsuka, M. Fukumura, T. Nosaka, X. Mi, D. Shukla, K. Kataoka, Y. Kondoh, M. Hirose, T. Arai, Y. Inoue, Y. Yano, R. I. Mackie, I. Cann and E. C. Gabazza, "Inhibition of lung microbiota-derived proapoptotic peptides ameliorates acute exacerbation of pulmonary fibrosis", Nat. Comm., 2022, doi:10.1038/s41467-022-29064-3. |
| 3 | 細胞 (A549, HeLa) |
プレートリーダー | J. Yang, L. Liu, Y. Oda, K. Wada, M. Ago, S. Matsuda, M. Hattori, T. Goto, Y. Kawashima, Y. Matsuzaki and T. Taketani,"Highly-purified rapidly expanding clones, RECs, are superior for functional-mitochondrial transfer", Stem Cell Res Ther., 2023, doi: 10.1186/s13287-023-03274-y. |
| 4 | 細胞 (ALM) |
プレートリーダー | T. Nechiporuk, S.E. Kurtz, O. Nikolova, T. Liu, C.L. Jones, A. D. Alessandro, R. C. Hill, A. Almeida, S. K. Joshi, M. Rosenberg, C. E. Tognon, A. V. Danilov, B. J. Druker, B. H. Chang, S. K McWeeney and J. W. Tyner , "The TP53 Apoptotic Network Is a Primary Mediator of Resistance to BCL2 Inhibition in AML Cells.", Cancer Discov, 2019, 9, |
| 5 | 細胞 (ARPE-19) |
フローサイトメーター、 蛍光顕微鏡 |
J. Hamuro, T. Yamashita, Y. Otsuki, N. Hiramoto, M. Adachi, T. Miyatani, H. Tanaka, M. Ueno, S. Kinoshita and C. Sotozono,"Spatiotemporal Coordination of RPE Cell Quality by Extracellular Vesicle miR-494-3p Via Competitive Interplays With SIRT3 or PTEN", Invest Ophthalmol Vis Sci., 2023, doi: 10.1167/iovs.64.5.9. |
| 6 | 細胞 (ARPE-19) |
蛍光顕微鏡 | J. H. Quan, F. F. Gao, H. A. Ismail, J. M. Yuk, G. H. Cha, J. Q. Chu and Y. H. Lee, "Silver Nanoparticle-Induced Apoptosis in ARPE-19 Cells Is Inhibited by Toxoplasma gondii Pre-Infection Through Suppression of NOX4-Dependent ROS Generation", Int J Nanomedicine., 2020, 15, 3695–3716. |
| 7 | 細胞 (C2C12 myocytes) |
- | Z. Jing, T. Iba, H. Naito, P. Xu, J.I. Morishige, N. Nagata, H. Okubo and H.Ando ,"L-carnitine prevents lenvatinib-induced muscle toxicity without impairment of the anti-angiogenic efficacy", Front Pharmacol., 2023, doi: 10.3389/fphar.2023.1182788. |
| 8 | 細胞 (C2C12, 3T3L1) |
プレートリーダー | M. Kurano, K. Tsukamoto, T. Shimizu, H. Kassai, K. Nakao, A. Aiba, M. Hara and Yatomi , "Protection Against Insulin Resistance by Apolipoprotein M/Sphingosine 1-Phosphate ", Diabetes, 2020, DOI: 10.2337/db19-0811. |
| 9 | 細胞 (Colon 26) |
蛍光顕微鏡 | B. Uranbileg, M. Kurano, K. Kano, E. Sakai, J. Arita, K. Hasegawa, T. Nishikawa, S. Ishihara, H. Yamashita, Y. Seto, H. Ikeda, J. Aoki and Y. Yatomi,"Sphingosine 1‐phosphate lyase facilitates cancer progression through converting sphingolipids to glycerophospholipids", Clin Transl Med., 2022, doi: 10.1002/ctm2.1056. |
| 10 | 組織 (Frozen heart slides) |
蛍光顕微鏡 | W. Yu, Y. Hu, Z. Liu, K. Guo, D. Ma, M. Peng, Y. Wang, J. Zhang, X. Zhang, P. Wang, J. Zhang, P. Liu and J. Lu,"Sorting nexin 3 exacerbates doxorubicin-induced cardiomyopathy via regulation of TFRC-dependent ferroptosis", Acta Pharmaceutica Sinica B., 2023, doi: https://doi.org/10.1016/j.apsb.2023.08.016. |
| 11 | 細胞 (HCE) |
蛍光顕微鏡 | T. Yamashita, K. Asada, M. Ueno, N. Hiramoto, T. Fujita, M. Toda, C. Sotozono, S. Kinoshita and J. Hamuro,"Cellular interplay through extracellular vesicle miR-184 alleviates corneal endothelium degeneration", Ophthalmol Sci., 2022, doi: 10.1016/j.xops.2022.100212. |
| 12 | 細胞 (HCE) |
蛍光顕微鏡 | M. Ueno, K Yoshii, T. Yamashita, K. Sonomura, K. Asada, E. Ito, T. Fujita, C. Sotozono, S. Kinoshita and J. Hamuro,"The Interplay Between Metabolites and MicroRNAs in Aqueous Humor to Coordinate Corneal Endothelium Integrity", Ophthalmol Sci., 2023, doi: 10.1016/j.xops.2023.100299. |
| 13 | 細胞 (HCE-T) |
- | W. Otsu, T. Yako, E. Sugisawa, S. Nakamura, H. Tsusaki, N. Umigai, M. Shimazawa and H. Hara,"Crocetin protects against mitochondrial damage induced by UV-A irradiation in corneal epithelial cell line HCE-T cells", J Pharmacol Sci., 2022, doi: 10.1016/j.jphs.2022.10.005. |
| 14 | 細胞 (HCE-T) |
蛍光顕微鏡 | K. Ishida, T. Yako, M. Tanaka, W. Otsu, S. Nakamura, M. Shimazawa, H. Tsusaki and H. Hara,"Free-radical scavenger NSP-116 protects the corneal epithelium against UV-A and blue led light exposure", Biol Pharm Bull., 2021, doi: 10.1248/bpb.b21-00017. |
| 15 | 細胞 (HepG) |
蛍光顕微鏡、 分光光度計 |
M. Ikura, K. Furuya, T. Matsuda and T. Ikura,"Impact of Nuclear De Novo NAD+ Synthesis via Histone Dynamics on DNA Repair during Cellular Senescence To Prevent Tumorigenesis", Mol Cell Biol., 2022, doi: 10.1128/mcb.00379-22. |
| 16 | 細胞 (hiPSCs, Neurons) |
蛍光顕微鏡 | T. Hara, M. Toyoshima, Y. Hisano, S. Balan, Y. Iwayama, H. Aono,Y. Futamura, H. Osada, Y. Owada and T. Yoshikawa,"Glyoxalase I disruption and external carbonyl stress impair mitochondrial function in human induced pluripotent stem cells and derived neurons", Translational Psychiatry., 2021, doi: 10.1038/s41398-021-01392-w. |
| 17 | 細胞 (HSCs; LX-2,T6) |
蛍光顕微鏡 | Y. Su, S. Lu, C. Hou, K. Ren, M. Wang, X. Liu, S. Zhao and X. Liu ,"Mitigation of liver fibrosis via hepatic stellate cells mitochondrial apoptosis induced by metformin", International Immunopharmacology., 2022, doi: 10.1016/j.intimp.2022.108683. |
| 18 | 細胞 (HUVECs) |
蛍光顕微鏡 | D. Ueno, K. Ikeda, E. Yamazaki, A. Katayama, R. Urata and S. Matoba ,"Spermidine improves angiogenic capacity of senescent endothelial cells, and enhances ischemia-induced neovascularization in aged mice", Sci Rep., 2023, doi: 10.1038/s41598-023-35447-3. |
| 19 | 細胞 (KYSE30) |
蛍光顕微鏡 | Q. Luo, X. Wu, P. Zhao, Y. Nan, W. Chang, X. Zhu, D. Su and Z. Liu,"OTUD1 activates caspase‐independent and caspase‐dependent apoptosis by promoting AIF nuclear translocation and MCL1 degradation", Adv Sci (Weinh)., 2021, doi: 10.1002/advs.202002874. |
| 20 | 細胞 (Macrophage) | 蛍光顕微鏡 | G. Yang, M. Fan, J. Zhu, C. Ling, L. Wu, X. Zhang, M. Zhang, J. Li, Q. Yao, Z. Gu and X. Cai, "A multifunctional anti-inflammatory drug that can specifically target activated macrophages massively deplete intracellular H2O2 and produce large amounts CO for a highly efficient treatment of osreoarthritis" , Biomaterials, 2020, doi:10.1016/j.biomaterials.2020.120155. |
| 21 | 細胞 (MDA-MB-415, MCF-7) |
蛍光顕微鏡 | S.Y. Park, K.J. Jeong, A. Poire, D. Zhang, Y.H. Tsang, A.S. Blucher and G.B. Mills ,"Irreversible HER2 inhibitors overcome resistance to the RSL3 ferroptosis inducer in non-HER2 amplified luminal breast cancer", Cell Death & Disease., 2023, doi: 10.1038/s41419-023-06042-1. |
| 22 | 細胞 (MIN6) |
プレートリーダー、 蛍光顕微鏡 |
N. Mizusawa, N. Harada, T. Iwata, I. Ohigashi, M. Itakura and K. Yoshimoto,"Identification of protease serine S1 family member 53 as a mitochondrial protein in murine islet beta cells", Islets., 2022, doi: 10.1080/19382014.2021.1982325. |
| 23 | 細胞 (MSCs) |
フローサイトメーター | S.Y. Jo, H.J. Cho and T.M. Kim,"Fenoldopam mesylate enhances the survival of mesenchymal stem cells under oxidative stress and increases the therapeutic function in acute kidney injury", Cell Transplant., 2023, doi: 10.1177/09636897221147920. |
| 24 | 細胞 (Neuro-2A) |
蛍光顕微鏡、 プレートリーダー |
Y. Wang, Y. Shinoda, A. Cheng, I. Kawahata and K. Fukunaga,"Epidermal fatty acid-binding protein 5 (FABP5) Involvement in alpha-synuclein-induced mitochondrial injury under oxidative stress", Biomedicines., 2021, doi: 10.3390/biomedicines9020110. |
| 25 | 細胞 (Neuron) |
蛍光顕微鏡 | I. Kawahata, L. Luc Bousset, R. Melki and K. Fukunaga , "Fatty Acid-Binding Protein 3 is Critical for α-Synuclein Uptake and MPP+-Induced Mitochondrial Dysfunction in Cultured Dopaminergic Neurons ", Int J Mol Sci., 2019, 20, 5358. |
| 26 | 細胞 (Neuron) |
蛍光顕微鏡 | A. Fukuda, S. Nakashima,Y. Oda, K. Nishimura, H. Kawashima, H. Kimura, T. Ohgita, E. Kawashita, K. Ishihara, A. Hanaki, M. Okazaki, E. Matsuda, Y. Tanaka, S. Nakamura, T. Matsumoto, S. Akiba, H. Saito, H. Matsuda and K. Takata,"Plantainoside B in Bacopa monniera Binds to Aβ Aggregates Attenuating Neuronal Damage and Memory Deficits Induced by Aβ", Biol Pharm Bull., 2023, doi: 10.1248/bpb.b22-00797. |
| 27 | 細胞 (PAECs) |
プレートリーダー | T. Sakai, H. Takagaki, N. Yamagiwa, M. Ui, S. Hatta and J. Imai,"Effects of the cytoplasm and mitochondrial specific hydroxyl radical scavengers TA293 and mitoTA293 in bleomycin-induced pulmonary fibrosis model mice", Antioxidants (Basel)., 2021, doi: 10.3390/antiox10091398. |
| 28 | 細胞 (PANC-1) |
プレートリーダー | W.A. Naime, A. Kimishima, A. Setiawan, J.R. Fahim, M.A. Fouad, M.S. Kamel and M. Arai,"Mitochondrial Targeting in an Anti-Austerity Approach Involving Bioactive Metabolites Isolated from the Marine-Derived Fungus Aspergillus sp.", Marine drugs., 2020, doi: 10.3390/md18110555. |
| 29 | 細胞 (PANC-1, MIAPaca-2) |
蛍光顕微鏡 | T. Taniai, Y. Shirai,Y. Shimada, R. Hamura, M. Yanagaki, N. Takada, T. Horiuchi, K. Haruki, K. Furukawa, T. Uwagawa, K. Tsuboi, Y. Okamoto, S. Shimada, S. Tanaka, T. Ohashi and T. Ikegami,"Inhibition of acid ceramidase elicits mitochondrial dysfunction and oxidative stress in pancreatic cancer cells", Cancer Sci., 2021, doi: 10.1111/cas.15123. |
| 30 | 細胞 (PC) |
フローサイトメーター | R. Hamura, Y. Shirai,Y. Shimada, N. Saito, T. Taniai, T. Horiuchi, N. Takada, Y. Kanegae, T. Ikegami, T. Ohashi and K. Yanaga ,"Suppression of lysosomal acid alpha‐glucosidase impacts the modulation of transcription factor EB translocation in pancreatic cancer", Cancer Sci., 2021, doi: 10.1111/cas.14921. |
| 31 | 細胞 (porcine oocytes) |
蛍光顕微鏡 | W. Hu, Y. Zhang, D. Wang, T. Yang, J. Qi, Y. Zhang, H. Jiang, J Zhang, B. Sun and S. Liang,"Iron Overload-Induced Ferroptosis Impairs Porcine Oocyte Maturation and Subsequent Embryonic Developmental Competence in vitro", Front Cell Dev Biol., 2021, doi: 10.3389/fcell.2021.673291. |
| 32 | 細胞 (porcine oocytes) |
蛍光顕微鏡 | Y. Xiao, B. Yuan, W. Hu, J. Qi, H. Jiang, B. Sun, J. Zhang and S. Liang,"Tributyltin Oxide Exposure During in vitro Maturation Disrupts Oocyte Maturation and Subsequent Embryonic Developmental Competence in Pigs", Front Cell Dev Biol., 2021, doi: 10.3389/fcell.2021.683448. |
| 33 | 細胞 (RGC-5) |
プレートリーダー | Y. Aoyama, S. Inagaki, K. Aoshima, Y. Iwata, S. Nakamura, H. Hara and M. Shimazawa,"Involvement of endoplasmic reticulum stress in rotenone-induced leber hereditary optic neuropathy model and the discovery of new therapeutic agents", J Pharmacol Sci . .,2021, doi: 10.1016/j.jphs.2021.07.003. |
| 34 | 細胞 (SAS,HSC-2) |
プレートリーダー | K. Yamana, J. Inoue, R. Yoshida, J. Sakata, H. Nakashima, H. Arita, S. Kawaguchi, S. Gohara, Y. Nagao, H. Takeshita, M. Maeshiro, R. Liu, Y. Matsuoka, M. Hirayama, K. Kawahara, M. Nagata, A. Hirosue, R. Toya, R. Murakami, Y. Kuwahara, M. Fukumoto and H. Nakayama,"Extracellular vesicles derived from radioresistant oral squamous cell carcinoma cells contribute to the acquisition of radioresistance via the miR‐503‐3p‐BAK axis", J Extracell Vesicles., 2021, doi: 10.1002/jev2.12169. |
| 35 | 細胞 (SBC-3) |
フローサイトメーター | N. Takahashi, T. Iguchi, M. Kuroda, M. Mishima and Y. Mimaki,"Novel Oleanane-Type Triterpene Glycosides from the Saponaria officinalis L. Seeds and Apoptosis-Inducing Activity via Mitochondria", Int J Mol Sci., 2022, doi: 10.3390/ijms23042047. |
| 36 | 細胞 (SH-SY5Y) |
蛍光顕微鏡 | Q. Guo, I. Kawahata, A. Cheng, H. Wang, W. Jia, H. Yoshino and K. Fukunaga,"Fatty acid-binding proteins 3 and 5 are involved in the initiation of mitochondrial damage in ischemic neurons", Redox Biology., 2023, doi: 10.1016/j.redox.2022.102547. |
| 37 | 細胞 (SiHa) |
蛍光顕微鏡 | F.F. Gao, J.H. Quan, M.A. Lee, W. Ye, J.M. Yuk, G.H. Cha, I.W. Choi and Y.H. Lee,"Trichomonas vaginalis induces apoptosis via ROS and ER stress response through ER–mitochondria crosstalk in SiHa cells", Parasites &vectors., 2021, doi: 10.1186/s13071-021-05098-2. |
| 38 | 細胞 (SU-DHL-2) |
フローサイトメーター | Q. Zhao, D. Jiang, X. Sun, Q. Mo, S. Chen, W. Chen, R. Gui and X. Ma, "Biomimetic nanotherapy: core–shell structured nanocomplexes based on the neutrophil membrane for targeted therapy of lymphoma", J Nanobiotechnology., 2021, doi: 10.1186/s12951-021-00922-4. |
| 39 | 細胞 (THP-1) |
蛍光顕微鏡 | W. Zheng, Z. Zhou, Y. Rui, R. Ye, F. Xia, F. Guo, X. Liu, J. Su, M. Lou, and X.F. Yu,"TRAF3 activates STING-mediated suppression of EV-A71 and target of viral evasion", Signal Transduct Target Ther., 2023, doi: 10.1038/s41392-022-01287-2. |
| 40 | 細胞 (TSM15) |
In Cell Analyzer | M. Honda, F. Shimizu, R. Sato, Y. Mizukami, K. Watanabe, Y. Takeshita, T. Maeda, M. Koga and T. Kanda,"Jo-1 Antibodies From Myositis Induce Complement-Dependent Cytotoxicity and TREM-1 Upregulation in Muscle Endothelial Cells", Neurol Neuroimmunol Neuroinflamm., 2023, doi: 10.1212/NXI.0000000000200116. |
| 41 | 細胞 (tumor) |
フローサイトメーター | H. Wang, X. Rong, G. Zhao, Y. Zhou, Y. Xiao, D. Ma, X. Jin, Y. Wu, Y. Yan, H. Yang, Y. Zhou, M. Qian, C. Niu, X. Hu, D.Q. Li, Q. Liu, Y. Wen, Y.Z. Jiang, C. Zhao and Z.M. Shao ,"The microbial metabolite trimethylamine N-oxide promotes antitumor immunity in triple-negative breast cancer", Cell Metab., 2022, doi: 10.1016/j.cmet.2022.02.010. |
| 42 | 細胞 (TY10) |
In Cell Analyzer | F. Shimizu, R. Ogawa, Y. Mizukami, K. Watanabe, K. Hara, C. Kadono, T. Takahashi, T. Misu, Y. Takeshita, Y. Sano, M. Fujisawa, T. Maeda, I. Nakashima, K. Fujihara and T. Kanda,"GRP78 antibodies are associated with blood-brain barrier breakdown in anti–myelin oligodendrocyte glycoprotein antibody–associated disorder", Neurol Neuroimmunol Neuroinflamm., 2022, doi: 10.1212/NXI.0000000000001038. |
| 43 | 細胞 (U2OS, HeLa) |
蛍光顕微鏡 | T. Namba, "BAP31 regulates mitochondrial function via interaction with Tom40 within ER-mitochondria contact sites ", Sci Adv., 2019, 5, (6), 1386. |
よくある質問
-
Q
1キットあたりの使用回数の目安は?
-
A
目安となる使用回数の目安は、下記を参考にしてください。
装置 容器 回数 液量 フローサイトメーター - 100回 0.5 ml/回 蛍光顕微鏡
マイクロプレートリーダー35 mm dish 25 枚 2 ml/枚 8 well チャンバースライド 30 枚 200 µl/well 96 well マイクロプレート 5 枚 100 µl/well * 容器毎で使用する液量によって使用回数は変わります。容器と液量を予め確認の上、ご使用ください。
-
Q
JC-1染色後の細胞の洗浄には、HBSSの代わりにPBSを使用できますか?
-
A
細胞へのダメージを軽減するため、HBSSの使用を推奨しております。HBSSがお手元にない場合は培地での洗浄を推奨します。
-
Q
血清入り培地を使用してもいいですか?
-
A
細胞洗浄やWorking Solutionに血清入り培地を使用して頂いて構いません。蛍光観察時はImaging Bufferを推奨しますが、血清入り培地をご使用の場合はフェノールレッド不含培地を推奨します。
-
Q
染色後の細胞固定化、または細胞固定化後の染色は可能ですか?
-
A
固定化によりミトコンドリアが脱分極するため、染色後の固定及び固定化後の染色は出来ません。
-
Q
薬剤処理したサンプルをコントロールと比較したところ、赤と緑の両方の蛍光値が増加(又は減少)しました。 結果をどのように解釈すればよいのでしょうか?
-
A
赤色と緑色の蛍光比を比較してください。
薬剤処理サンプルとコントロールの各々で赤色蛍光値/緑色蛍光値の比を算出してください。
両者を比較して蛍光比が低い程ミトコンドリア膜電位が低下していると考えられます。(赤/緑の比で評価する理由)
JC-1は膜電位依存的に細胞に蓄積するため、細胞の状態により細胞あたりのJC-1の濃度は異なる場合があります1)2)。(コントロールと薬剤処理サンプルでは細胞の状態が異なるため、JC-1の蓄積濃度が異なります。)
また、JC-1はミトコンドリア膜電位が高い状態では凝集し緑から赤色に蛍光がシフトします。この凝集体の量は膜電位の程度に依存する3)ことから、赤/緑の比でサンプル間のミトコンドリア膜電位を比較することができます。<参考文献>
1) Cossarizza, A. et al., Biochem Biophys Res Commun., 1993, 197(1), 40.
2) Perelman, A. et al., Cell Death and Disease, 2012, 3, e430
3) Smiley, S. T. et al., Proc. Nail. Acad. Sci., 1991, 88, 3671.
取扱条件
| 保存条件: 冷蔵 |