Liperfluo
過酸化脂質検出蛍光試薬
-
製品コードL248 Liperfluo
-
CAS番号1448846-35-2
-
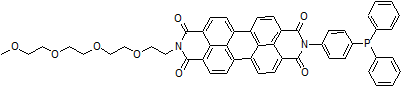
化学名N-(4-Diphenylphosphinophenyl)-N'-(3,6,9,12-tetraoxatridecyl)perylene-3,4,9,10-tetracarboxydiimide
-
分子式・分子量C51H41N2O8P=840.85
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 1 set (50 μg x 5) | ¥25,900 | 345-91551 |
<使用回数の目安> 50 µgあたり、5-50回(保存不可)
【本製品に関する重要なお知らせ】
2024年3月1日以降の製品出荷分に関して、性状変更に伴う製品取扱方法の変更がございます。
・下記製品写真を参考に、シール添付および同梱カードが入っている場合には、
必ず「Type 2」の取扱説明書をご利用ください。
・シール添付等が無い製品は「Type 1」の取扱説明書をご利用ください。
-
「Type 2」の外装シールと同梱カード 

-
「Type 1」の外装 
性質
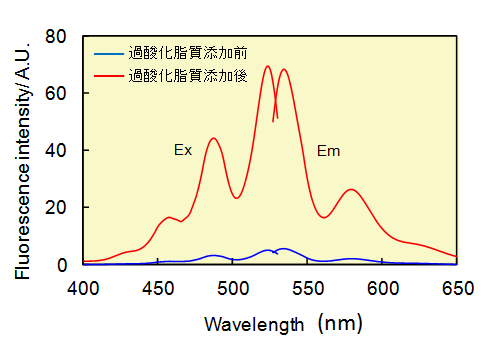
Liperfluo は、Spy-LHP の類似化合物で、過酸化脂質検出用の試薬であり、過酸化脂質で特異的に酸化されエタノール等の有機溶媒中で強い蛍光を発します(図1,2)。Liperfluo 酸化体の励起波長および蛍光波長はそれぞれ524 nm、535 nm で、測定試料への光によるダメージや試料由来の自家蛍光の影響を軽減できます。本試薬は、ジイソキノリン環の片方にテトラエチレングリコール基が導入されたもので、Spy-LHP よりも水系バッファー中での分散性が向上しています。Liperfluo 酸化体は水中ではほとんど蛍光を発しませんが、細胞膜等の脂溶性の高い部位では蛍光性となることから、容易に蛍光顕微鏡による生細胞の過酸化脂質のイメージング(図3)やフローサイトメトリーによる細胞の過酸化脂質量の分析に使用することができます。
近年、細胞死の一種であるフェロトーシス研究において、細胞内2価鉄を基点とした過酸化脂質の生成が注目されており、脂質過酸化現象を見る試薬(製品コード: L267、製品名: Lipid Peroxidation Probe –BDP 581/591 C11-)とは異なり、過酸化脂質そのものを検出するLiperfluoは多くの論文で使用されています。
技術情報
特長
1) 長波長励起のため、細胞への光ダメージや自家蛍光の影響を軽減できる。
図1 過酸化脂質によるLiperfluoの励起および蛍光スペクトル変化(エタノール溶媒中)
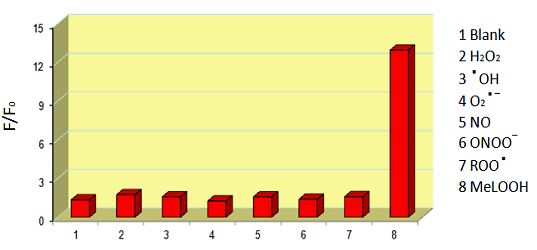
2) 過酸化脂質特異性が高い
図2 Liperfluoの活性酸素種に対する反応選択性
3) 細胞の過酸化脂質のイメージングができる。
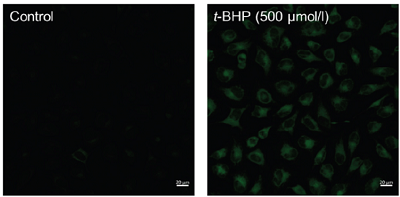
図3 HeLa細胞における過酸化脂質のイメージング
実験例:SH-SY5Y細胞内の過酸化脂質の検出
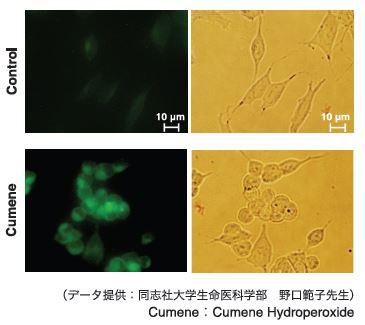 |
操作手順 ・使用細胞:SH-SY5Y 6 well Plateに播種(60x105 cell/well) ↓終夜(37℃, CO2インキュベート) ・LjperfluoのDMSO溶液を添加(終濃度:20 μmol/l) ↓15min (37℃, CO2インキュベート) ・Cumene添加(終濃度:100 μmol/l) ↓2h (37℃, CO2インキュベート) ・蛍光顕微鏡で測定 装置:Olympus IX-71 epifluorescent microscope) ミラーユニット:U-MNIBA3 露光時間:10 sec. lSO感度:800 |
図7 SH-SY5Y 細胞における各種薬剤刺激による過酸化脂質イメージング
薬剤による酸化ストレス刺激により明確な蛍光増加が確認できる。
Control、 Cumene それぞれの蛍光及び明視野画像。
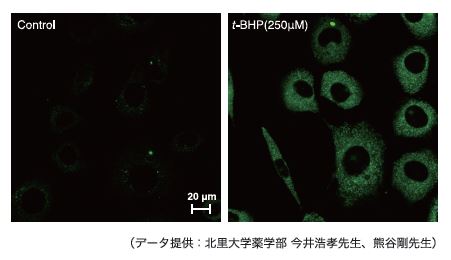
実験例:L929細胞内の過酸化脂質の検出
 |
|
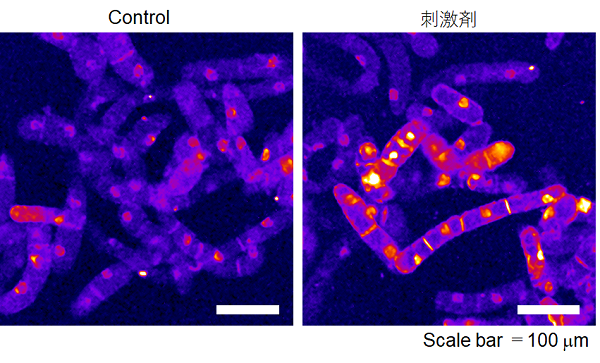
実験例:植物細胞(タバコ BY-2細胞)内の過酸化脂質の検出
植物細胞(タバコ BY-2細胞)にストレス刺激※を2時間行った際の過酸化脂質の検出を行いました。
結果、刺激を行っていない細胞 (Control) に比べ、刺激剤処理群では優位な蛍光輝度の上昇が観察されました。
※刺激の条件は論文執筆中のため、非公開
<操作手順>
・BY-2 細胞懸濁液を必要量準備する
・1.5 mL チューブに細胞懸濁液を1 mL入れる
・1 mmol/l の Liperfluo DMSO stock solutionを2 µL (終濃度 2 µmol/l、x500希釈)添加する
・30分間静置し、細胞を沈殿させる
・静置後、細胞を舞い上げないように上澄みを900 µL除く
・LS 培地を900 µL添加する
・刺激剤、コントロール(DMSO等)を適量添加する
・チューブをラップ、アルミホイルで覆い、シェイカーに設置
・シェイカーにて 2 時間培養する
・スピニングディスク式共焦点顕微鏡 (CSU-X1) にて観察する
対物レンズ: 10倍、励起レーザー: 488 nm、露光時間: 5,000 ミリ秒
「データ提供:平瀬 一真(熊本大学理学部・4年生)、檜垣 匠(熊本大学理学部・教授)」
参考文献
Liperfluoが使用された細胞種別の参考文献(細胞名:英数順)
よくある質問
-
Q
S343 Spy-LHPとの違いは何ですか?
-
A
DMSOへの溶解性が増し、生細胞の過酸化脂質の染色が容易になりました。
溶解例:1 mmol/l (50 µg/60 µl DMSO)
※製品コード:S343、製品名:Spy-LHPは販売を中止させていただきました。
-
Q
蛍光顕微鏡やフローサイトメトリーで観察する際、どの励起フィルター、レーザーが使用可能でしょうか?
-
A
蛍光顕微鏡の場合、GFPフィルター(励起:450-490 nm, 蛍光:500-545 nm)やFITCフィルター(励起:467-498 nm, 蛍光:513-556 nm)が使用可能です。
フローサイトメトリーの場合は、488nmで励起可能です。
-
Q
培地中のフェノールレッドや血清の影響はありますか?
また、バックグランドが高い場合や、蛍光が弱い(probeが光らない)場合に改善する点はありますか? -
A
フェノールレッドや血清入り培地でも使用可能です。
ただし、バックグランドが高い場合はPBSに置換して下さい。
また、バックグランドが高い場合、Liperfluoが光により自然酸化されている可能性があります。
インキュベーション時もなるべく遮光するようにしてください。
(溶解後は必ずアルミ箔などで遮光してください。)
蛍光強度が弱い場合、反応時間を長くしてもバックグランドも高くなってしまうためお勧めできません。
そのため、装置の測定(蛍光観察)の条件を調整してください。
→励起光の強度を強くする。
→露光時間を長くする。
-
Q
浮遊細胞と付着細胞のどちらでも使用可能でしょうか?
また、固定化した細胞を染色することはできますか? -
A
浮遊細胞、付着細胞、どちらでも使用可能です。
HL-60細胞(浮遊細胞)、CHO細胞・SH-SY5Y細胞(付着細胞)で実績があります。
固定化した細胞では染色することはできません。
取扱条件
| 性状: | 本品は、暗赤色結晶性粉末又は固体である。 |
|---|---|
| 純度(HPLC): | 90.0% 以上 |
| NMRスペクトル: | 試験適合 |
| 保存条件: 冷蔵,遮光 , 取扱条件: 窒素置換 |