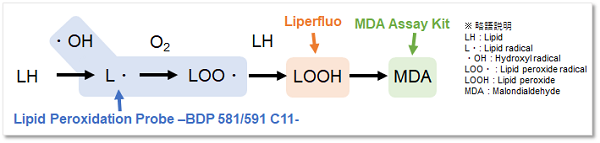
Lipid Peroxidation Probe -BDP 581/591 C11-
脂質過酸化検出試薬
- 脂質過酸化を高感度に検出できる
- 顕微鏡、プレートリーダー、フローサイトメーターで検出可能
-
製品コードL267 Lipid Peroxidation Probe -BDP 581/591 C11-
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 200 tests | ¥31,900 | 344-10061 |
性質
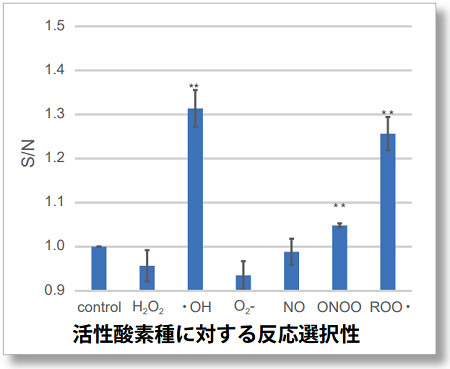
活性酸素種とは酸素を起点に化学反応にて生じる様々な酸化力を増した分子を示します。近年、生体内でスーパーオキサイドから反応が進行し、脂質の酸化等が引き起こされ、これが炎症や細胞死等の様々な疾病と関係性が報告されており、種々の研究対象となっております。以上の様に、活性酸素は生体内にて多様な変化をするため、その検出には各活性酸素を正確に解析する試薬を理解し使用する必要があります。
Lipid Peroxidation Probe は脂質周辺のROS発生状況を確認する試薬であり、脂質過酸化現象を高感度に検出することが出来ます。小社製品(製品コード: L248) Liperfluoとは異なり過酸化脂質を選択的に検出することはできませんが、脂質の過酸化現象を網羅的に検出します。また、高感度検出によりLiperfluoでは検出困難であったプレートリーダーでの検出が可能であり、蛍光の数値化やスクリーニング用途に関して優れた製品です。
マニュアル
技術情報
Lipid Peroxidation Probeの性質
Lipid Peroxidation Probe -BDP 581/591 C11- は脂質過酸化を検出することができる蛍光色素です。本蛍光色素は過酸化脂質とは応答しませんが、脂質が過酸化される際に発生する脂質ラジカルなどと反応するため、結果的に過酸化脂質の発生を検出することができます。未反応の本色素は赤色の蛍光を発しますが、脂質周辺のラジカルと応答後は、その蛍光特性を赤色から緑色の蛍光に変化させます。このように、赤色と緑色の蛍光強度比で検出するため、高感度に脂質過酸化を検出することが可能となります。
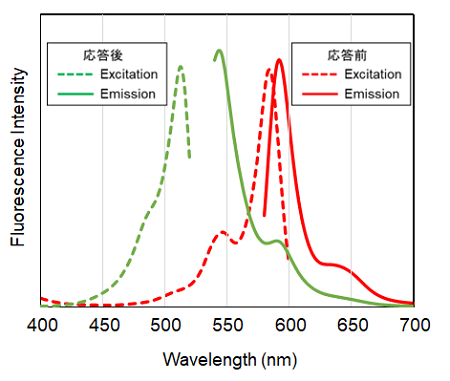
Lipid Peroxidation Probe -BDP 581/591 C11-の励起蛍光スペクトル
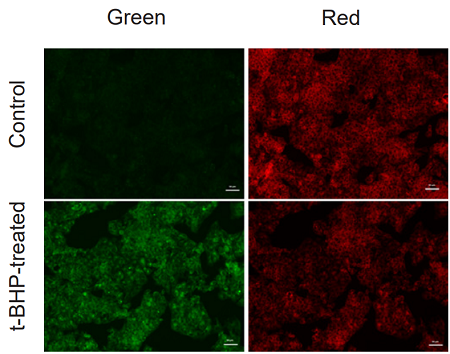
実験例:t-BHP (tert-butyl hydroperoxide) 処理した HepG2細胞の脂質過酸化の検出
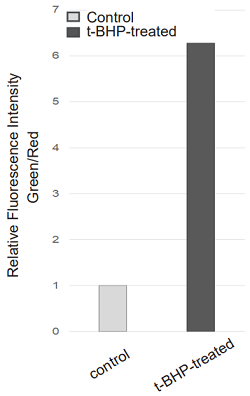
本色素で染色後のHepG2 細胞に、200 µmol/l t-BHPを含むHBSS溶液を添加し2時間の刺激を与え、未刺激の細胞との蛍光強度を比較しました。結果、未処理の細胞に比べ t-BHP 添加の細胞では、赤色蛍光の減少と緑色蛍光の増加が高感度に確認されました。また、この細胞をプレートリーダーを用いて検出し、得られた数値を緑色/赤色蛍光の強度比で算出したところ、脂質過酸化を数値化できました。さらに、フローサイトメーターで検出した場合、緑蛍光のヒストグラムが増加していることも確認できました。本色素は、異なる3つの分析器を用いて解析することが可能であることがわかりました。
<検出条件>
検出装置:蛍光顕微鏡
Green: GFP filter (Ex = 450-490 nm, Em = 500-550 nm)
Red: TexasRed filter (Ex = 540-580 nm, Em = 600-660 nm)
Scale bar: 50 µm
<検出条件>
検出装置:蛍光プレートリーダー
Green: Ex = 490 nm, Em = 520-540 nm
Red: Ex = 570 nm, Em = 600-620 nm
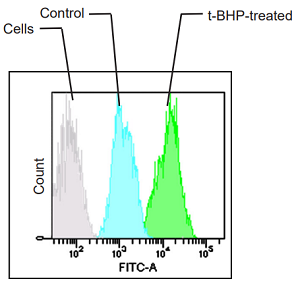
<検出条件>
検出装置:フローサイトメーター
Filter: FITC (Ex = 488 nm, Em = 515-545 nm)
実験例:Cumene hydroperoxide処理におけるHepG2細胞の脂質過酸化の検出
本色素で染色後のHepG2 細胞に、200 µmol/l cumene hydroperoxide を含むHBSS溶液を添加し2時間の刺激を与え、未刺激の細胞との蛍光強度を比較しました。結果、未処理の細胞に比べ cumene hydroperoxide 添加の細胞では、赤色蛍光の減少と緑色蛍光の増加が確認され、脂質過酸化を検出できていることがわかりました。
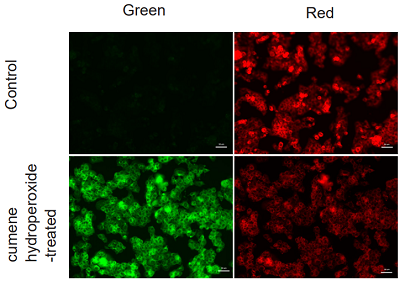
<検出条件>
検出装置:蛍光顕微鏡
Green: GFP filter (Ex = 450-490 nm, Em = 500-550 nm)
Red: TexasRed filter (Ex = 540-580 nm, Em = 600-660 nm)
Scale bar: 50 µm
実験例:Erastin 処理した HepG2細胞の脂質過酸化の検出
10 µmol/l Erastin を含むMEM培地を添加し2時間の刺激を与えたHepG2 細胞と、未刺激の細胞を本色素を用いて比較しました。結果、未処理の細胞に比べ刺激有りの細胞では、赤色蛍光の減少と緑色蛍光の増加が確認され、脂質過酸化を検出できていることがわかりました。
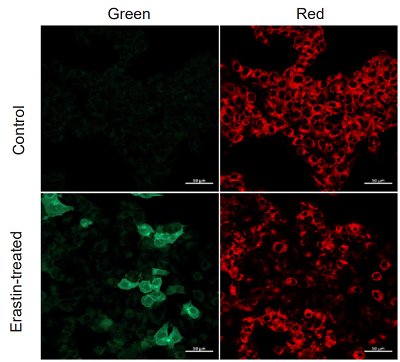
<検出条件>
検出装置:共焦点レーザー顕微鏡
Green: Ex = 488 nm, Em = 510-550 nm
Red: Ex = 561 nm, Em = 600-630 nm)
Scale bar: 50 µm
実験例:植物細胞(タバコ BY-2細胞)内の脂質過酸化の検出
植物細胞(タバコ BY-2細胞)にストレス刺激※を2時間行った際の過酸化脂質の検出を行いました。
結果、刺激を行っていない細胞 (Control) に比べ、刺激剤処理群では優位な蛍光輝度の上昇が観察されました。
※刺激の条件は論文執筆中のため、非公開
<操作手順>
・BY-2 細胞懸濁液を必要量準備する
・1.5 mL チューブに細胞懸濁液を1 mL入れる
・1 mmol/l の Liperfluo DMSO stock solutionを2 µL (終濃度 2 µmol/l、x500希釈)添加する
・30分間静置し、細胞を沈殿させる
・静置後、細胞を舞い上げないように上澄みを900 µL除く
・LS 培地を900 µL添加する
・刺激剤、コントロール(DMSO等)を適量添加する
・チューブをラップ、アルミホイルで覆い、シェイカーに設置
・シェイカーにて 2 時間培養する
・スピニングディスク式共焦点顕微鏡 (CSU-X1) にて観察する
対物レンズ: 10倍、励起レーザー: 488 nm, 555 nm、露光時間: 500 ミリ秒
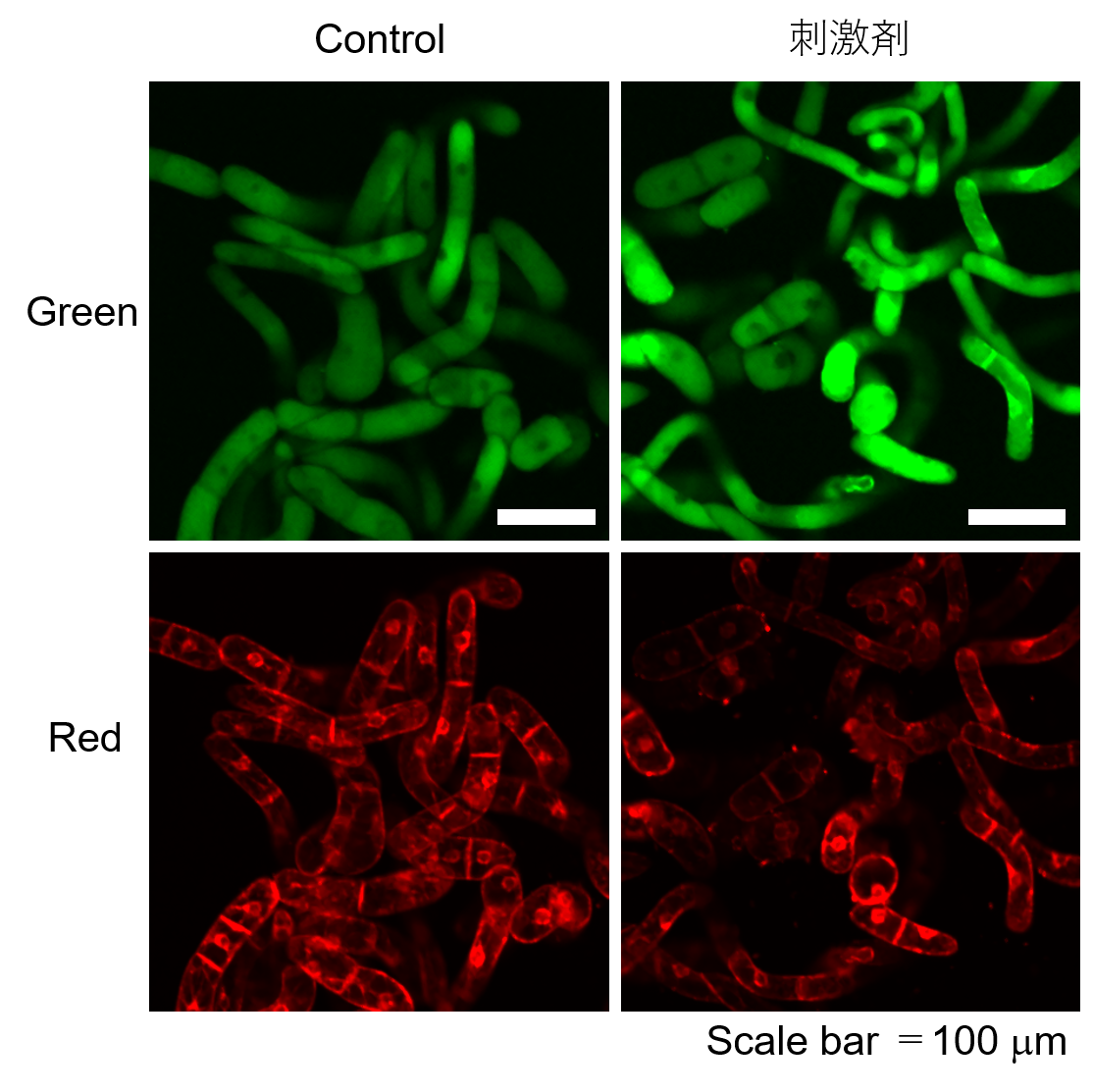
「データ提供:平瀬 一真(熊本大学理学部・4年生)、檜垣 匠(熊本大学理学部・教授)」
参考文献
| 文献No. | 対象サンプル | 装置 | 引用(リンク) |
|---|---|---|---|
| 1) | 細胞 (HTR-8/Svneo) |
蛍光顕微鏡 | H. Yang, X. Zhang, Y. Ding, H. Xiong, S. Xiang, Y. Wang, H. Li, Z. Liu, J. He, Y. Tao, H. Yang, H. Qi, "Elabela: Negative Regulation of Ferroptosis in Trophoblasts via the Ferritinophagy Pathway Implicated in the Pathogenesis of Preeclampsia", cells, 2023, doi:10.3390/cells12010099. |
| 2) | 細胞 (HLE-B3) |
蛍光顕微鏡 | D. Ma, J. Liu, L. Wang, Z. Zhi, L. Luo, J. Zhao, Y. Qin, "GSK-3β-dependent Nrf2 antioxidant response modulates ferroptosis of lens epithelial cells in age-related cataract", 2023, doi:10.1016/j.freeradbiomed.2023.04.022. |
よくある質問
-
Q
測定可能なサンプル数を教えてください。
-
A
測定可能なサンプル数は以下をご参考ください。
・96-well plate: 2枚
・ibidi 8-well plate: 12枚
・35 mm dish: 10枚
・6-well plate: 10ウェル
-
Q
ポジティブコントロールになる実験例はありますか?
-
A
取扱説明書にtert-butyl hydroperoxide (t-BHP)処理もしくはcumene hydroperoxide処理をしたHepG2細胞による検出例を掲載しております。実験例1もしくは実験例2の項目の操作1-5をご参考ください。
-
Q
working solutionは培養培地以外でも調製できますか?
-
A
培養培地以外での調製は、お勧めしません。BDP 581/591 C11は脂溶性が高いため、無血清培地やバッファーで調製すると試薬が容器に沈着する可能性があります。調製には血清入り培地をご使用ください。
-
Q
フローサイトメーターで使用する際、細胞を剥がす操作はどの段階で行えば良いですか?
-
A
取扱説明書操作6の後(薬剤処理しHBSSで洗浄した後)に、細胞を剥がす操作(トリプシン処理)を行ってください。
-
Q
染色後の細胞洗浄に使用するBufferはHBSS以外でも使用できますか?
-
A
PBS、 Hanks’ HEPES buffer、 培地でも洗浄できます。