Cystine Uptake Assay Kit
シスチン取り込み検出キット
- シスチン取り込み能力を簡便に検出できる
- プレートリーダーを用いて検出が可能
-
製品コードUP05 Cystine Uptake Assay Kit
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 20 tests | ¥21,800 | 344-09951 |
| 100 tests | ¥60,100 | 340-09953 |
<使用回数の目安> 100 testsあたり、96-well plate 1 枚
| 20 tests | Cystine Analog Solution Fluorescent Probe Reducing Agent Assay Buffer |
45 μl×1 ×1 ×1 5 ml×1 |
|---|---|---|
| 100 tests | Cystine Analog Solution Fluorescent Probe Reducing Agent Assay Buffer |
225 μl×1 ×1 ×2 25 ml×1 |
性質
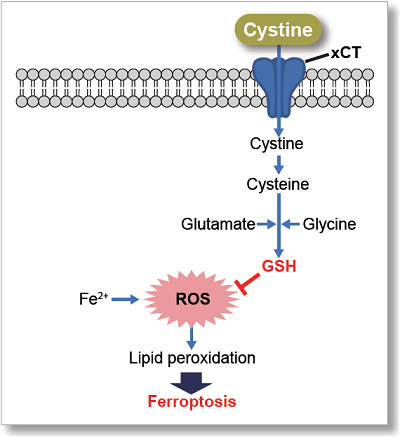
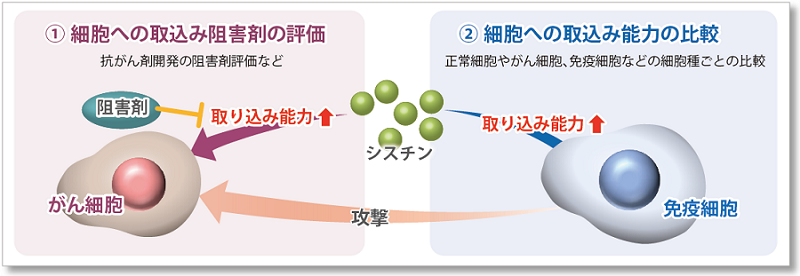
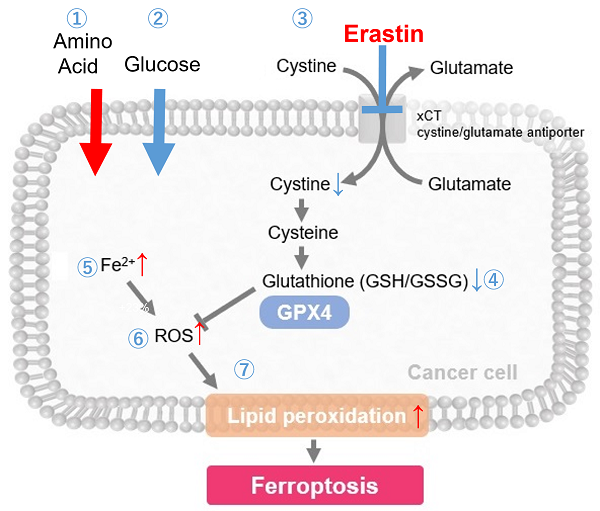
シスチンは、シスチントランスポーターであるxCTによって細胞内に取り込まれており、抗酸化物質であるグルタチオン(GSH)の原料となるため、細胞内のレドックスバランスの制御に重要な役割を果たしています。
多くのがん細胞ではxCTを介したシスチン取り込みが亢進しており、細胞内のグルタチオン量を高レベルに保つことによって細胞内レドックスを制御しています。また、このような高レベルの細胞内グルタチオンが、がん細胞における薬剤耐性に寄与することが明らかとなっています。
そのため、近年xCTは癌治療のターゲットの一つとして注目されています。xCT阻害剤であるスルファサラジンやエラスチンは、シスチン取り込みを阻害することによって細胞内グルタチオン量を低下させ、細胞死の一つであるフェロトーシスを誘導することが知られています。また、免疫細胞では活性化時にxCTを高発現することが知られており、シスチン取り込みを介した細胞内レドックス制御が免疫応答にも重要であることが示唆されています。
マニュアル
技術情報
この製品でできること
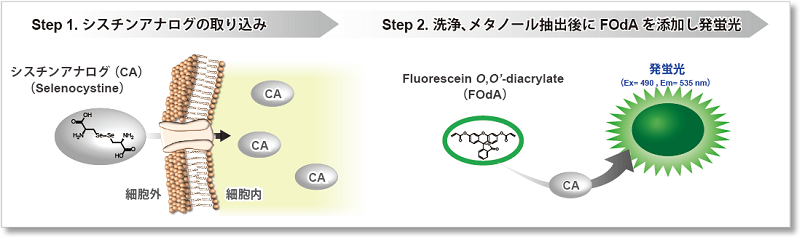
本キットはCystine Analog (CA)としてSelenocystineを用いており、細胞のシスチン取り込み能力を短時間の操作で簡便にプレートリーダーにて測定することが可能です。
測定原理
キットに含まれるCystine Analog (CA)は、シスチンと同様にxCTを経由して細胞に取り込まれます。細胞溶解後のReducing Agent添加で還元されたCAと検出色素FOdAが特異的に反応し、CA量に応じて緑色蛍光色素 を生成します。[特許出願中]
を生成します。[特許出願中]
下記ジャーナルにて技術情報を論文化しております。
Shimomura T, Hirakawa N, Ohuchi Y, Ishiyama M, Shiga M, Ueno Y, Simple Fluorescencce Assay for Cystine Uptake via the xCT in Cells Using Selenocystine and a Fluorescent Probe. ACS Sensors, 2021, 6(6), 2125-2128
実験例① xCT阻害剤(スルファサラジン、エラスチン)による評価
本キットを用いて、HeLa細胞へのスルファサラジン、エラスチンによる、シスチン取り込み阻害効果を測定しました。
スルファサラジン、エラスチンを添加した群では優位に蛍光強度が減少している結果が得られ、いずれの薬剤もシスチン取り込みを阻害することが分かりました。

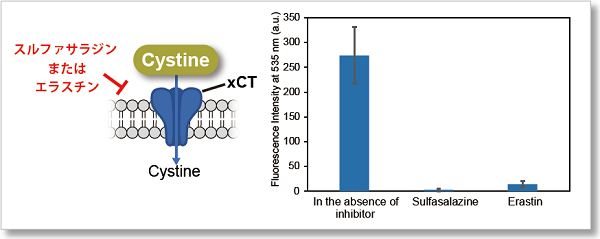
検出条件
細胞 :HeLa cells
前処理 :DMEM (cystine-free, serum-free), 37℃, 5 min
取込条件:0.5 mmol/l  or 2 μmol/l erastin / Cystine Analog / DMEM (cystine-free, serum-free), 37℃, 30 min
or 2 μmol/l erastin / Cystine Analog / DMEM (cystine-free, serum-free), 37℃, 30 min
測定装置:蛍光プレートリーダー
検出条件:Ex=485 nm, Em=535 nm
実験例② ラジオアイソトープ(RI)法との比較
RI測定を要していたシスチン取り込みアッセイをプレートリーダーで簡便にできるようになりました。
本製品と既存法の[14C]標識シスチンを用いたRI測定法を用いて、Wild-type(WT), xCT-knockout(KO), xCT-overexpressed(OE)の3種の細胞における取り込み量を比較しました。
その結果、どちらもWTと比較して、KOでは取り込み量が減少し、OEでは取り込み量が増加しました。
したがって、本製品はRI測定法に対して相関性があることが確認されました。
※本データは新潟大学 医学部 保健学科 生化学・分子生物学研究室 佐藤 英世 教授 及び 佐藤 茉美 特任助教よりご提供いただきました。
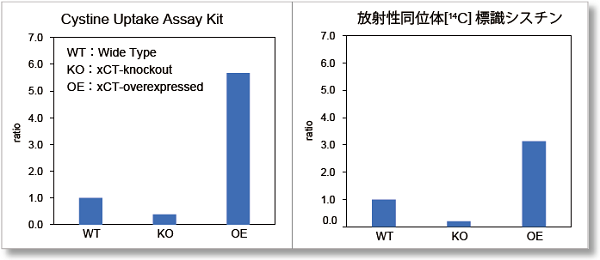
(WTを基準としたときの取り込み量を比較しました。)
検出条件
細胞:HT1080 cells (wild-type or xCT-knockout or xCT- overexpressed)
○Cystine Uptake Assay Kit
前処理 :PBS (+) (cystine-free, 0.1% glucose, 0.01% Mg2+, 0.01% Ca2+), 37 ℃, 5 min
取込条件: Cystine Analog / PBS(+) (cystine-free, 0.1% glucose, 0.01% Mg2+, 0.01% Ca2+), 37℃, 30 min
○RI法
前処理 :無し
取込条件: 0.05 mmol/l cystine + [14C]cystine (7.4 kBq/ml) /PBS(+) (0.1% glucose, 0.01% Mg2+, 0.01% Ca2+), 37℃, 2 min
実験例③ エラスチン処理による栄養素取り込み量の増減と、レドックスバランスの変化
xCT阻害剤であるエラスチンを処理したA549細胞における、栄養素取り込み量の増減と、レドックスバランスの変化を確認しました。
その結果、主に以下3点を確認することができました。
・シスチン取り込みの阻害によるシステインの喪失を補うために、アミノ酸の取り込みが増加しました。
・グルコースの取り込みの減少が見られ、代謝のリプログラミングが行われた可能性が考えられます。
・シスチン取り込み阻害によるグルタチオンの減少により、Fe2+とROS, 過酸化脂質の量が増加しました。
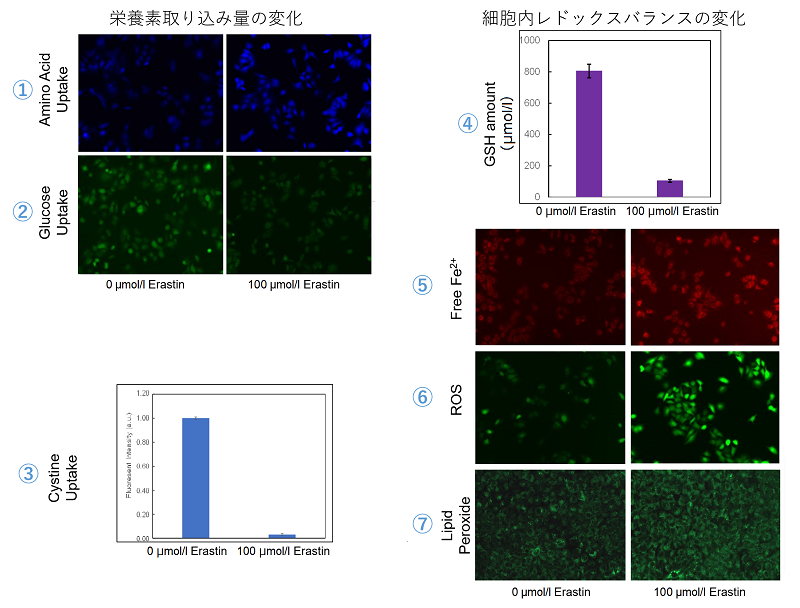
<使用製品>
| ① アミノ酸取り込み | :Amino Acid Uptake Assay Kit (製品コード:UP04) |
| ② グルコース取り込み | :Glucose Uptake Assay Kit-Green (製品コード:UP02) |
| ③ シスチン取り込み | :Cystine Uptake Assay Kit (製品コード:UP05) |
| ④ 細胞内グルタチオン量 | :GSSG/GSH Quantification Kit (製品コード:G257) |
| ⑤ 細胞内鉄イオン | :FerroOrange (製品コード:F374) |
| ⑥ 細胞内トータルROS | :ROS Assay Kit -Highly Sensitive DCFH-DA- (製品コード:R252) |
| ⑦ 細胞内過酸化脂質 | :Liperfluo (製品コード:L248) |
<実験条件>
細胞:A549細胞
培養条件:100 μmol/l Erastin/MEM, 37℃, 3h
参考文献
| 文献No. | 対象サンプル | 装置 | 引用(リンク) |
|---|---|---|---|
| 1) | 細胞 (A172; LN229) |
プレートリーダー | K. Hayashima, H. Katoh, "Expression of gamma-glutamyltransferase 1 in glioblastoma cells confers resistance to cystine deprivation-induced ferroptosis", J. Biol. Chem., 2022, doi:10.1016/j.jbc.2022.101703. |
| 2) | 細胞 (HK2; 293T) |
プレートリーダー | H. Chen, L. Cao, K. Han, H. Zhang, J. Cui, X. Ma, S. Zhao, C. Zhao, S. Yin, L. Fan, H. Hu, "Patulin disrupts SLC7A11-cystine-cysteine-GSH antioxidant system and promotes renal cell ferroptosis both in vitro and in vivo", 2022, Food Chem. Toxicol., doi: 10.1016/j.fct.2022.113255. |
| 3) | 細胞 (Hep 3B) |
プレートリーダー | X. Hu, Y. He, Z. Han, W. Liu, D. Liu, X. Zhang, L. Chen, L. Qi, L. Chen, Y. Luo, Q. Li, P. Chen, Q. Wu, X. Zhu and H. Guo, "PNO1 inhibits autophagy-mediated ferroptosis by GSH metabolic reprogramming in hepatocellular carcinoma ", 2022, Cell Death Dis., doi:10.1038/s41419-022-05448-7. |
よくある質問
-
Q
蛍光測定用のマイクロプレートはどのようなものが使えますか?
-
A
使用実績のあるマイクロプレートは下記の通りです。
社名 製品名 Cat No. ibidi μPlate 96 well ibiTreat black S 15 ib89626 AGC techno glass EZVIEW Glass Bottom Culture Plate LB 96well 5866-096 Thermo Fisher 96 Well Black/Clear Bottom Plate, TC Surface, Pack of 10 165305
-
Q
Cystine Analogはどのトランスポーターを介して取り込まれるのでしょうか?
-
A
Cystine Analogはシスチン・グルタミン酸トランスポーター(xCT)を介して細胞内へ取り込まれます。
-
Q
細胞種の実績を教えて下さい。
-
A
下記の細胞において使用実績があります。
由来 細胞名 ヒト神経膠芽腫由来細胞 A172 ヒト肺胞基底上皮腺癌細胞 A549 ヒト悪性黒色種 A375 ヒト結腸腺癌 HCT116 ヒト子宮頸癌由来細胞 HepG2 白血病細胞 HL60 ヒトサルコーマ細胞 HT1080 マウス胚性線維芽細胞 MEF ヒト肺小細胞癌 SBC-5 アストロサイト―マ U-251 MG
-
Q
Cystine Analogは細胞内に取り込まれた後、分解・代謝されるのでしょうか?
-
A
Cystine Analogは安定な構造を有しているため、実験操作内において分解されることはございません。
-
Q
Cystine uptake solutionは保存可能でしょうか?
-
A
Cystine uptake solutionは保存できません。添加前に必要量のCystine uptake solutionを調製して下さい。
-
Q
シスチンを定量することはできますか?
-
A
本製品を用いてシスチンを定量することはできません。
-
Q
細胞内に取り込まれたCystine Analogを定量することはできますか?
-
A
細胞内に取り込まれたCystine Analogを定量することはできません。本製品は、シスチン取り込み能力を数値化するためのキットです。
-
Q
サンプル間またはブランクとの蛍光強度差が無い場合、何を確認すればよいですか?
-
A
以下5点をご確認ください。
1.細胞数が変化している。
測定値(蛍光強度)を細胞数やタンパク質量で補正してください。
詳細はよくある質問[測定値(蛍光強度)を細胞数やタンパク質濃度で補正する方法を教えてください。]をご参照ください。2. 細胞へCystine Analogが十分取り込まれていない。
マニュアルの各操作の時間を以下を目安にご検討ください。
・シスチン不含培地での培養時間 (接着細胞 操作3, 浮遊細胞 操作4 ):5 – 30分間
・Cystine Analogの取り込み時間 (接着細胞 操作4, 浮遊細胞 操作5 ) : 30 – 60分間3. 細胞に取り込まれなかったCystine Analogがウェル内に残存することでバックグラウンドが上昇している。
PBSによる洗浄(接着細胞:操作5, 浮遊細胞:操作6)を繰り返してください。4. Working solutionが分解しており、バックグラウンドが上昇している。
Working solutionを調製後、時間をおくと溶液に含まれる蛍光色素が分解し、蛍光強度が 高くなる可能性があります。
Working Solution調製後、時間をおかずに添加してください。5. 細胞種の影響
細胞種ごとにシスチンの取り込み能は大きく異なっており、取り込み能が低い細胞種では相対的にバックグラウンドが高く見えることがあります。下図は異なるがん細胞のシスチン取り込み能の違いを示しています。上記記載の対処法でもバックグラウンドが解決できない場合には、よくある質問記載の実績のある細胞種でまずご検討いただくことをおすすめいたします。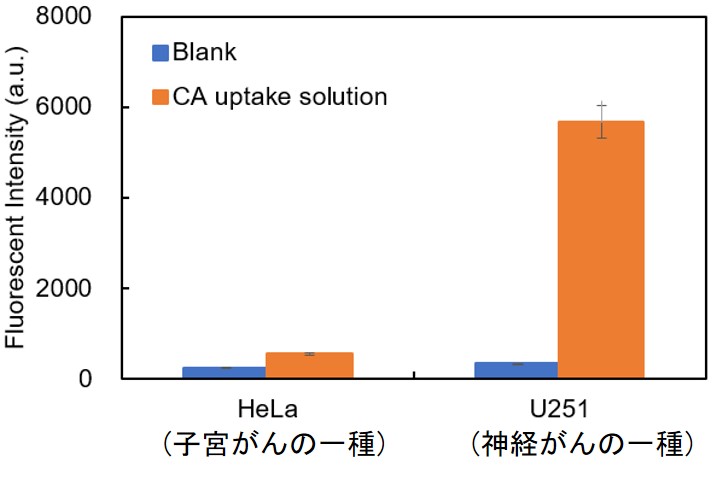
-
Q
シスチン不含無血清培地以外にCA Uptake solutionの調製に使用できるバッファーはありますか?
-
A
HeLa細胞においてHBSSや0.1%Glucoseを含むPBS(+)を使用して測定した実績がございます。
-
Q
測定値(蛍光強度)を細胞数やタンパク質濃度で補正する方法を教えてください。
-
A
小社では下記表に記載する方法を推奨しております。使用する細胞(接着細胞・浮遊細胞)により補正方法とタイミングが異なるため、下記表を参照し[UP05による測定値]を補正してください。
細胞 接着細胞 浮遊細胞 補正方法
核染色(蛍光)
タンパク質定量法: BCA法 (比色)
製品
Cell Count Normalization Kit [Code:C544]
Sodium bicinchoninate [Code:B037]
市販のキット補正のタイミング
取扱説明書 接着細胞の操作10(UP05の測定)後の溶液を用いる。
取扱説明書 浮遊細胞の操作9で使用した溶液の残りを使用する。
補正の操作
Cell count Normalization Kit [Code:C544]
の取扱説明書 [培地交換法]をご参照ください。取扱説明書 の下記 実験例をご参照ください。
[xCT阻害剤エラスチンによるシスチントランスポーター活性阻害(HL60)][UP05による測定値]を [補正方法による測定値]で補正蛍光強度を計算してください。
補正蛍光強度=[UP05による測定値]/[補正方法による測定値]※[UP05による測定値] = (サンプルの測定値) - (ブランクの測定値)
※[補正方法による測定値] = (サンプルウェルの測定値) - (細胞なしのウェルの測定値)
取扱条件
| 保存条件: 冷凍 | |
|
危険・有害 シンボルマーク |
   
|
|---|---|