MitoBright LT Red
ミトコンドリア染色用色素 Red
- 長時間 細胞に滞留する
- 血清培地中で染色できる
- 蛍光顕微鏡・フローサイトメーターに対応
-
製品コードMT11 MitoBright LT Red
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 400 μl | ¥14,400 | 349-92073 |
性質
ミトコンドリアは細胞内のエネルギー生産のみならずさまざまな細胞機能に関与する多機能なオルガネラであり、活発な融合と分裂サイクルによりその形態を変化させています。これはミトコンドリアダイナミクスと言われ、最近では、ミトコンドリアの形態制御異常が神経変性疾患、代謝疾患や老化などに関与することからミトコンドリアの動態を長期間観察する需要が増えています。
ミトコンドリア形態観察・ミトコンドリア膜電位観察のコツ
実験成功のための「購入前の抑えるポイント・実験のコツ」について、実際に小社で取得したデータを用い動画で判りやすく解説しています。
-
① ミトコンドリア形態・動態観察のコツ [2:10~]
1.染色方法の選定
低分子蛍光色素・蛍光タンパクの遺伝子発現・免疫染色法 2.染色色素の特性を理解する
蛍光特性、染色後の結合性、染色の方法 3.観察時の確認事項と検討方法
蛍光の漏込・Z軸の情報・タイムラプスイメージング
-
② ミトコンドリア膜電位観察のコツ [16:17~]
-
既存の低分子色素「JC-1, TMRE,TMRM, MT-1」について 1.各色素の特性
2.耐光性とタイムラプスイメージング
3.固定化操作の影響
マニュアル
技術情報
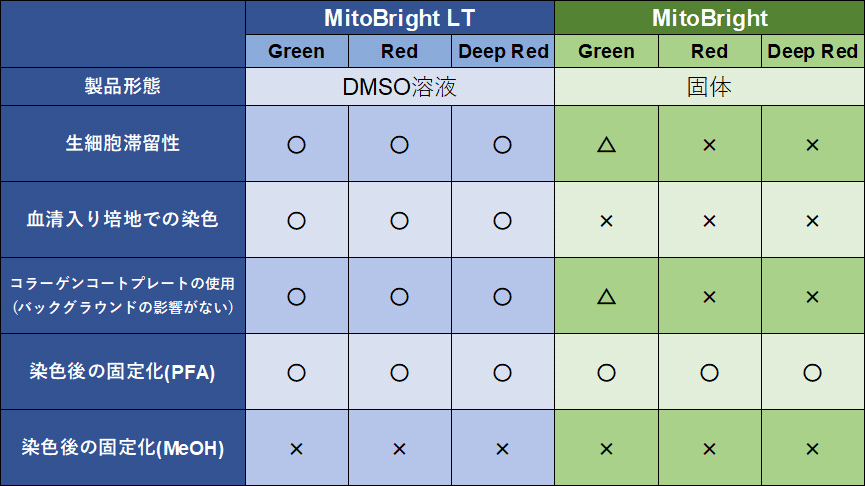
MitoBright LT は、他とココが違う
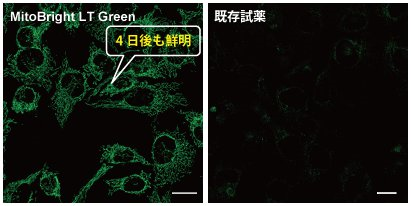
長時間 細胞に滞留する
HeLa 細胞をHBSS にて洗浄後、各MitoBright LT または既存試薬にて染色し、血清入り培地に入れ替え、4 日間培養後ミトコンドリアを観察しました。その結果、既存試薬は蛍光強度が4 日後に大きく低下したのに対し、 MitoBright LT は蛍光強度が維持され、ミトコンドリアを明瞭に観察できました。さらに継続して培養を行った結果、 MitoBright LT は7 日後もミトコンドリアに滞留していることが確認されました。
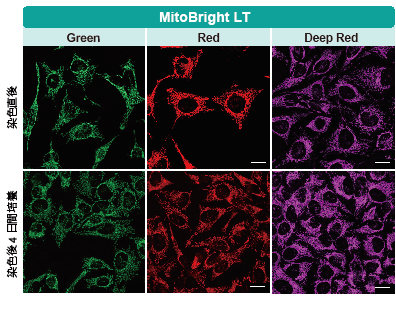
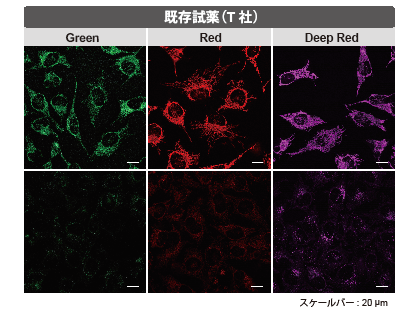
| <検出条件> | |
| MitoBright LT Green 、既存試薬(T 社)Green | :Ex 488 nm/Em 500–560 nm |
| MitoBright LT Red 、既存試薬(T 社)Red | :Ex 561 nm/Em 560–620 nm |
| MitoBright LT Deep Red 、 既存試薬(T 社)Deep Red | :Ex 640 nm/Em 650–700 nm |
小社のミトコンドリア染色試薬MitoBright LTシリーズは、世界的に広くご愛顧いただき多くの論文に掲載されています。
| 製品名 | サンプル | 染色後の 観察時間 |
測定機器 | ジャーナル(リンク) |
|---|---|---|---|---|
| MitoBright LT Green | 細胞 (C2C12) | 5日間 | 蛍光顕微鏡 | Polymers |
| MitoBright LT Green | 細胞 (BMM) | 36時間 or 3日間 | 蛍光顕微鏡/ フローサイトメーター |
JCI Insights |
| MitoBright LT Red | 細胞 (A11 cells/ P29 cells) | 3日間 | 蛍光顕微鏡 | BMC Mol. Cell Biol. |
| MitoBright LT Deep Red | 細胞 (HT-1080; MCF-10A; MCF-7 ) | 8時間 | 蛍光顕微鏡 | Advanced Therapeutics |
| MitoBright LT Deep Red | 細胞 (4T1) | 24時間 | 蛍光顕微鏡 | Advanced Functional Materials |
ミトコンドリアの分裂と融合の様子
HeLa細胞を100 nmol/l MitoBright LT Redにて染色後、血清入り培地に入れ替えミトコンドリアの形態を30分間観察しました。
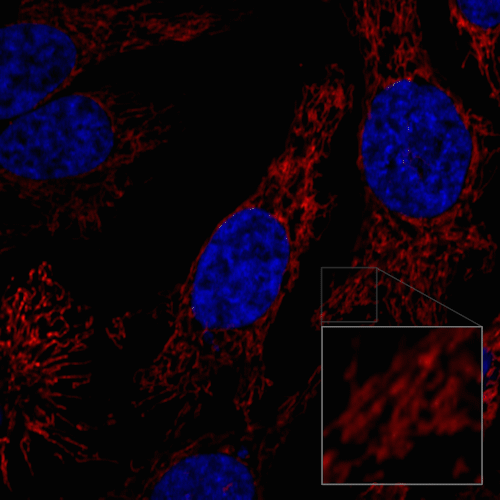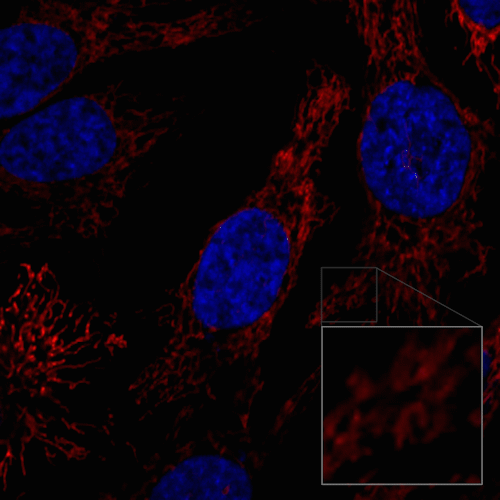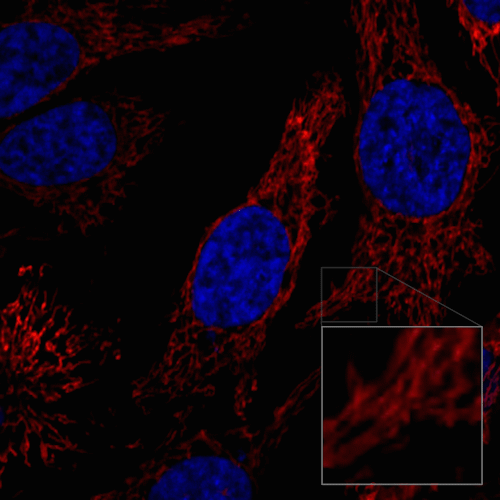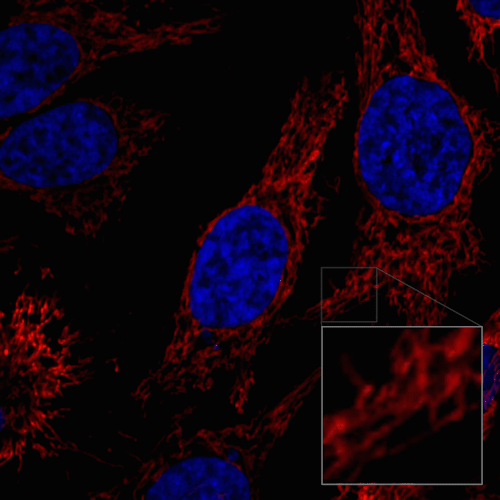
<測定装置>
共焦点レーザー顕微鏡、倍率 63倍
<観察条件>
Ex 561 nm、Em 560-620 nm
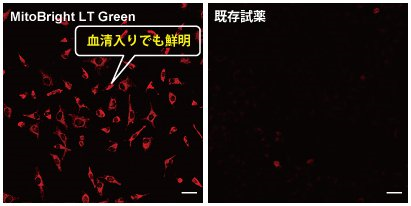
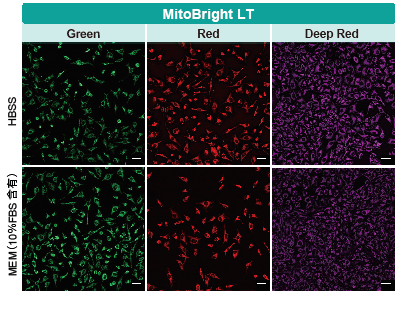
血清入りの培地で染色できる
MitoBright LT と既存試薬にて、血清有無の培地で染色しました。既存試薬は血清入り培地で染色した場合、蛍光が暗くなるのに対し、MitoBright LT は血清入り培地中で染色しても蛍光強度が低下することがなく、ミトコンドリアを明瞭に染色しました。
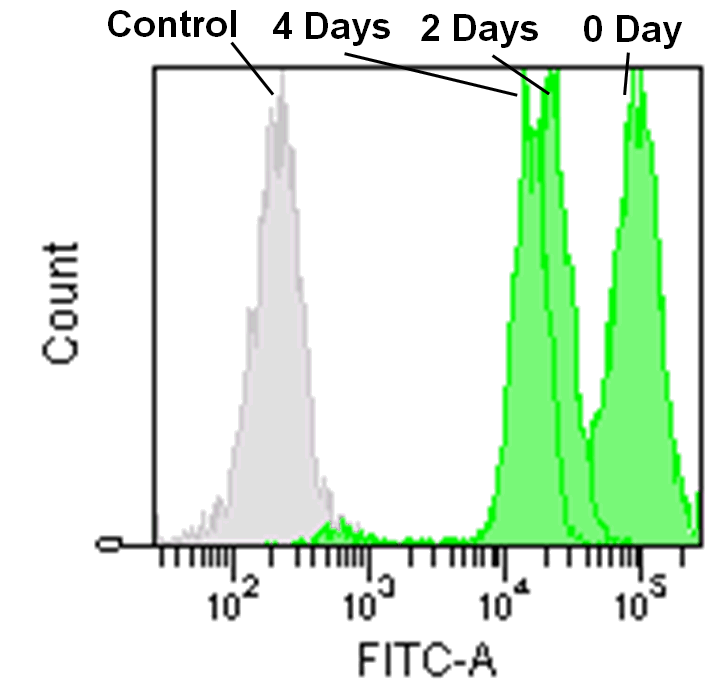
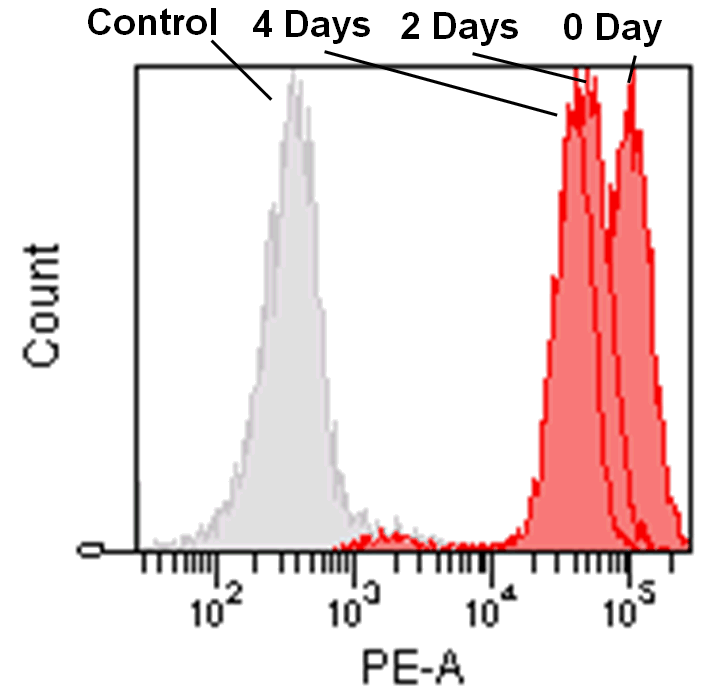
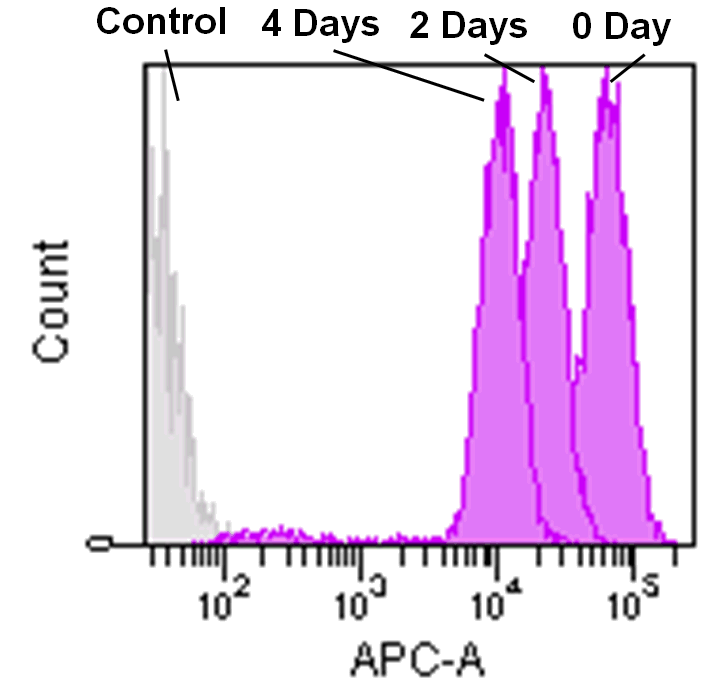
フローサイトメーターでの検出
Jurkat 細胞(3.2 x 105 cells/mL) をRPMI 培地 (10% fetal bovine serum, 1% penicillin-streptomycin) で 5 cm ディッシュに播種し、37℃、5% CO2 インキュベーター内で一晩培養した。
培地を取り除き、MitoBright LT working solution (0.1 μmol/L, 5 mL) を添加し37℃ で30 分間インキュベートした。溶液を取り除き、5 mL のRPMI 培地を用いて2 回洗浄した。
RPMI 培地を添加し、細胞培養を継続し、その細胞を2 日毎にフローサイトメーターで解析した。
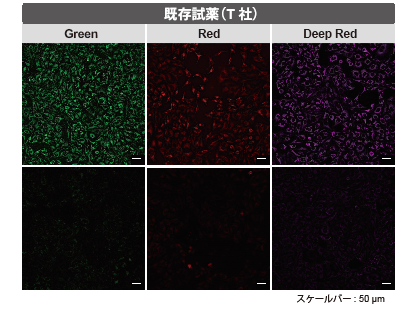
コラーゲンコートプレートを用いたミトコンドリア検出
ミトコンドリアの形態評価は高倍率で観察するため、コラーゲンコートしたガラスプレートがよく使用されます。
既存のミトコンドリア染色試薬は、コラーゲンに吸着しバックグラウンドを上昇させる問題がありましたが、MitoBright LTシリーズはバックグラウンドの影響がなく鮮明にミトコンドリアを染色できます。
MitoBright LT Red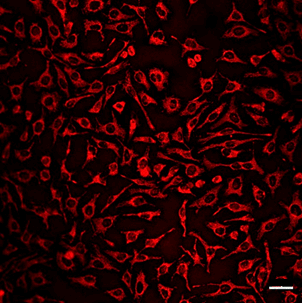 |
既存試薬 (MitoBright Red)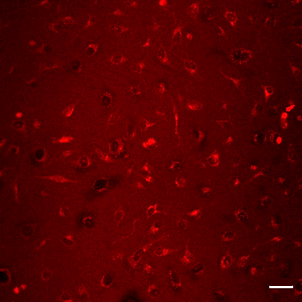 |
| スケールバー: 50 μm |
<染色条件>
HeLa細胞をコラーゲンコートプレートに播種し、24時間培養後 上澄みを抜き取り、HBSS にて洗浄。
100 nmol/L MitoBright LT Red working solution を添加し、30分インキュベート後上澄みを抜き取り、HBSS にて洗浄後、蛍光顕微鏡で観察。
<観察条件>
Ex 561 nm, Em 560–620 nm
<結果>
既存試薬はバックグラウンドが見られましたが、MitoBright LTで染色したミトコンドリアはバックグラウンドの影響がなく、鮮明にミトコンドリアを染色しました。
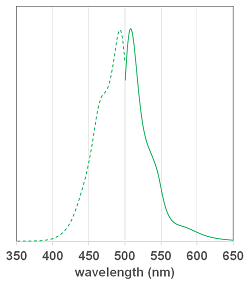
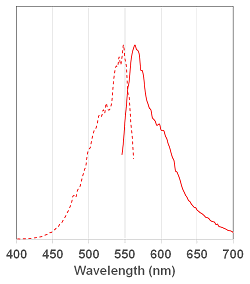
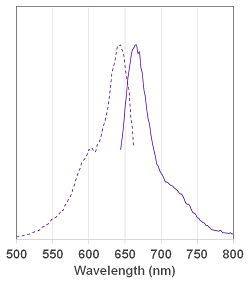
ラインナップと各試薬の蛍光特性
使用回数の目安
| MitoBright LT 容量 | 蛍光顕微鏡 | フローサイトメーター (working solution1 ml使用した場合) |
|
|---|---|---|---|
| (35 mm dish, working solution 2 ml/dish使用した場合) |
|||
| 400 μl | 200 枚 | 400 回 | |
*100 nmol/L MitoBright LT working solutionを調製した場合。
参考文献
| 文献No. | 対象サンプル | 装置 | 引用(リンク) |
|---|---|---|---|
| 1 | 細胞 (SH-SY5Y) |
蛍光顕微鏡 | A. M. Kimura, M. Tsuji, T. Yasumoto, Y. Mori, T. Oguchi, Y. Tsuji, M. Umino, A. Umino, T. Nishikawa, S. Nakamura, T. Inoue, Y. Kiuchi, M. Yamada, D. B. Teplow and K. Ono., " Myricetin prevents high molecular weight Aβ1-42 oligomer-induced neurotoxicity through antioxidant effects in cell membranes and mitochondria ", 2021, doi:10.1016/j.freeradbiomed.2021.05.019. |
| 2 | 細胞 (MRC-5) |
蛍光顕微鏡 | Y. Takenaka, I. Inoue, T. Nakano, M. Ikeda and Y. Kakinuma, "Prolonged disturbance of proteostasis induces cellular senescence via temporal mitochondrial dysfunction and subsequent mitochondrial accumulation in human fibroblasts", 2021, doi:10.1111/febs.16249. |
| 3 | 細胞 (A11 cells/ P29 cells) |
蛍光顕微鏡 | K. Takenaga, N. Koshikawa and H. Nagase, "Intercellular transfer of mitochondrial DNA carrying metastasis-enhancing pathogenic mutations from high- to low-metastatic tumor cells and stromal cells via extracellular vesicles", 2021, doi:10.1186/s12860-021-00391-5. |
| 4 | 細胞 (BM cells) |
蛍光顕微鏡 | Y. Aoyagi, Y. Hayashi, Y. Harada, K. Choi, N. Matsumura, D. Sadato, Y. Maemoto, A. Ito, S. Yanagi, D. Starczynowski, H. Harada, "Mitochondrial Fragmentation Triggers Ineffective Hematopoiesis in Myelodysplastic Syndromes", Cancer Discovery, 2022, doi:10.1158/2159-8290.CD-21-0032. |
よくある質問
-
Q
MitoBright LT は DMSO溶液ですが、凍結融解を繰り返しても劣化しないのでしょうか?
-
A
小社では凍結融解を30回繰り返した溶液を用いて、染色が可能であったことを確認しております。
-
Q
MitoBright LTとMitoBrightの違いを教えてください。
-
A
MitoBright LTはMitoBrightの細胞内滞留性を高めた製品です。また、MitoBright LTはDMSOに溶解した製品であり、
染色溶液を調製する手間がなくすぐにお使い頂けます。その他の性能の違いは下記表をご参照ください。
-
Q
MitoBright LTシリーズで染色した後に脱分極すると、染色度合いに影響はありますか?
-
A
脱分極条件や細胞種などにより影響は確認されます。また、MitoBright LTの各色素で影響の度合は異なります。
参考として小社ではHeLa細胞を各MitoBright LTで染色し、下記条件にて脱分極処理を行って蛍光染色の変化を観察しました。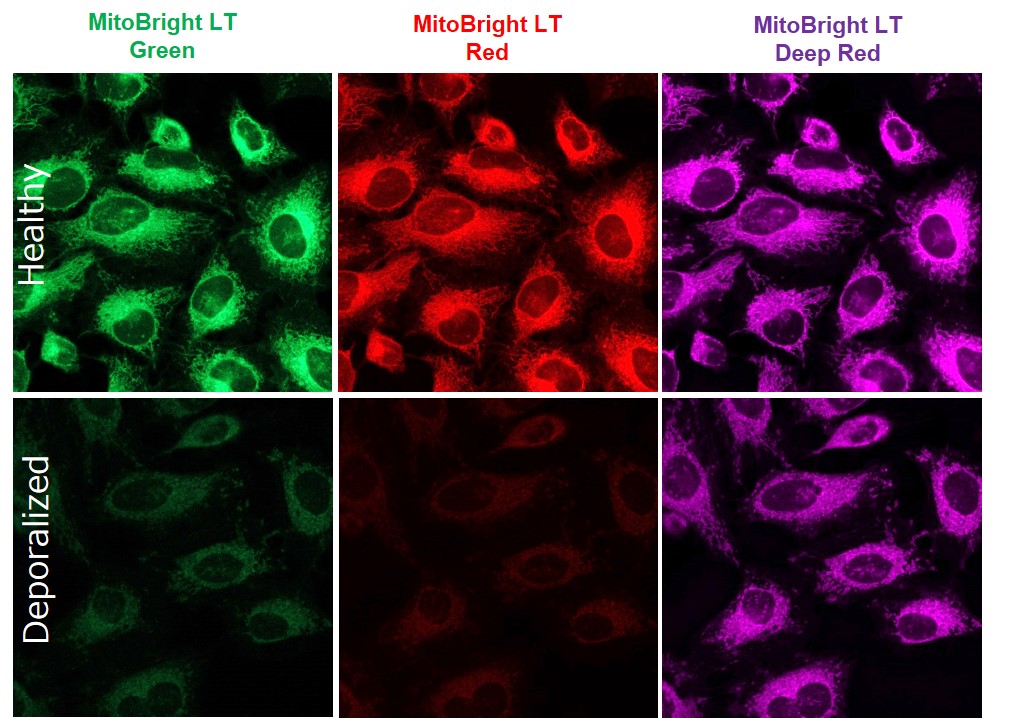
<染色条件>
HeLa細胞をMitoBright LT (100 μmol/l、30分インキュベーション)にて染色しHBSSにて洗浄後
FCCP処理(100μmol/l 、60分インキュベーション)しHBSSにて2回洗浄後観察した。<検出条件>
MitoBright LT Green :Ex 488 nm/Em 500–560 nm
MitoBright LT Red :Ex 561 nm/Em 560–620 nm
MitoBright LT Deep Red :Ex 640 nm/Em 650–700 nm