HilyMax
遺伝子導入試薬
- 多岐にわたる細胞へDNAを高効率に導入
- 血清を含む培地での導入が可能
- 導入遺伝子の細胞内シグナル応答が良好
- コストパフォーマンスに優れた純国産導入試薬
-
製品コードH357 HilyMax
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 1 ml | ¥25,900 | 342-91103 |
内容物が微量のため確認しづらい場合があります。
内容物の確認についてはこちら
| 1 ml | ・HilyMax Reagent ・lipoform Buffer |
1 tube 1.0 ml×1 |
|---|
性質
HilyMax(ハイリーマックス)は、カチオン性リポソームを利用した導入試薬である(特許第4911416号)。 多岐にわたる動物細胞へプラスミドDNAを高効率に導入することができ、またsiRNA用導入試薬としても使用可能である。 培地中の血清の影響を殆ど受けないため、遺伝子導入時の面倒な培地交換をする必要がない。HilyMaxは、化学合成品のため、遺伝子導入時に影響を及ぼす可能性のある生物由来成分は含まれていない。
技術情報
初代培養神経細胞への応用
Rat primary cortical neurons への導入事例
こちら(PDF)からもご覧いただけます。
Reagents:2.5μl Plasmid:1.5 μg
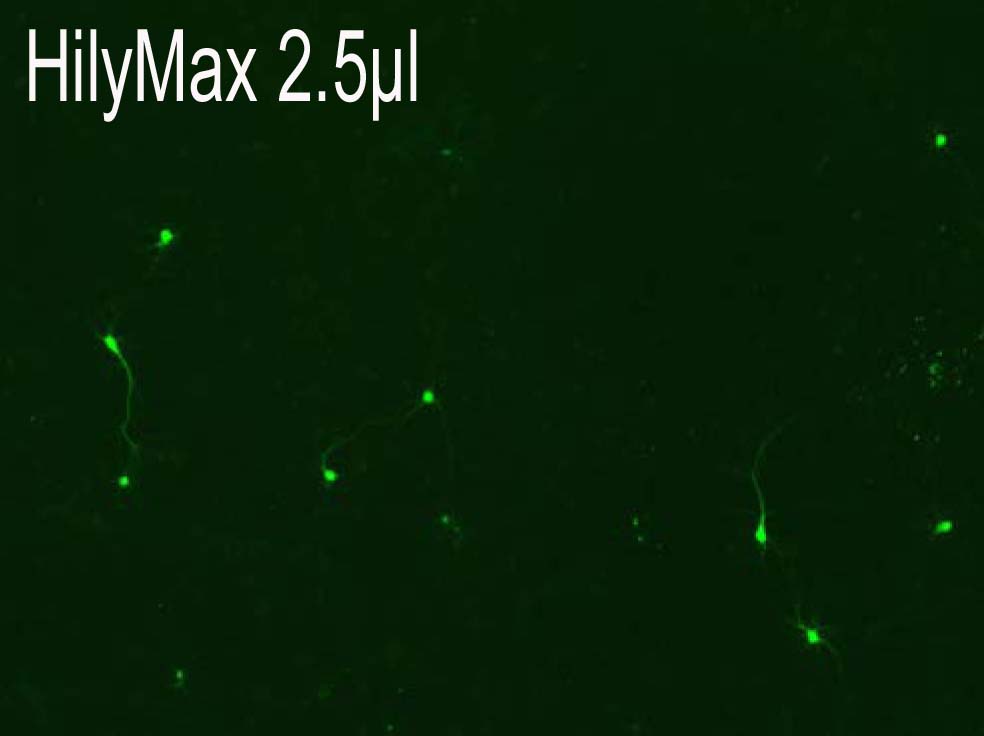 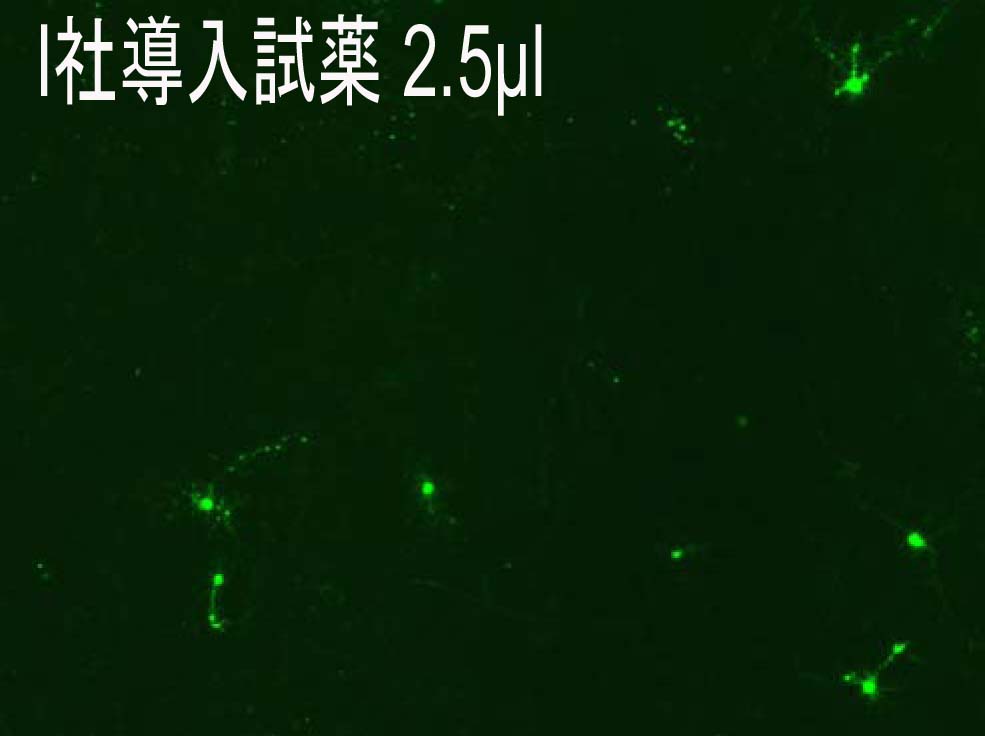  |
Reagents:5.0 μl Plasmid:1.5 μg
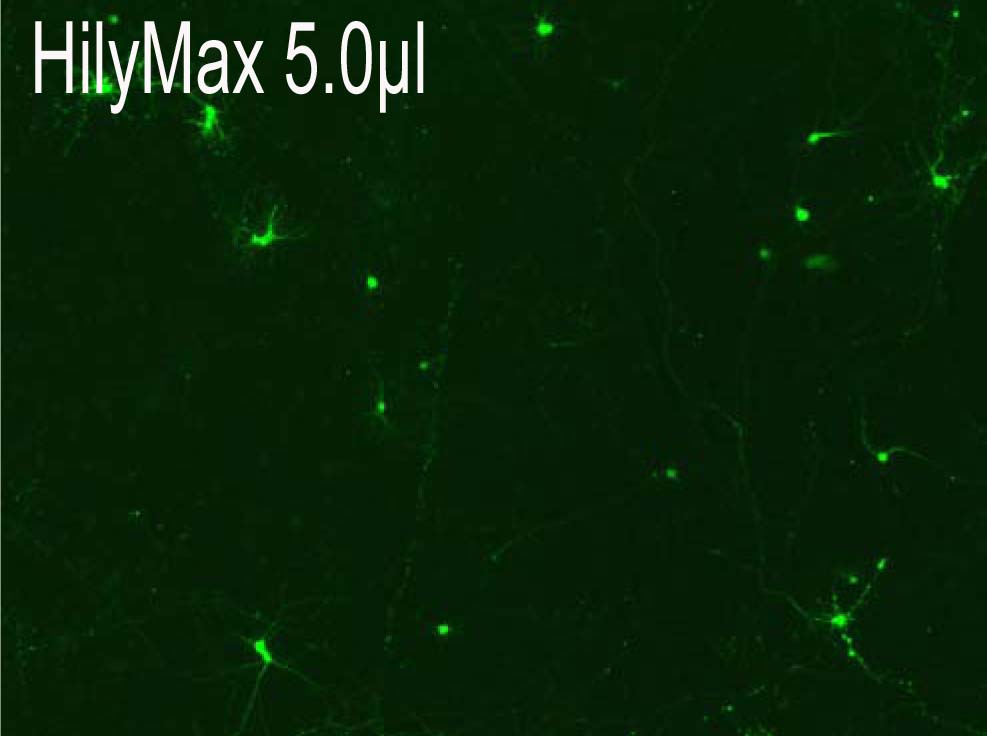 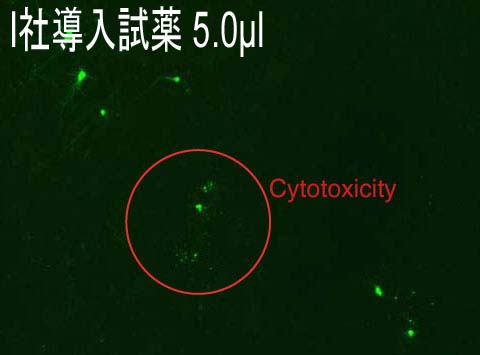 (データ提供:Johns Hopkins University, Dr. Minori Koga) |
Culture Condition
・Cell : Rat primary corical neurons, 100,000 cells/well
・Media :
Media A; Neurobasal Media (500uL) + B-27(10uL) + 0.5mM Glutamine (1.25uL)
Media B; Neurobasal Media (500uL) + B-27(10uL) + 0.5mM Glutamine (1.25uL) + pen/strep (5uL)
・Microplate : 24-well plate
Transfection Condition
・Vector :Conventional expression promoter driven EGFP
・Reagent : HilyMax or Company I
・Ratio : (Reagent):(Plasmid) = (2.5):(1.5)→(5.0):(1.5)
・DNA-HilyMax複合体の調製用培地 : Neurobasal Media
Neurobasal Media(25μl)+plasmid, Neurobasal Media(25μl)+Reagent
→それぞれをNeurobasal Mediaに混和、5分間馴染ませた後に混合し、20分インキュベーションする。
・遺伝子導入後の培地交換 :有(3時間後)
<導入手順>
1.Primary Neuron Cellを24-Well plateにて培養([Media-B]を使用)
2.[Medium-B]を300μl取り除き、[Media-A]を250μl添加し、Total 450μlとする。
(このとき取り除いた[Media-B]は後から使用するので捨てない→[Media-B']とする)
3.ReagentとPlasmidの混合物 50μlを添加し、インキュベーションする。
4.3時間後、Mediaを交換する。
(交換用Media : [Media-B] + [Media-B'] を1:1で混合したものを使用する)
5.48時間後にイメージングを行う。
昆虫細胞への応用
-ショウジョウバエ細胞(S2 cell)における導入事例-
(データ提供:Max Planck Institute of Neurobiology, Dr. Takashi Suzuki)
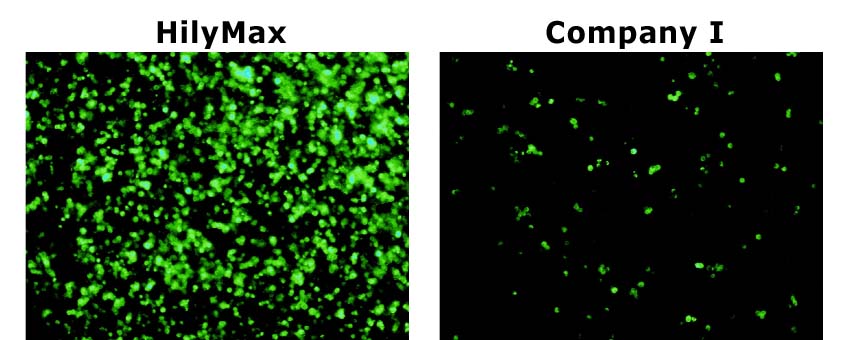
Culture Condition
・Cell : S2(Schneider 2) cell, 200,000 cells/well
・Media : Schneider's Drosophila medium with 10% FCS
・Antibiotics : 50 units Penicillin/ml, 20 μg Streptomycin/ml
・Microplate : 24-well plate
Transfection Condition
・Vector : 1 μg/well [ pAct Gal4(6 kb), pUAS-mCD8::GFP(10 kb) ]
・Reagent : 5 μl/well
・DNA-HilyMax複合体の調製用培地(添加剤) : Schneider's Drosophila medium(without seum and antibiotics)
・遺伝子導入後の培地交換 : 有(4時間後)
*培地交換を行っていただくことで、導入効率の向上が認められます。
シグナル伝達への応用
細胞内へ導入した遺伝子は、一般的に導入操作のみによってタンパクを発現するが、薬物刺激に対して発現する場合もある。
一例として、IL-8プロモーターを組込んだルシフェラーゼ発現プラスミドをA549細胞に導入した場合、HilyMaxで導入した場合と、 他社品で導入した場合とでは、以下のチャートに示す差が観察された。
| 刺激なし | TNF-α添加 | TNF-α、 Dexamethasone添加 |
||
|---|---|---|---|---|
| HilyMax | Luciferase活性(RLU) | 835 | 10313 | 1753 |
| シグナル応答 | 12.4倍↑ | 83%↓ | ||
| 他社品 | Luciferase活性(RLU) | 12053 | 20890 | 12334 |
| シグナル応答 | 1.7倍↑ | 41%↓ |
他社品では、刺激を加える前(刺激なし)からルシフェラーゼが発現している。これをTNF-α刺激するとシグナル応答が増加するが、TNF-α刺激により発現したIL-8の増加量よりも、 ルシフェラーゼ発現量が少ない1) 。一方、HilyMaxで導入を行うと、刺激なしではルシフェラーゼ発現量が少ない。これをTNF-αで刺激することにより、IL-8発現量に相関した シグナル応答がでてくる1) 。
したがって、HilyMaxはシグナル応答をより明確に測定できることが分かる。一方、他社品の導入試薬は、GFP安定発現するHT1080細胞へ導入試薬のみ 添加すると、試薬濃度依存的にGFP発現量が増加することが確認されている2) 。
1) H. Takei, Y. Baba, A. Hisatsune, H. Katsuki, T. Miyata, K. Yokomizo, and Y. Isohama, Glycyrrhizin Inhibits Interleukin-8 Production and Nuclear Factor-κB Activity in Lung Epithelial Cells, but Not Through Gluco- corticoid Receptors, J Pharmacol Sci., 2008, 106, 460-468.
2) T. Tagami, K. Hirose, J. M. Barichello, T. Ishida, and H. Kiwada, Global Gene Expression Pro?ling in Cultured Cells Is Strongly Influenced by Treatment with siRNA-Cationic Liposome Complexes, Pharmaceutical Research, 2008, 25, 11.
siRNA導入例
siRNA用の導入試薬としても使用可能
-
24-wellプレートにてEGFPを発現している細胞に対し、HilyMaxを用いてGFP siRNAを血清存在下でトランスフェクションした。24時間後にフローサイトメトリーにてEGFPのノックダウン率を測定した。
(データ提供:福岡県工業技術センター 生物食品研究所 楠本賢一先生)
【HilyMaxによるsiRNA導入マニュアル】
siRNAとプラスミドを同時に導入するコトランスフェクションが可能です。
詳細なプロトコルではありませんが、下記PDFファイルに導入例を示します。
ご検討の上、ご使用ください。
他社製品との比較例
汎用されている市販の導入試薬と同等かそれ以上の導入効率
|
|
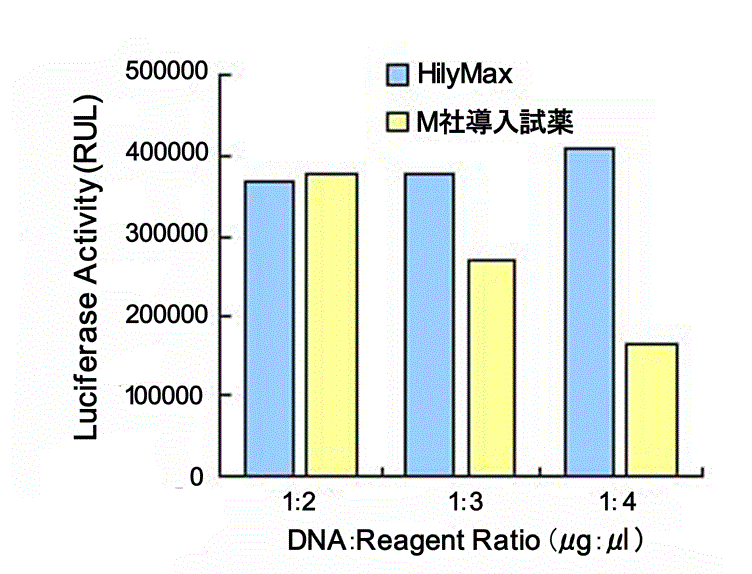
初代培養細胞、血球系細胞での高効率遺伝子導入
- 初代培養細胞(COV)への遺伝子導入
- 血球系細胞(DT40)への遺伝子導入
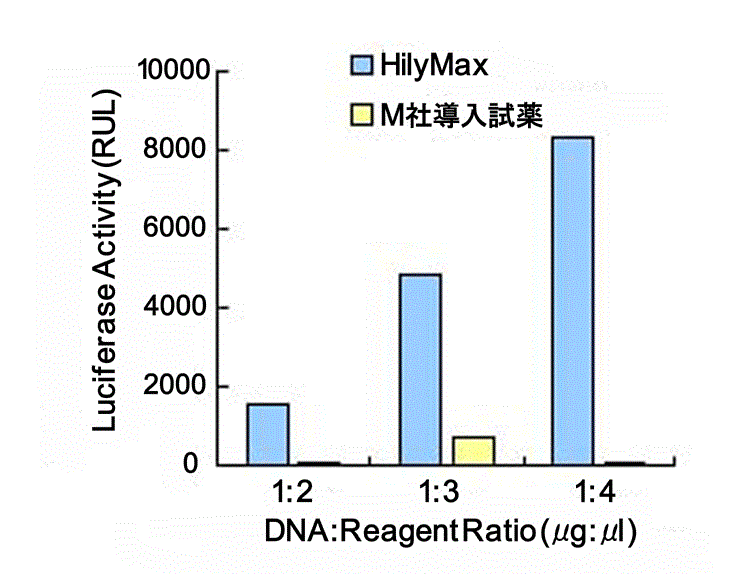
COV(ニワトリ卵巣由来)細胞およびDT40(ニワトリB細胞由来)細胞にpGL3 vectorを血清存在下で遺伝子導入し、24時間後にLuciferase活性を測定した。
(データ提供:就実大学薬学部生物薬学科分子細胞薬学ユニット)
汎用されている細胞へのGFP導入例
CHO cell |
HEK293 cell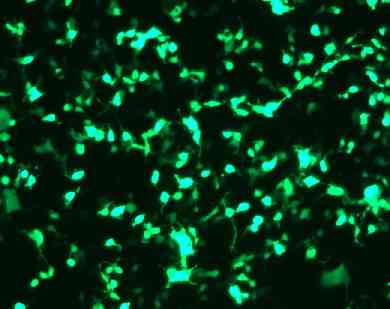 |
A549 cell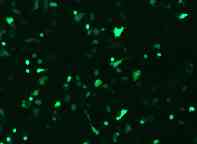 |
HeLa cell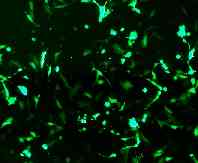 |
NIH3T3 cell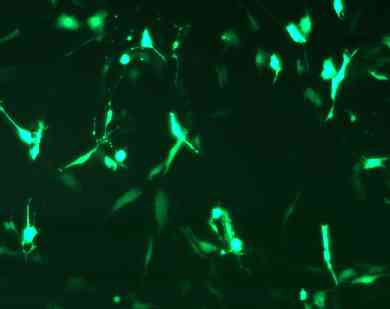 |
導入手順
ワンチューブによるシンプルプロトコール 遺伝子導入前の培地交換が不要
|
STEP 1
無血清培地を別途容器に用意する |
STEP 2
プラスミドDNAを添加する |
STEP 3
DNA溶液にHilyMaxを添加し、室温にてインキュベートする |
STEP 4
DNA-HilyMax複合体を準備した細胞に添加する |
導入実績細胞腫
多岐にわたる細胞への導入実績
インデックス:数字-B C-G H-J K-M N-P Q-
導入条件の詳細は、細胞名をクリックしてください。(一部細胞を除く)
導入条件一覧 ![]() 使用論文一覧
使用論文一覧![]()
参考文献
1) S. Mima, H. Ushijima, H.-J. Hwang, S. Tsutsumi, M. Makise, Y. Yamaguchi, T. Tsuchiya, H. Mizushima and T. Mizushima, "Identification of theTP01gene in Yeast, and its Human Orthologue TETRAN, which Cause Resistance to NSAIDs",FEBS Lett.,2007,581, 1457.
2) T. Namba, T. Ishihara, K. Tanaka, T. Hoshino and T. Mizushima, "Transcriptional Activation of ATF6 by Endoplasmic Reticulum Stressors",Biochem. Biophys. Res. Commun.,2007,355, 543.
3)H. Nakajima, W. Amano, A. Fujita, A. Fukuhara, Y. Azuma, F. Hata, T. Inui and T. Takeuchi, "The Active Site Cysteine of the Proapoptotic Protein Glyceraldehyde-3-phosphate Dehydrogenase Is Essential in Oxidative Stress-induced Aggregation and Cell Death",J. Biol. Chem.,2007,282(36), 26562.
4) A. Endo, D. Sumi and Y. Kumagai, "1,2-Naphthoquinone Disrupts the Function of cAMP Response Element-binding Protein through Covalent Modification",Biochem. Biophys. Res. Commun.,2007,36(1), 243.
よくある質問
-
Q
遺伝子導入後の培地交換は必ず行う必要はありますか?
-
A
低い細胞毒性と高い導入効率を望まれる場合は、培地交換をお勧めします。
しかし、細胞(例:CHO細胞など)によっては、培地交換が毒性や導入率に影響しないものもありすので、細胞系にあわせて行ってください。
-
Q
導入効率が悪かった場合、どのような点を検討すれば良いでしょうか? (DNA量,HilyMax量,複合体形成比,時間など)
-
A
<細胞毒性が低い>
導入効率が極端に低い場合は、DNA量を増やすか、DNA(μg):HilyMax(μL)=1:5~1:9にしてみてください。
高い導入効率を示す場合があります。
<細胞毒性が高い>
DNA量またはHilyMax量を減らしてください。
-
Q
説明書には、保存条件が『冷蔵』と『冷凍』の2つの記載があります。 どのように保存すればよいのでしょうか? 最初から『冷凍』したり、ずっと『冷蔵』ではダメですか?
-
A
未開封・未使用の場合には『冷蔵保存』、試薬を緩衝液と混合し溶解した後は『冷凍保存』してください。
未開封の状態で『冷凍保存』いただいても品質には問題はありませが、使用時に凍結した[Lipoform Buffer]を融解していただく必要があります。また、溶解後に関しては、2~3週間以内に使い切る場合であれば『冷蔵保存』いただいても性能に影響はありません。数週間を越える使用の場合には、必ず『冷凍保存』してください。
取扱条件
| 保存条件: 冷蔵 |






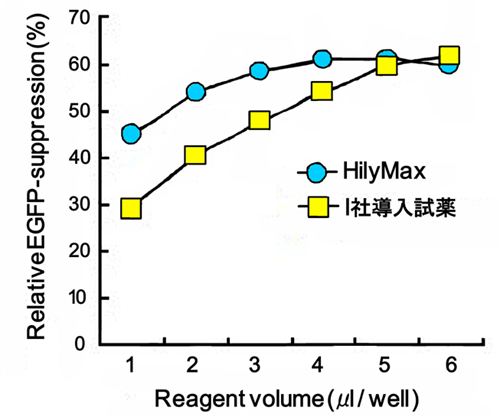
 siRNA導入プロトコル
siRNA導入プロトコル