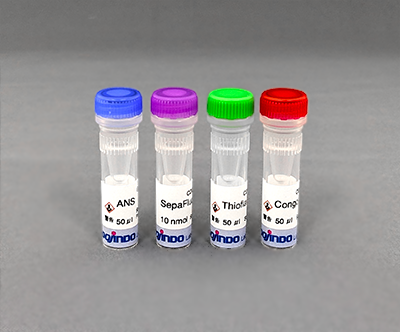
LLPS Characterization-dye Set

LLPS 性質評価蛍光色素セット
- 相分離液滴の性質を確認できる色素セット
- 液滴に含まれる疎水性相互作用の強いタンパク質やアミロイドを染色
- 液滴のゲル状や凝集体への変化を捉える色素も同梱
-
製品コードLL03 LLPS Characterization-dye Set
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 1 set | ¥39,800 | 349-10251 |
| 1 set | ANS SepaFluor Thioflavin T Congo Red |
50 μl×1 10 nmol×1 50 μl×1 50 μl×1 |
|---|
液- 液相分離(LLPS)とは
液‐液相分離( liquid-liquid phase separation: LLPS)は細胞内で特定の分子が局所的に集まり、液体のような性質を持つ生体分子の凝集体(液滴)を形成する現象です。近年、LLPS が細胞内での多くの生物学的プロセスに影響を与えることが明らかになり注目を浴びています。 相分離によって形成される液滴の研究はまだ初期段階ですが、これらの生物学的な現象がどのようにして細胞の機能や疾患の発症に影響を与えるかを解明することは、新しい治療法の開発につながる重要な鍵と考えられています。
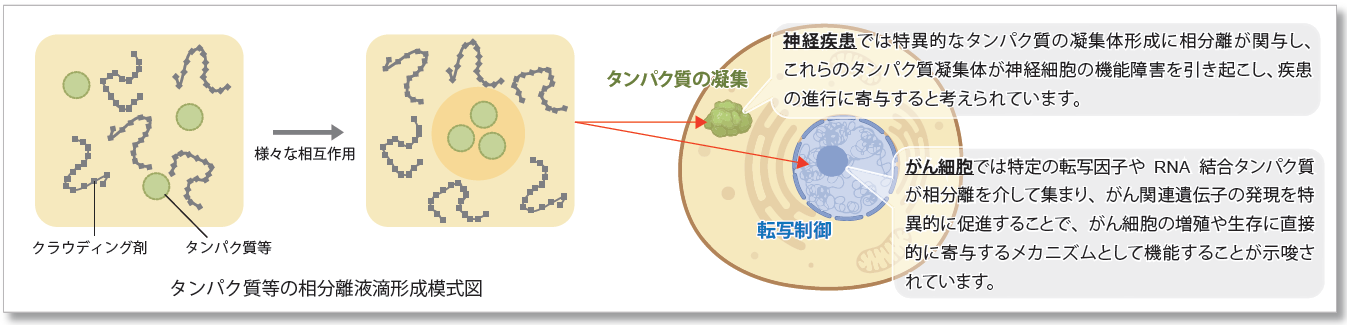
参考文献 E. Dolgin, Nature, 2018, DOI: 10.1038/d41586-018-03070-2.
相分離液滴の性質を調べるのに有用な色素のセット
本キットは、タンパク質間の疎水性相互作用に応答する色素(ANS、SepaFluor)とアミロイド結合性の蛍光染色色素(Thioflavin T、Congo Red) の4種類を同梱しています。さらに、SepaFluorは疎水性相互作用だけでなく、相分離液滴がゲル化したものも観察可能です。これらの色素を用いることで、相分離液滴の性質の理解につながります。
*本キットは、細胞内の相分離液滴には適用できません。細胞外における実験でご使用ください。
*本キットには、標準タンパク質、クラウディング剤、緩衝液等は同梱されておりません。下記別キットをお買い求めください。
▶ 液滴作成法・観察方法の確認 (標準タンパク質同梱) LLPS Starter Kit [LL01]
▶ 標的タンパク質液滴の最適条件の確認(クラウディング剤、緩衝液同梱) LLPS Forming Condition Screening Kit [LL02]
▶ 本キット
| コンポーネント | 性質 |
| ANS (8-anilino-1-naphthalenesulfonic acid) | 疎水場で青色蛍光を発する色素 |
| SepaFluor |
疎水場で紫色蛍光を発する色素 |
| Thioflavin T | アミロイド結合性の緑色蛍光を発する色素 |
| Congo Red | アミロイド結合性の赤色蛍光を発する色素 |
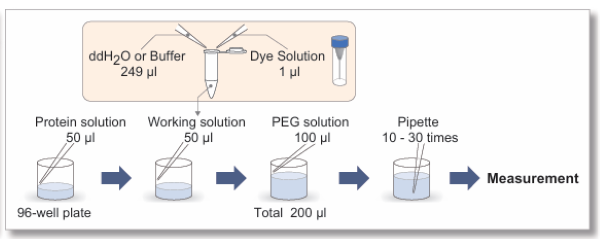
マニュアル
技術情報
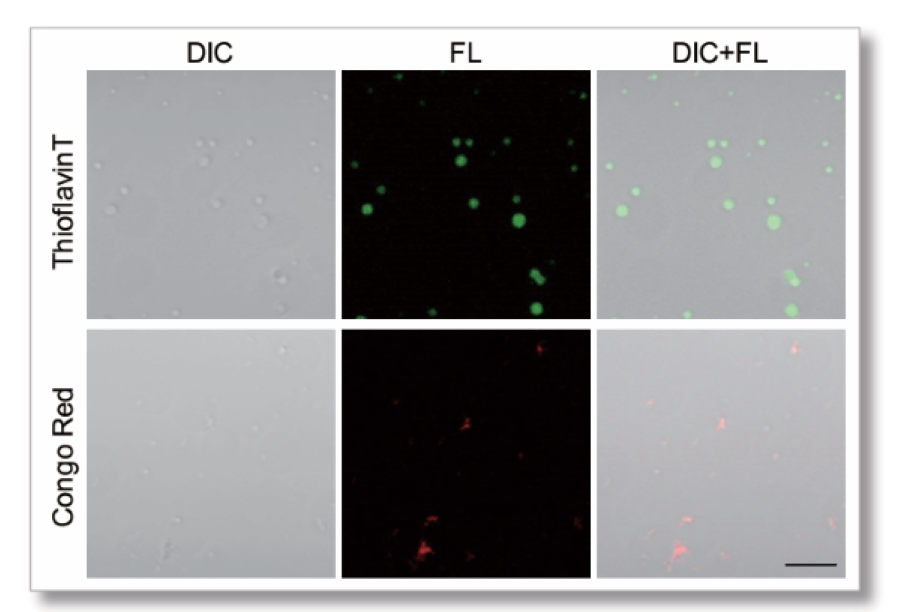
Heparinを用いたTauタンパク質の凝集体の染色
Tauタンパク質とHeparinを用いて相分離液滴を作製しました。 作製時、Thioflavin TまたはCongo Redを添加しました。
【サンプル】
Tau-441 (2N4R) WT:10 μmol/l
Heparin:20 %
Buffer: 10 mmol/l HEPES (pH 7.4) 150 mmol/l NaCl
色素濃度:10 μmol/l
インキュベート(37℃) :10日間
【検出条件】
共焦点レーザー顕微鏡 Zeiss LSM800
・Thioflavin T Ex=488 nm, Em=500-600 nm
・Congo Red Ex=561 nm, Em=550-700 nm
Scale bar: 10 μm
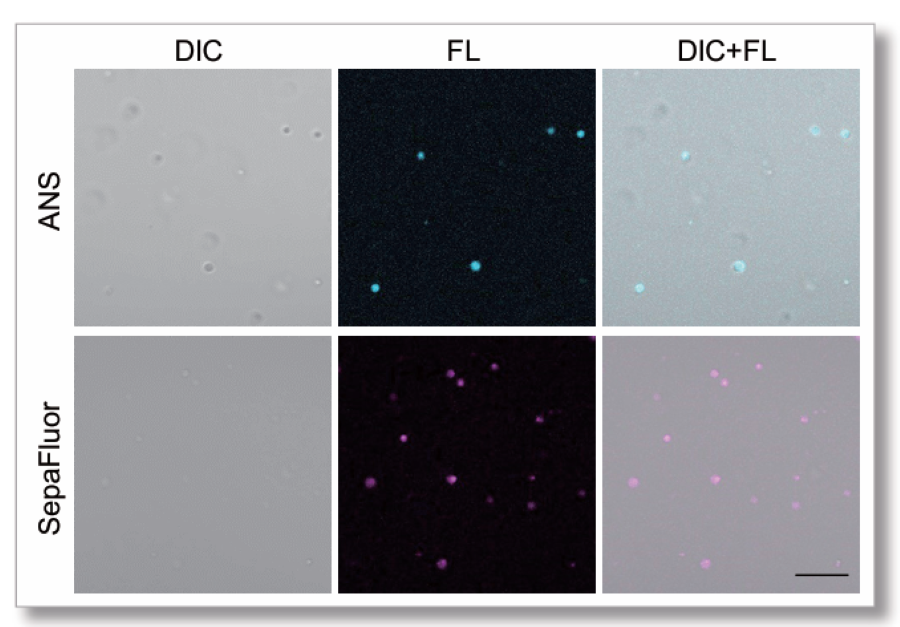
クラウディング剤PEG8000を用いたBSAタンパク質の染色
LLPS Starter Kit (LL01)のウシ血清アルブミン(BSA)タンパク質とクラウディ ング剤PEG8000を用いて相分離液滴を作製しました。作製時、ANSまたは SepaFluorを添加しました。
【サンプル】
BSA:150 μmol/l
PEG8000:15 %
Buffer: 50 mmol/l HEPES (pH 7.4)150 mmol/l NaCl
色素濃度:ANS 10 μmol/l SepaFluor 100 nmol/l
インキュベート(25℃):1時間
【検出条件】
共焦点レーザー顕微鏡 Zeiss LSM800
・ANS Ex=405 nm, Em=400-550 nm
・SepaFluor Ex=640 nm, Em=650-700 nm
Scale bar: 10 μm
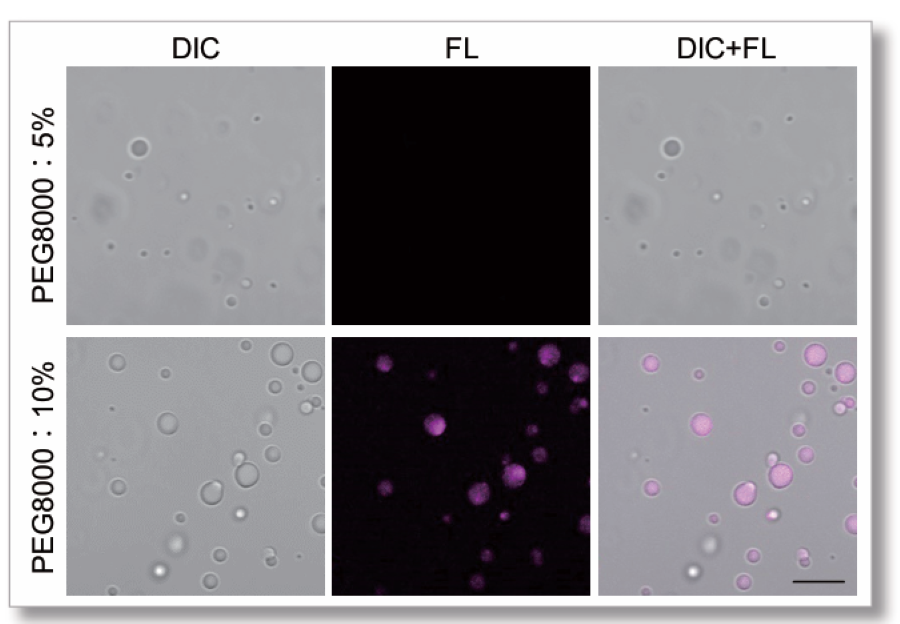
PEG8000を用いたLactoferrinタンパク質の染色
主に静電相互作用で相分離液滴を形成することが知られているLactoferrinタン パク質を用いて実験を行いました。 LLPS Forming Condition Screening Kit (LL02) を用いてPEG8000の濃度検討行い、濃度を高くすると、Lactoferrinの相分離液 滴はゲル化しました。その変化をSepaFluorで検出することができました。
【サンプル】
Lactoferrin:20 μmol/l
PEG8000:5 % or 10 %
Buffer: 20 mmol/l HEPES (pH 7.4)
色素濃度:SepaFluor 100 nmol/l
インキュベート(25℃):1時間
【検出条件】
共焦点レーザー顕微鏡 Zeiss LSM800
・SepaFluor Ex=640 nm, Em=650-700 nm
Scale bar: 10 μm
よくある質問
-
Q
各色素で何回染色できますか。
-
A
96 well plateを使用した場合約2.5枚分になります。
-
Q
染色時間について教えて下さい。
-
A
染色時間は相分離液滴の種類によって異なります。条件を比較するときは、毎回染色時間を統一してください。なお、各色素を用いてTauタンパク質の相分離液滴を10日間染色し続けた実績がございます(観察容器:スライドガラス、穴開き両面テープ、カバーガラス)。
-
Q
相分離液滴を作製した後の染色は可能ですか?
-
A
染色可能です。各色素のDMSO溶液の終濃度が1000倍希釈となるように添加して下さい。
-
Q
96 well plateはどのようなものが使用できますか?
-
A
蛍光顕微鏡での観察を行う場合には、クリアボトムのブラックプレートを使用されることを推奨します。
また、使用実績のあるプレートは下記の通りです。
社名
製品名
Cat No.
ibidi
μPlate 96 well ibiTreat black S 15
ib89626
AGC techno glass
EZVIEW Glass Bottom Culture Plate LB 96well
5866-096
SPL Life Sciences
SPL Cellular Imaging 96 Well Plate Black & Clear Bottom PS
33396
-
Q
相分離液滴が染まりません。
-
A
染色時間を伸ばしたり、染色濃度を上げることで改善する可能性があります。ただし、相分離液滴は、疎水性相互作用や静電相互作用、水素結合、π-π相互作用、カチオン-π相互作用など、タンパク質同士の様々な相互作用よりできています。そのため、疎水性相互作用の弱いタンパク質の相互作用によりできる液滴もございます。例えば、塩類を添加して静電相互作用を確認したり、尿素を加えて水素結合を確認したり、1,6-ヘキサンジオールを添加して疎水性相互作用を確認するなど、複合的なデータよりその性質を判断する必要があります。
参考文献
Manisha Poudyal et al., “Intermolecular interactions underlie protein/peptide phase separation irrespective of sequence and structure at crowded milieu”, Nat. Commun., 2023, 14, 6199.
-
Q
ゲル化について教えてください。
-
A
液滴内部の構造が固まり、流動性が低下すると相分離液滴自体がゲル化していく場合がございます。例えば、経時的な変化やタンパク質濃度の増加、分子の翻訳後修飾の変化、タンパク質のβシート化等の構造変化など、要因は様々です。
取扱条件
| 保存条件:冷凍(-20℃) |