LysoPrime Green - High Specificity and pH Resistance
リソソーム染色色素 Green
- リソソームへの特異性が高い
- リソソームのpH変化の影響を受けにくい
- リソソームを一晩染色できる
-
製品コードL261 LysoPrime Green - High Specificity and pH Resistance
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 10 μl x 1 | ¥15,700 | 345-09903 |
| 10 μl x 3 | ¥32,500 | 349-09901 |
<使用回数の目安> 10 μl あたり、35 mm dish 10 枚、μ-Slide 8 well 10 枚
<保存上の注意>
・長期間の保存は、-80℃以下または液体窒素中での保存が望ましい。
・本製品は冷凍(-20℃)条件下でも経時的に劣化する。
-80℃以下での保存が難しい場合は、できるだけ早く使用すること。
・凍結・解凍の繰り返しは、劣化を促すので避けること。
性質
リソソームは細胞内小器官の一つで生体膜に囲まれた酸性小胞であり、様々な分解酵素を内包しています。また、リソソームは不要な物質を分解することで生体内恒常性の維持に寄与しています。リソソームの機能不全は神経変性疾患等の発症・進展に深く関与していることから、リソソームを詳細に解析することは病態の解明や治療薬の開発において注目を集めています。
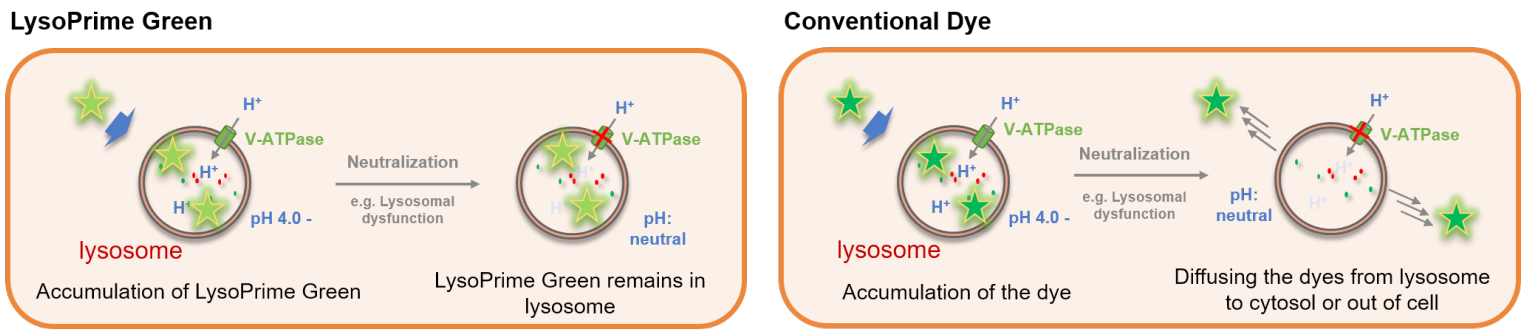
リソソームの生細胞解析では低分子蛍光色素を用いたライブイメージングが汎用されてきましたが、特異性やpH変化による染色能の低下が課題として挙げられてきました。本製品はよりリソソーム特異性が高くpH変化に抵抗性の低分子蛍光色素であり、より正確なリソソームの生細胞解析を可能とします。また、滞留性が高いため長期間のイメージングが必要な実験系にも適応可能です。
マニュアル
技術情報
リソソームへの特異性が高い
既存色素とLysoPrime Greenのリソソーム局在性をリソソームマーカータンパク LAMP1-RFP発現HeLa細胞を用いて比較しました。 既存色素による染色ではリソソーム以外にも分散してバックグラウンドが高くなったのに対し、LysoPrime Greenではバックグラウンドが抑えられる結果が得られました(蛍光画像 Merged)。また、蛍光画像の範囲において蛍光強度を測定した結果、LysoPrime Greenは既存色素と比較してリソソームへの局在性が高いことが判りました(右図)。
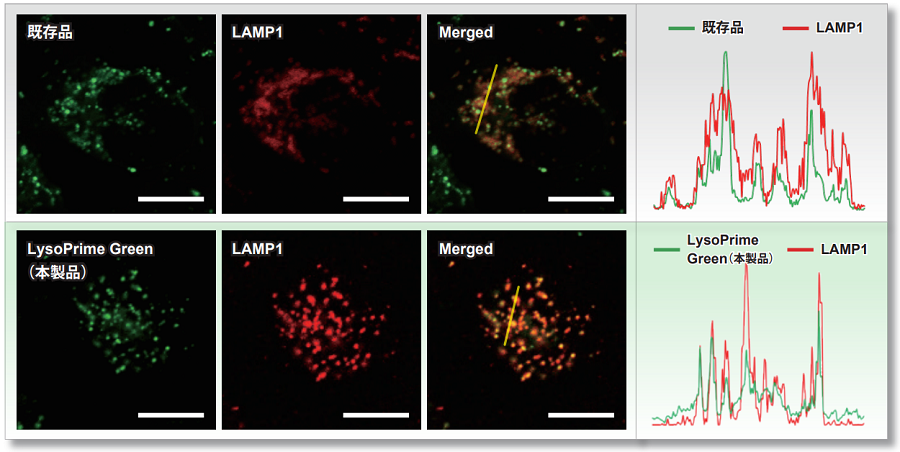
<検出条件>
Green: Ex= 488 nm, Em= 500-570 nm
Red : Ex= 561 nm, Em= 560-620 nm
スケールバー: 20 µm
リソソームのpH変化の影響を受けにくい
LysoPrime Greenおよび既存色素は酸性状態にあるリソソームに集積する性質がありますが、リソソーム酸性阻害剤であるBafilomycin A1で処理し、酸性から中性に変化すると既存色素はリソソームから離れるため蛍光シ グナルは著しく低下します。一方 LysoPrime Green はリソソームへ保持されやすいため、蛍光シグナルの低下が抑えられ、既存試薬に対して鮮明な観測結果が得られました。
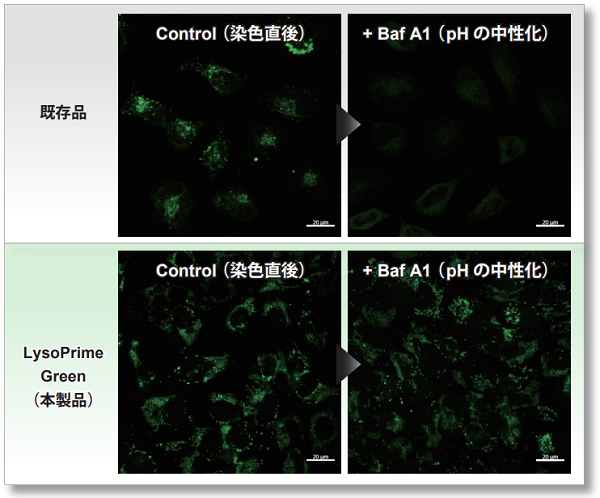
<検出条件>
Green: Ex= 488 nm, Em= 500-570 nm
スケールバー: 20 µm
リソソームへの滞留性が高い
LysoPrime Greenと既存色素のリソソーム滞留性をそれぞれの色素にて染色した細胞を用いて比較しました。既存色素による染色では染色後90分後には蛍光が低下したのに対し、LysoPrime Greenでは蛍光輝度は維持され滞留性が高い結果が得られました。
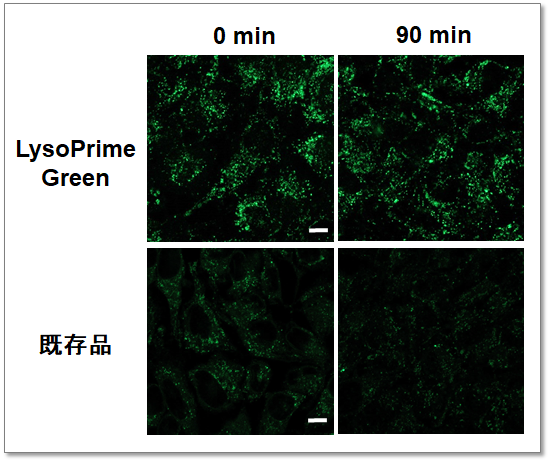
<検出条件>
Green: Ex= 488 nm, Em= 500-570 nm
スケールバー: 10 µm
さらに、LysoPrime Greenもしくは既存品で染色したHeLa細胞をトリプシン処理し回収を行った後、フローサイトメーターを用いて蛍光輝度を確認しました。既存品はトリプシン処理後に染色した蛍光輝度に比べ、トリプシン処理前に染色した蛍光輝度が大きく減少したのに対し、LysoPrime Greenはトリプシン処理前後の染色にて蛍光輝度の差が少ない結果が得られました。LysoPrime Greenは前処理による色素の漏れ出しが低いことがわかりました。
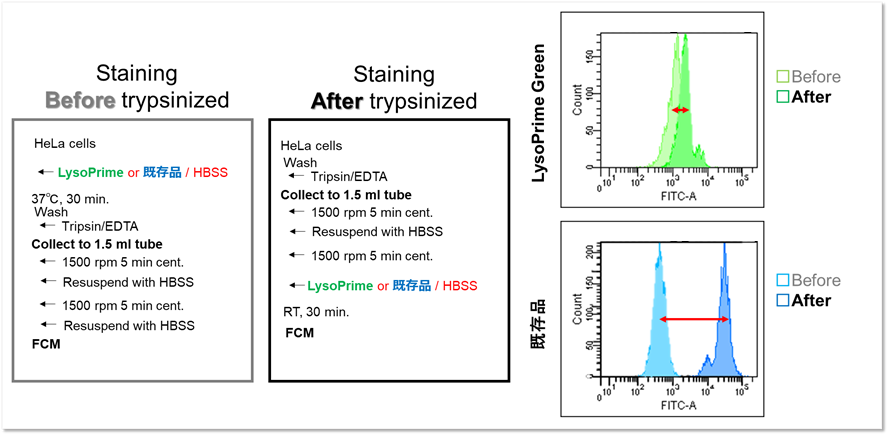
<検出条件>
Filter: FITC (Ex= 488 nm, Em= 515-545 nm)
実験例:リソソーム酸性阻害剤を用いた評価(LysoTracker™ Redとの共染色)
HeLa細胞のリソソームをLysoPrime GreenとLysoTracker™ Redで共染色した後、リソソーム阻害剤Bafilomycin A1を添加して蛍光イメージングを行いました。LysoPrime Greenの蛍光シグナルは、Bafilomycin A1の有無にかかわらず殆ど変化しませんが、LysoTracker™ Redは、Bafilomycin A1添加に伴うリソソーム中性化により蛍光シグナルが低下することが観察されました。このように両方の試薬を組み合わせることで、リソソームの量とpH変化を同時に評価することが可能になります。さらに、この蛍光輝度はプレートリーダーを用いて数値化を行う事ができました。
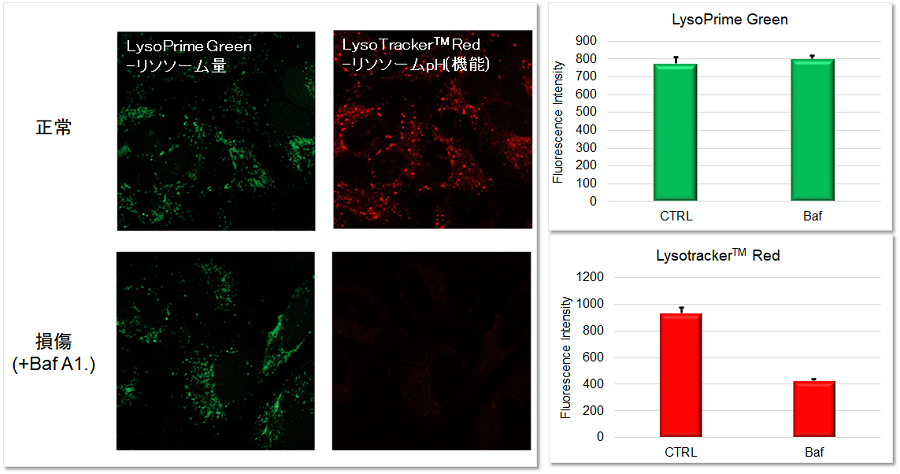
<検出条件>
共焦点レーザー顕微鏡
LysoPrime Green: Ex=488 nm, Em=500-570 nm
LysoTracker™ Red: Ex=561 nm, Em=560-620 nm
スケールバー: 20 µm
プレートリーダー
LysoPrime Green: Ex=445-455 nm, Em=530-550 nm
LysoTracker™ Red: Ex=565-575 nm, Em=610-630 nm
実験例:時間依存的に取り込まれるエクソソームの局在やエンドサイト―シス経路の解析
LysoPrime Greenで染色したHeLa細胞に、ExoSparkler Exosome Membrane Labeling Kit-Deep Red (製品コード: EX03)を用いて染色したエクソソームを添加して蛍光イメージングを行いました。LysoPrime Greenの蛍光シグナルは低下せず経時的なリソソームの局在が確認され、ExoSparkler Deep Redの蛍光シグナルは増加し時間依存的なエクソソームの取り込み量の増加が確認されました。
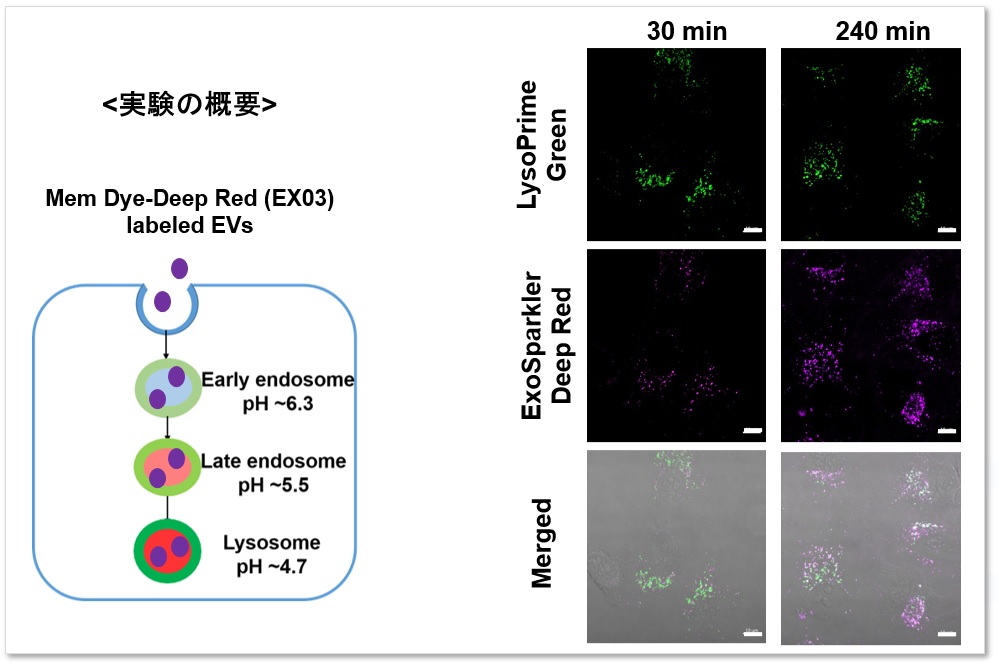
<検出条件>
Green: Ex= 488 nm, Em= 500-570 nm
Deep Red : Ex= 640 nm, Em= 640-700 nm
スケールバー: 20 µm
また、エンドソームがリソソームへの成熟を阻害する阻害剤であるBafilomycin A1を添加した細胞群と比較を行いました。LysoPrime Greenの蛍光シグナルは低下せず経時的なリソソームの局在が確認されましたが、ExoSparkler Deep Redの蛍光シグナルはBafilomycin A1添加群で確認されませんでした。このことよりBafilomycin A1によりエンドサイトーシスの成熟が阻害されていることがわかりました。このように、両方の試薬を組み合わせることによりエンドソームからリソソーム経路を詳細に解析することが可能になります。
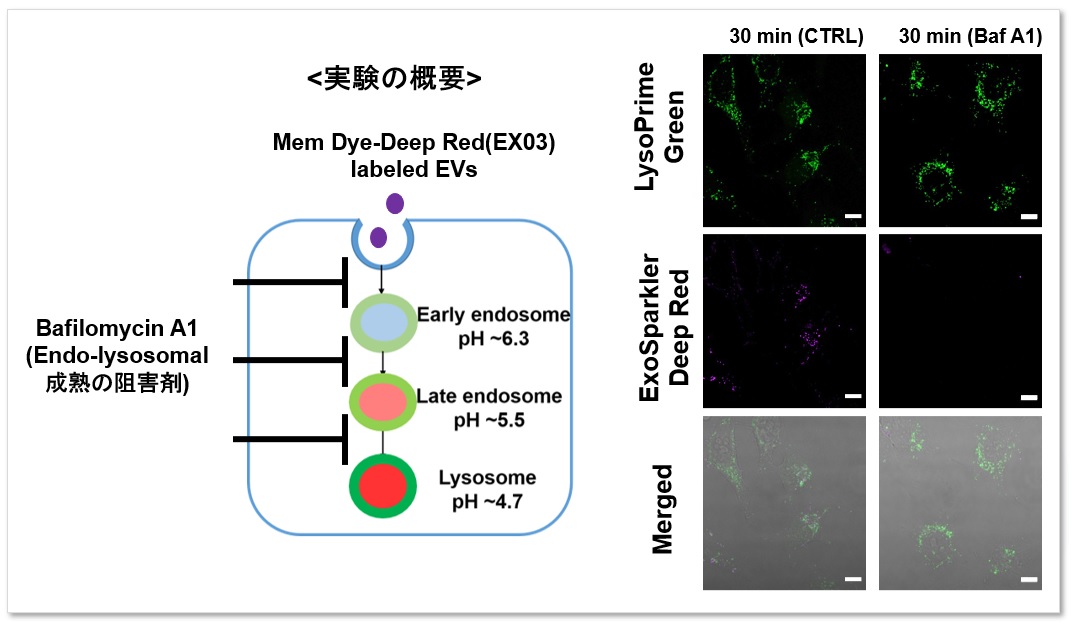
<検出条件>
Green: Ex= 488 nm, Em= 500-570 nm
Deep Red : Ex= 640 nm, Em= 640-700 nm
スケールバー: 20 µm
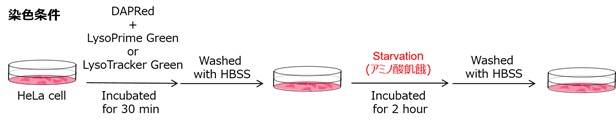
実験例:オートファジー検出試薬との併用
オートファジー検出色素DAPRed - Autophagy Detection (製品コード: D677)とLysoPrime Greenもしくは既存品で染色したHeLa細胞に、アミノ酸飢餓の刺激を与え蛍光イメージングを行いました。既存品では蛍光シグナルが低下し、飢餓培養後のリソソーム局在を確認できませんが、LysoPrime Greenの蛍光シグナルは低下せず経時的なリソソームの局在が確認されました。このことより、DAPRedの蛍光輝点が既存品よりも共局在率が高くなるため、より正確なオートファジー解析をすることが可能です。
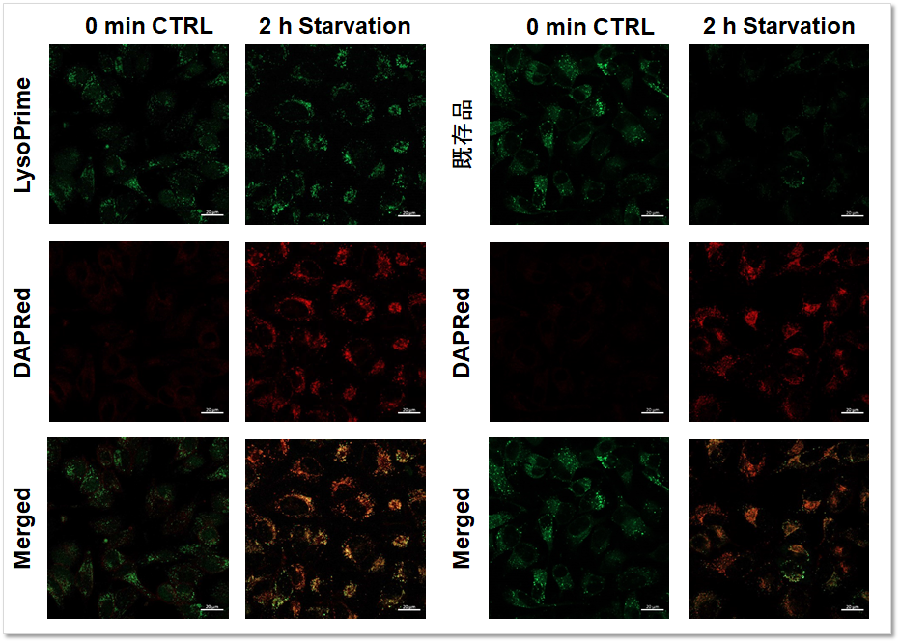
<検出条件>
Green: Ex= 488 nm, Em= 500-570 nm
Red : Ex= 561 nm, Em= 560-650 nm
スケールバー: 20 µm
実験例:マイトファジー検出試薬との併用
マイトファジー検出キットMitophagy Detection Kit(製品コード: MD01)とLysoPrime Greenもしくは既存品で染色したSHSY-5Y細胞に、マイトファジー誘導の刺激を与え蛍光イメージングを行いました。既存品では蛍光シグナルが低下し、マイトファジー誘導後のリソソーム局在を確認できませんが、LysoPrime Greenの蛍光シグナルは低下せず経時的なリソソームの局在が確認されました。このことより、Mtphagy Dyeの蛍光輝点が既存品よりも共局在率が高くなるため、より正確なマイトファジー解析をすることが可能です。
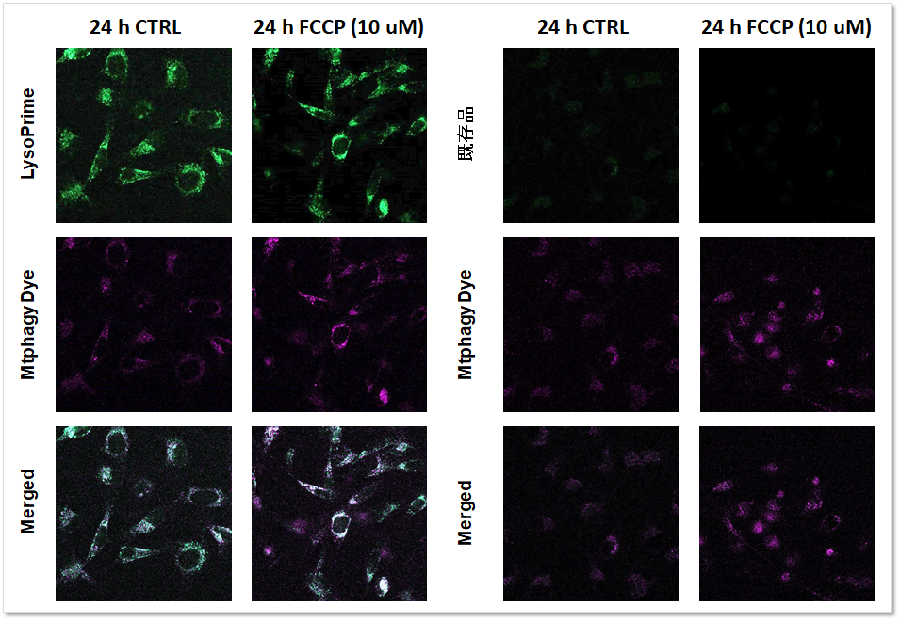
<検出条件>
LysoPrime Green: Ex= 488 nm, Em= 500-570 nm
Mtphagy Dye: Ex= 561 nm, Em= 560-650 nm
参考文献
| 文献No. | 対象サンプル | 装置 | 引用(リンク) |
|---|---|---|---|
| 1) | 細胞 CHO Cells |
共焦点顕微鏡 | M. Houser, S. Mitchell, P. Sinha, B. Lundin, O. Berezovska, M. Maesako, "Endosome and Lysosome Membrane Properties Functionally Link to γ-Secretase in Live/Intact Cells", Sensors, 2023, doi:10.3390/s23052651. |
よくある質問
-
Q
輸送温度と保存温度(-80℃)が異なっていたのですが性能は問題ないのでしょうか。
-
A
本品は冷凍(-20℃)で輸送されますが、輸送に想定される期間で製品性能に影響を与える劣化や分解はございません。お手元に届き次第、-80℃にて保存して下さい。
なお、小社では本品を室温(25℃)で一ヶ月間保存した場合でも、リソソームの染色性能に影響がないことを確認しています。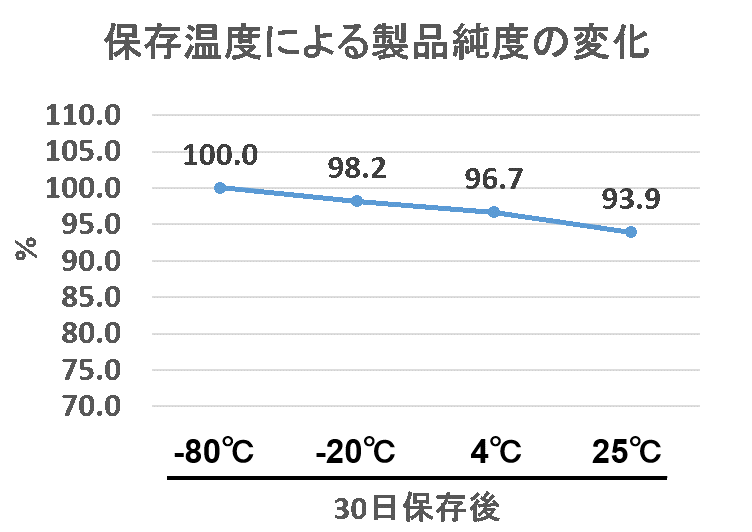
※-80℃保存の純度を100%とした場合のHPLC純度推移
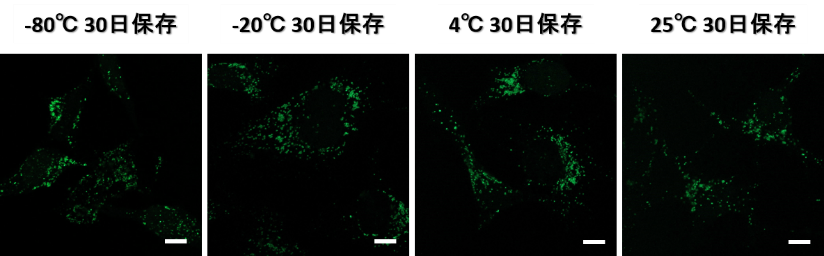
スケールバー:10 µm
-
Q
染色後にリソソーム以外が染まっているように見えるのですが。
-
A
LysoPrime Greenがリソソーム以外の核やその他オルガネラに非特異的吸着を起こした可能性が考えられます。LysoPrime Greenの最適な濃度は細胞種や細胞密度に影響するため、Working solutionの希釈倍率について1,000-4,000 倍の範囲を目安に最適濃度の検討を行ってください。参考として、HeLa細胞を用いてWorking solutionを各希釈倍率で染色した際の蛍光染色画像を掲載します(1,000 倍希釈時に非特異的吸着が観察されました)。
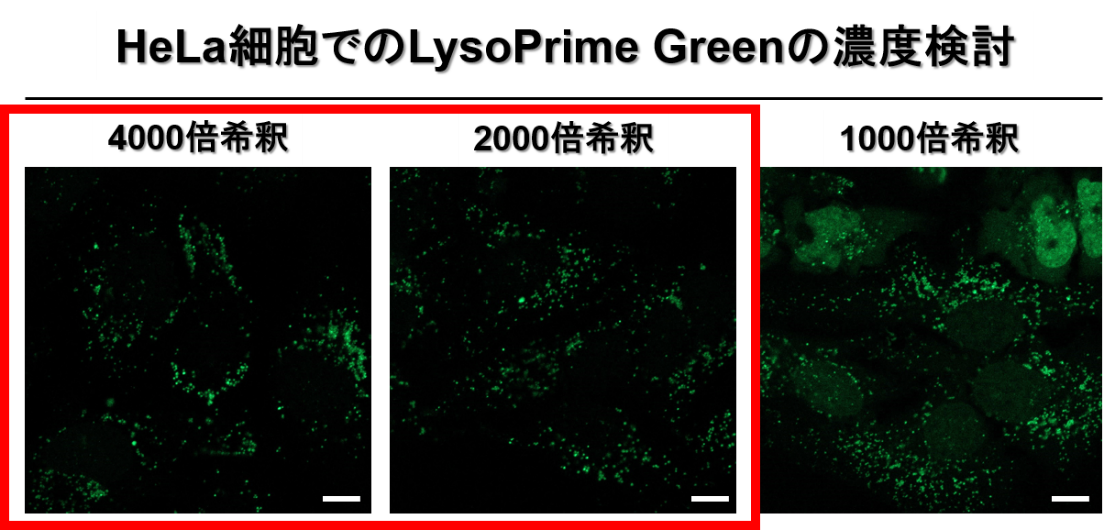
※スケールバー:10 µm
-
Q
血清含有培地で染色できますか。
-
A
染色できません。LysoPrime Greenは血清の影響を受けるため必ずHBSSや無血清培地等の血清を含まない溶液でworking solutionを作成してください。
-
Q
リソソームpHに影響を与える薬剤刺激を考えています。LysoPrime Greenの染色は、薬剤添加の前と後どちらで行えばいいですか。
-
A
染色後の刺激を推奨しております。LysoPrime GreenはpH依存的にリソソームに集積しますが、集積後にpHが変化してもリソソームに滞留し続けます。一方で、あらかじめ薬剤刺激等によりpHが中性付近に変化したリソソームにはLysoPrime Greenが集積できないため染色できません。そのため、染色能に影響が少ない染色後の薬剤刺激を推奨しております。
-
Q
落射型顕微鏡でも観察できますか?
-
A
落射型顕微鏡でも観察は可能ですが、細胞によっては、確認が困難な場合があります。 その際は、共焦点顕微鏡で観察されることをお勧めします。