Cellular Senescence Detection Kit - SPiDER-βGal
老化細胞検出キット
- SA-βgalの定量が可能
- 生細胞と固定細胞どちらも染色可能
- 色素の染色時間は 30分
-
製品コードSG03 Cellular Senescence Detection Kit - SPiDER-βGal
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 10 assays | ¥49,700 | 347-09181 |
SPiDER-βGalは、株式会社同仁化学研究所・株式会社東京大学TLOの登録商標です(登録商標第6331186号)
| 10 assays | [10 assays: 35 mm dish] ・SPiDER-βGal ・Bafilomycin A1 |
x 1 x 1 |
|---|
性質
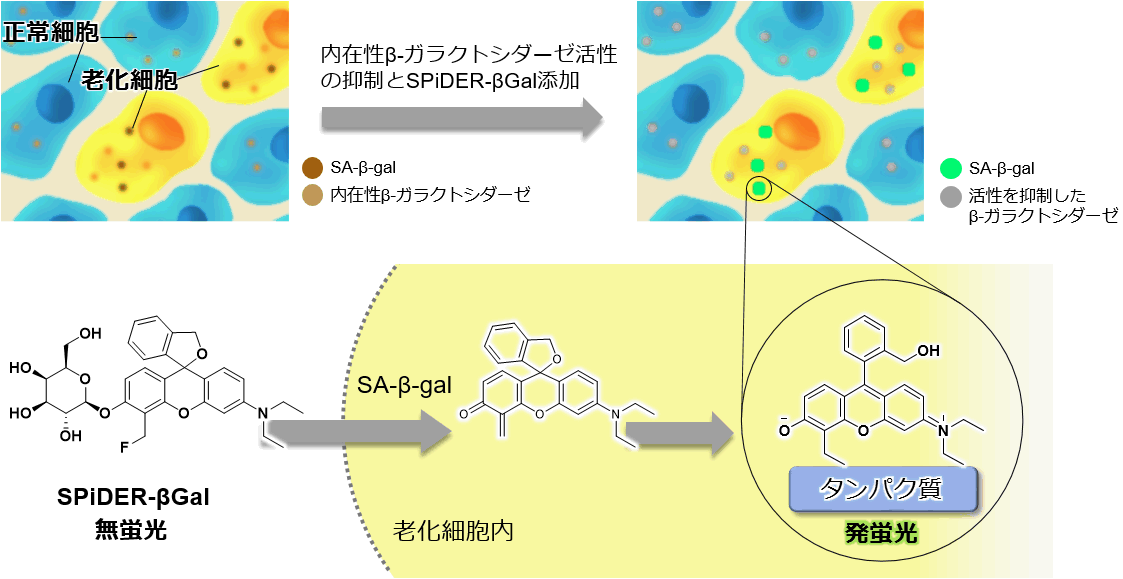
正常細胞は、分裂を繰り返すことや、酸化ストレス等によりDNAに損傷を生じる。損傷DNAが修復されない異常細胞がこれ以上増えないようにするため、不可逆的に分裂を停止する細胞老化が引き起こされる。このようにして生じた老化細胞において過剰発現が認められるSA-β-gal(senescence-associated β-galactosidase)は、老化マーカーの1つとして広く用いられている。代表的なSA-β-galの検出方法としてX-gal染色が広く利用されているが、(1)細胞膜透過性が乏しいため細胞を固定化する必要がある、(2)染色された細胞とそうでない細胞とを目視により見分ける必要があるため定量性に欠ける、(3)染色に時間を要する、などが課題となっている。
本キットに含まれるβ-galactosidase検出試薬SPiDER-βGalは、細胞膜透過性が高く、優れた細胞内滞留性を有し反応後の基質が細胞外へ漏れ出さない、という性質を有し、細胞内β-galactosidaseの高感度検出、短時間染色を実現できる。また、蛍光検出が可能なことから、X-gal染色法では適用できなかったフローサイトメトリーも利用することができ、定量性のあるデータを取得できる。なお、生細胞のみならずX-gal法と同様に固定化細胞を用いてもSA-β-galを簡便かつ迅速に検出することが可能である。
老化細胞検出用試薬の選択ガイド
| 製品名 | サンプル | 対応装置 | 色素 / 検出波長 |
| 生細胞 固定化細胞 |
 |
SPiDER-βGal |
|
| Cellular Senescence Detection Kit- SPiDER Blue |
固定化細胞 |  |
SPiDER-Blue Ex: 350-450 nm / Em: 400-500 nm |
| SPiDER-βGal | 組織 |  |
SPiDER-βGal Ex: 500-540 nm / Em: 530-570 nm |
| Cellular Senescence Plate Assay Kit- SPiDER-βGal |
生細胞 |  |
SPiDER-βGal |
技術情報
原理
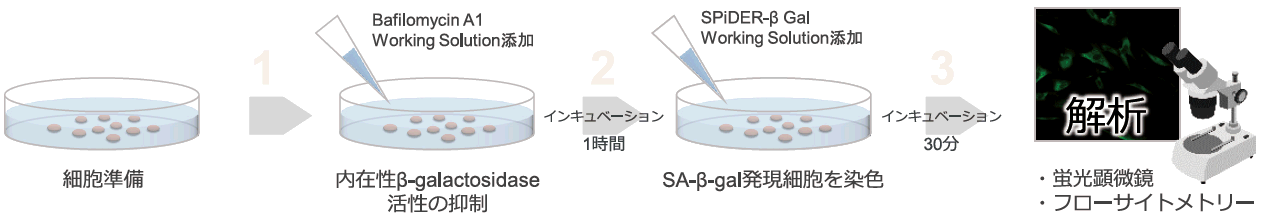
本キットのβ-galactosidase検出試薬SPiDER-βGalは、細胞膜透過性を有するため、特別な膜透過処理や固定化操作は不要で生細胞に適応できる。細胞膜を透過したSPiDER-βGalは、SA-β-galと反応することで蛍光を発し、かつ近傍のタンパク質と共有結合する。また、SPiDER-βGalを添加する前に本キットに含まれるBafilomycin A1を添加することで、生細胞中の内在性β-galactosidaseの活性を抑制し、バックグラウンド抑えた状態でSA-β-galを蛍光検出できる。
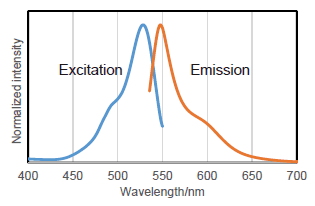
蛍光特性(β-galactosidaseと反応後のSPiDER-βGal)
|
||
|
<観察条件の実績> |
既存法との比較
| 製品名 | 生細胞 | 固定化細胞 | 細胞内滞留性 | 検出 | 対応装置 | 染色時間 | 備考 |
|---|---|---|---|---|---|---|---|
|
Cellular Senescence Detection Kit |
〇 | 〇 | ◎ | 蛍光 | 蛍光顕微鏡・FCM | 30分 |
・高感度のため短時間の染色、定量解析が可能 ・異なる老化マーカーと多重染色が可能 |
| 〇 | - | - | 蛍光 | プレートリーダー | 30分 |
・96ウェルプレートに試薬を加えるだけでSA-βGal活性の数値化が可能 ・多検体評価が可能 |
|
| C12FDG | △ | △ | △ | 蛍光 | 蛍光顕微鏡・FCM | 1~2時間 | ・細胞膜透過性が低いため、染色時間がSG03よりも長い |
| X-Gal | × | 〇 | 〇 | 比色 | 顕微鏡 | 一晩 | ・目視でのカウントのため、客観的な測定が難しい |
簡便な操作
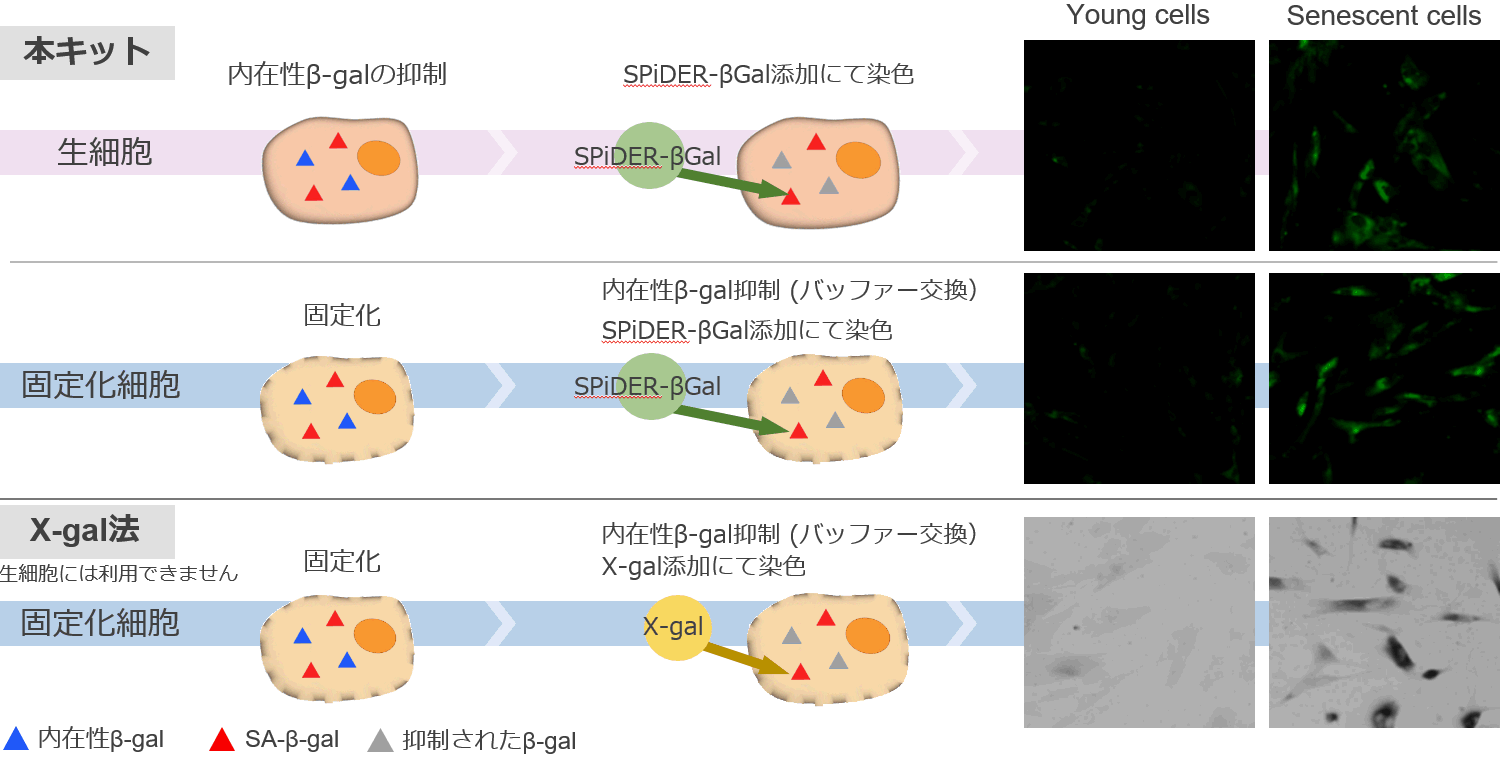
特長①.生細胞も固定化細胞も適用できる
固定化細胞の場合、Bafilomycin A1を添加する必要はなく、取扱説明書に記載された手順に従うことでSA-β-galを検出できる。
※Bafilomycin A1 を添加する理由 : よくある質問「Bafilomycin A1 を添加する理由を教えて下さい。」の項をご確認ください。
特長②.定量が容易にできる
| ○本キットでは 蛍光による検出なのでフローサイトメトリーによる定量解析ができる |
○従来法(X-gal法)では 目視による判断のため、客観的な測定が難しい。 |
|
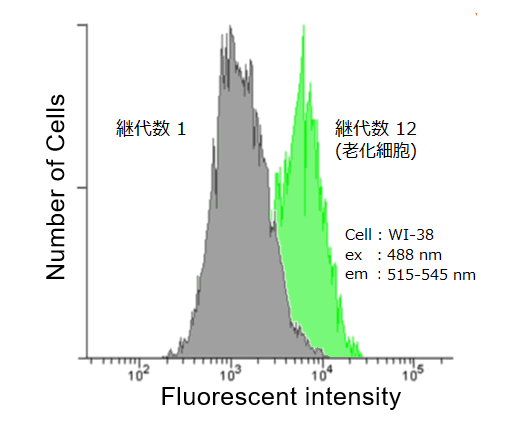 |
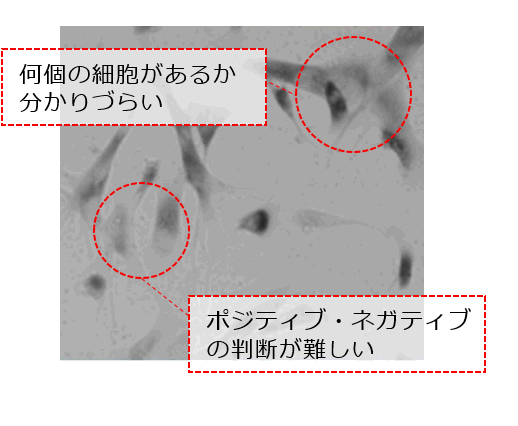 |
|
| 検出系: 蛍光顕微鏡、フローサイトメーター、プレートリーダー | 検出系: 蛍光顕微鏡のみ |
プレートリーダーを使った SA-βGal の測定を行う場合、プレートリーダー測定用に最適化した Cellular Senescence Plate Assay Kit - SPiDER-βGal のご使用をおすすめいたします。
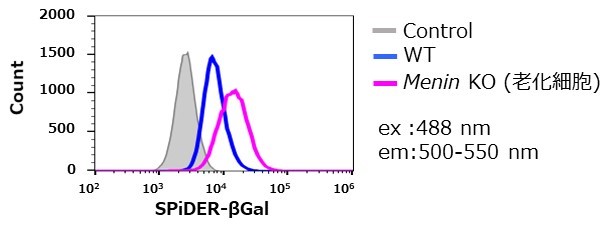
T細胞(浮遊細胞)の細胞老化: フローサイトメーター
愛媛大学大学院医学系研究科 山下政克教授らの研究グループでは、メニン(Menin)というタンパク質が、T細胞の疲弊や老化を制御し、免疫機能を正常に保っていることを明らかにしています。今回、このメニンをノックアウトしたナイーブCD8 陽性T細胞に、インターロイキン2(IL-2)存在下でTCR(T細胞受容体)を刺激することにより、細胞老化が誘導されることを、本キットを用いて確認することができました。
<老化誘導条件>
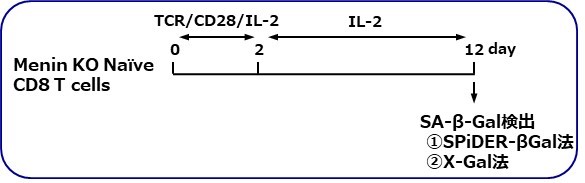
①SPiDER-βGal法による検出
②X-Gal法による検出
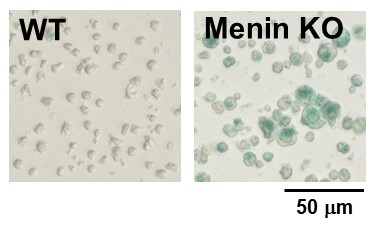
※本実験例は愛媛大学大学院医学系研究科の山下政克教授よりご提供いただきました。
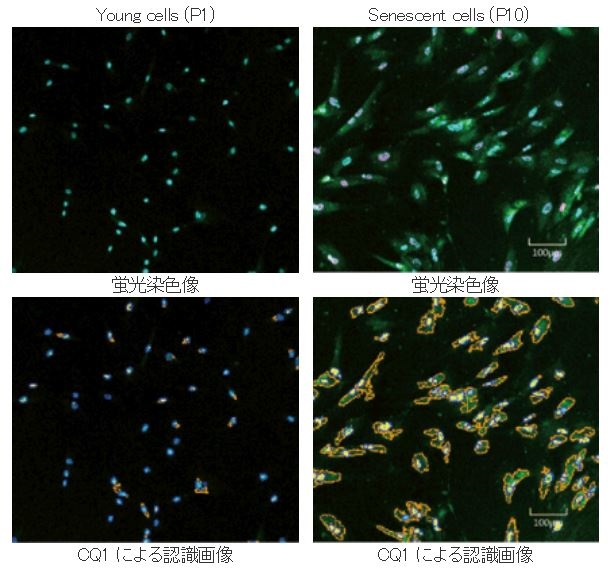
細胞老化の定量解析: 共焦点定量イメージサイトメーター
共焦点定量イメージサイトメーター(横河電機株式会社 CQ1)を用いた老化細胞の定量解析を行いました。
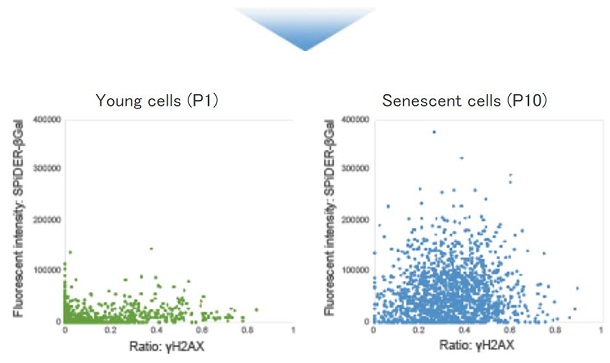
■ 他老化マーカーと共染色と解析
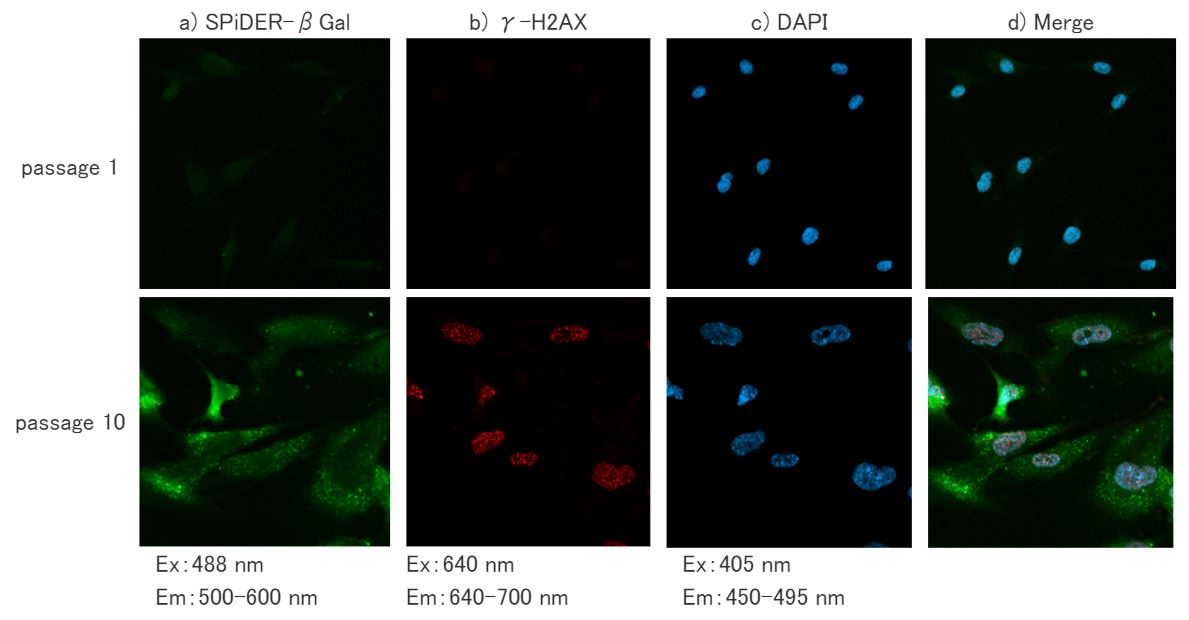
SA-β-galをSPiDER-βGalで生細胞染色して細胞固定及び膜透過処理後、DNA損傷マーカー γ-H2AXを免疫蛍光染色したWI-38細胞を用いて、共焦点定量イメージングサイトメーターで定量解析を行いました。
|
|
■ 生細胞蛍光染色による解析
X-gal法では顕微鏡で目視による全細胞数と老化細胞を計測し、全細胞数に対する老化細胞数の割合を陽性率として評価します。
共焦点定量イメージングサイトメーターを用いて、核染色試薬(Hoechst 33342)で全細胞数を計測し、SPiDER-βGalでSA-β-galを指標とした老化細胞数を計測した後、全細胞数に対する老化細胞数の割合を陽性率として定量解析を行いました。
| □ 横河電機CQ1撮影条件 使用プレート :96 well plate 対物レンズ :10倍 撮影波長 :405 nm (Hoechst 33342): シアン 488 nm (SPiDER-βGal): 緑 視野 :8視野 |
※ SA-β-galポジティブなWI-38細胞(赤色の輪郭)
WI-38細胞の細胞分裂の程度に応じて陽性率に差が認められました。共焦点定量イメージングサイトメーターを用いることで、X-gal法による目視観察と比較して迅速な定量解析が可能となりました。
組織サンプル中のSA-β-gal検出
糖尿病モデルマウスの組織サンプルを用い、SPiDER-βGalによりSA-β-galを検出した論文が公開されました。
※本染色ではSPiDER-βGal[コード:SG02]が使用されています。
<組織サンプルの染色条件>
急速凍結した組織をスライス後、4%パラホルムアルデヒドに浸し20分間、室温でインキュベート。その後、PBSにて洗浄したサンプルに20 μmol/l SPiDER-βGalを加え1時間37℃でインキュベート。最後にサンプルをPBSにて洗浄し観察。
実験操作およびデータの詳細は下記参考文献の2)を参照ください。
一般的な老化細胞マーカー
細胞老化を評価する際には、複数の老化細胞マーカーを指標に解析する必要がある。下表は細胞老化研究分野で広く用いられるマーカーの一例であるが、その中でもSA-β-galは簡便に測定できることから、老化細胞の検出指標として汎用されている。
| ・SA-β-gal | (senescence-associated beta-galactosidase) |
|---|---|
| ・CDKis | (cyclin-dependent kinase inhibitor) ex. p16, p21 .etc |
| ・p53 gene | |
| ・SASP | (Senescence-Associated Secretory Phenotyp) ex. IL6, IL8 .etc |
| ・DDR | (DNA damage response) ex. γ-H2AX, ATM, .etc |
異なる老化マーカーとの共染色
ご要望が多かった本キットを用いた多重染色例をご紹介。上記実験では、老化細胞のモデルとして継代培養を繰り返したWI-38細胞(Passage 10)を用い、本キットによるSA-β-galの検出 a)、異なる老化マーカーとしてγ-H2AX(DNA損傷マーカー)の免疫染色 b)、更には全細胞の核染色(DAPI)c)を行った。SA-β-galとγ-H2AXの両老化マーカーで相関する結果が得られた d)。
※ 細胞を固定後にSA-β-gal評価および免疫染色する際は、よくある問合せ「細胞を固定化後にSA-β-gal検出および免疫染色はできますか」の項をご覧ください。
また、固定化細胞を用いた論文実績もあります。詳細は参考文献 3)をご参照ください。
| (1) | 継代培養を1回および10回行ったWI-38細胞を用い、本キット中の取扱説明書に記載の”生細胞を用いたアッセイ”に従いSA-β-galを染色した。 |
| (2) | 4% PFA/PBSを細胞へ添加し、室温で15分間インキュベートした。 |
| (3) | PBSで細胞を3回洗浄した。 |
| (4) | 0.1% Triton X-100/PBSを細胞へ添加し、室温で30分間インキュベートした。 |
| (5) | PBSで細胞を3回洗浄した。 |
| (6) | 1% BSA/PBSを細胞へ添加し、室温で1時間インキュベートした。 |
| (7) | 抗γ-H2AX抗体(ウサギ由来)を1% BSA/PBSにて希釈し細胞へ添加後、4℃で一晩インキュベートした。 |
| (8) | PBSで細胞を3回洗浄した。 |
| (9) | 抗ウサギ二次抗体(Alexa Fluor 647)を1% BSA/PBSにて希釈し細胞へ添加後、室温で2時間インキュベートした。 |
| (10) | PBSで細胞を3回洗浄した。 |
| (11) | PBSにて2 μg/ml に希釈したDAPI溶液[DAPI solution:コード D523]を細胞へ添加後、室温で10分インキュベートした。 |
| (12) | PBSで細胞を3回洗浄後、共焦点顕微鏡により観察した。 |
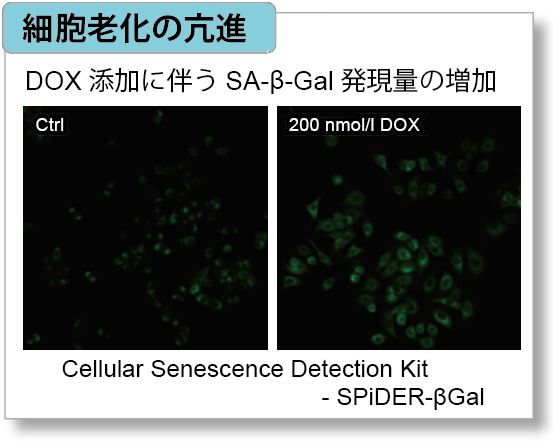
実験例:老化誘導によるA549細胞の代謝シフト
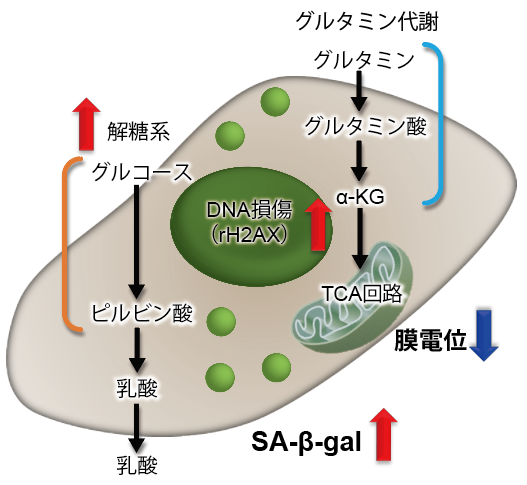
細胞老化が誘導されると、SA-β-galの発現亢進や不可逆的な細胞増殖停止といった現象が見られる他、DNAダメージが蓄積した老化細胞では、ミトコンドリア機能の低下によりエネルギー産生を解糖系にシフトします。そこで、A549細胞をDoxorubicinで処理し老化誘導した際のSA-β-gal発現亢進およびエネルギー産生経路(NAD量、ミトコンドリア膜電位、ATP量、Lactate放出量)のシフトを確認しました。
その結果、DNA損傷が認められましたが、SA-β-gal(Senescence Assosiated -β- Galactosidase)産生量が増加し、細胞内 NAD+ 量が低下したことからミトコンドリア膜電位が低下し、エネルギー生産経路が酸化的リン酸化から解糖系へシフトしたことが確認されました。
<使用製品>
DNAの損傷:DNA Damage Detection Kit - γH2AX (製品コード:G265)
SA-β-gal発現量:Cellular Senescence Detection Kit - SPiDER-βGal (製品コード:SG03)
NAD+量:NAD/NADH Assay Kit-WST (製品コード:N509)
ミトコンドリア膜電位:JC-1 MitoMP Detection Kit (製品コード:MT09)
代謝シフト(ATP量, Lactate放出量):Glycolysis/OXPHOS Assay Kit (製品コード:G270)
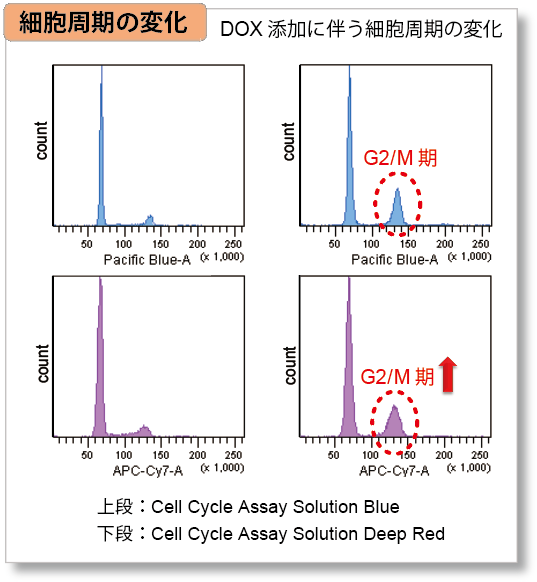
細胞老化と細胞周期との関連性
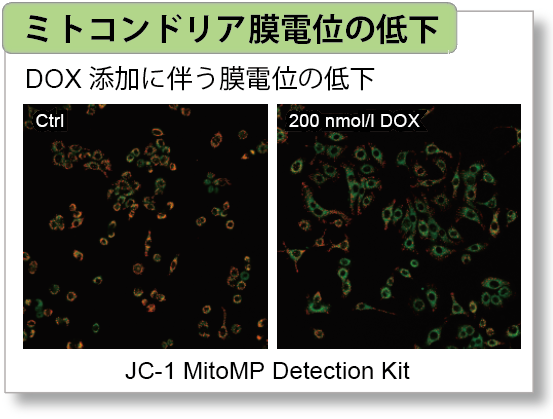
細胞周期のG2/M 期に作用して細胞増殖を停止させ、細胞老化を誘導することが知られているDoxorubicin(DOX) をA549 細胞へ添加後、本製品で細胞老化、Cell Cycle Assay Solution Blue (製品コード:C549)/ Deep Red(製品コード:C548)でA549 細胞における細胞周期の変化と、JC-1 MitoMP Detection Kit (製品コード:MT09)でミトコンドリア膜電位の変化を確認しました。
技術や使用製品に関する補足
-

細胞周期測定試薬
Cell Cycle Assay Solution Blue
-
ミトコンドリア膜電位検出キット
JC-1 MitoMP Detection Kit
細胞老化の誘導条件および測定装置
| 細胞(組織)種・老化誘導条件 | 測定装置 | 製品コード | 論文 |
|---|---|---|---|
|
MRC細胞(ヒト正常 二倍体線維芽細胞) |
蛍光顕微鏡 |
SG03 |
A. Park, I. Tsunoda and O. Yoshie, "Heat shock protein 27 promotes cell cycle progression by down-regulating E2F transcription factor 4 and retinoblastoma family protein p130", J. Biol. Chem.., 2018, doi: 10.1074/jbc.RA118.003310 . |
|
A549細胞(ヒト肺癌上皮細胞 ) |
蛍光顕微鏡・FCM |
SG03 |
R. Tanino, Y. Tsubata, N. Harashima, M. Harada and T. Isobe, "Novel drug-resistance mechanisms of pemetrexed-treated non-small cell lung cancer", Oncotarget., 2018, 9, (24), 16807. |
|
NHDF細胞(ヒト線維芽細胞) |
蛍光顕微鏡 |
SG03 |
Y. Kitahiro, A. Koike, A. Sonoki, M. Muto, K. Ozaki and M. Shibano. , "Anti-inflammatory activities of Ophiopogonis Radix on hydrogen peroxide-induced cellular senescence of normal human dermal fibroblasts.", J Nat Med ., 2018, 72, 905. |
|
高脂肪試料およびマウス脂肪組織 |
蛍光顕微鏡 |
SG02 |
T. Sugizaki, S. Zhu, G. Guo, A. Matsumoto, J. Zhao, M. Endo, H. Horiguchi, J. Morinaga, Z. Tian, T. Kadomatsu, K. Miyata, H. Itoh & Y. Oike, "Treatment of diabetic mice with the SGLT2 inhibitor TA-1887 antagonizes diabetic cachexia and decreases mortality", Nature Partner Journal:Aging and Mechanisms of Disease., doi:10.1038/s41514-017-0012-0. |
|
6週および78週マウス |
蛍光顕微鏡 |
SG03 |
R. Uchida, Y. Saito, K. Nogami, Y. Kajiyama, Y. Suzuki, Y. Kawase, T. Nakaoka, T. Muramatsu, M. Kimura and H. Saito , "Epigenetic silencing of Lgr5 induces senescence of intestinal epithelial organoids during the process of aging", NPJ Aging Mech Dis., 2018,doi:10.1038/s41514-018-0031-5. |
参考文献
| 文献No. | 対象サンプル | 装置 | 引用(リンク) |
|---|---|---|---|
| 1) |
細胞(HEK) |
蛍光顕微鏡 フローサイトメーター |
T. Doura, M. Kamiya, F. Obata, Y. Yamaguchi, T. Y. Hiyama, T. Matsuda, A. Fukamizu, M. Noda, M. Miura, Y. Urano, "Detection of LacZ-Positive Cells in Living Tissue with Single-Cell Resolution.", Angew Chem Int Ed Engl., 2016, 55, 33 |
| 2) | 組織(マウス脂肪) | 蛍光顕微鏡 | T. Sugizaki, S. Zhu, G. Guo, A. Matsumoto, J. Zhao, M. Endo, H. Horiguchi, J. Morinaga, Z. Tian, T. Kadomatsu, K. Miyata, H. Itoh & Y. Oike, "Treatment of diabetic mice with the SGLT2 inhibitor TA-1887 antagonizes diabetic cachexia and decreases mortality", Nature Partner Journal:Aging and Mechanisms of Disease., 2017, doi:10.1038/s41514-017-0012-0. |
| 3) |
細胞 |
蛍光顕微鏡 | A. Park, I. Tsunoda and O. Yoshie, "Heat shock protein 27 promotes cell cycle progression by down-regulating E2F transcription factor 4 and retinoblastoma family protein p130", J. Biol. Chem., 2018, doi: 10.1074/jbc.RA118.003310 . |
| 4) | 細胞(A549) | 蛍光顕微鏡 フローサイトメーター |
R. Tanino, Y. Tsubata, N. Harashima, M. Harada and T. Isobe, "Novel drug-resistance mechanisms of pemetrexed-treated non-small cell lung cancer", Oncotarget., 2018, 9, (24), 16807. |
| 5) | 細胞(NHDF) | 蛍光顕微鏡 | Y. Kitahiro, A. Koike, A. Sonoki, M. Muto, K. Ozaki and M. Shibano. , "Anti-inflammatory activities of Ophiopogonis Radix on hydrogen peroxide-induced cellular senescence of normal human dermal fibroblasts.", J Nat Med., 2018, 72, 905. |
| 6) |
組織 |
蛍光顕微鏡 | R. Uchida, Y. Saito, K. Nogami, Y. Kajiyama, Y. Suzuki, Y. Kawase, T. Nakaoka, T. Muramatsu, M. Kimura and H. Saito, "Epigenetic silencing of Lgr5 induces senescence of intestinal epithelial organoids during the process of aging", NPJ Aging Mech Dis., 2018, doi:10.1038/s41514-018-0031-5. |
| 7) |
組織(腎臓凍結切片) |
蛍光顕微鏡 | S. R. Kim, A. Eirin, X. Zhang, A. Lerman and L. O. Lerman, "Mitochondrial Protection Partly Mitigates Kidney Cellular Senescence in Swine Atherosclerotic Renal Artery Stenosis.", Cell. Physiol. Biochem., 2019, 52, 617. |
| 8) |
細胞(HN6, HN12, HN13) |
フローサイトメーター | Liana P. Webber, Veronica Q. Yujra, Pablo A. Vargas, Manoela D. Martins. Cristiane H. Squarize, Rogerio M. Castilho, "Interference with the bromodomain epigenome readers drives p21 expression and tumor senescence", Cancer Letters., 2019, doi.org/10.1016/j.canlet.2019.06.019. |
| 9) |
細胞(UE7T-13) |
フローサイトメーター | H. Ise, K. Matsunaga, M. Shinohara and Y. Sakai, Improved Isolation of Mesenchymal Stem Cells Based on Interactions between N-Acetylglucosamine-Bearing Polymers and Cell-Surface Vimentin ", Stem Cells Int., 2019, 4341286, 13. |
| 10) |
細胞(マウス角膜間質) |
フローサイトメーター | X. Wang, M. Qu, J. Li, P. Danielson, L. Yang and Q. Zhou, Induction of Fibroblast Senescence During Mouse Corneal Wound Healing.", Invest. Ophthalmol. Vis. Sci., 2019, 60, (10), 3669. |
| 11) |
細胞(VZ/SVZ) |
フローサイトメーター | Y. Nakatani, H. Kiyonari and T. Kondo, Ecrg4 deficiency extends the replicative capacity of neural stem cells in a Foxg1-dependent manner.", Development., 2019, 146, (4), 18. |
| 12) |
細胞(HaCaT, HEK001) |
蛍光顕微鏡 | Y. S. Ryu, K. A. Kang, M. J. Piao, M. J. Ahn, J. M. Yi, G. Bossis, Y. M. Hyun, C. O. Park and J. W. Hyun, Particulate matter-induced senescence of skin keratinocytes involves oxidative stress-dependent epigenetic modifications", Exp. Mol. Med., 2019, 51, 108. |
| 13) |
細胞(HT1080) |
蛍光顕微鏡 | E. M. Angela Ibler, E. Mohamed, L. N. Kathryn, A. B. Natalia, F. E. K. Sherif and H. Daniel, Typhoid toxin exhausts the RPA response to DNA replication stress driving senescence and Salmonella infection', Nat Commun., 2019, 10, 4040. |
| 14) | - (Review) | フローサイトメーター | B.L. Torres, A. Estepa-Fernandez, M. Rovira, M. Oraez, M. Serrano, R. Martinez-Manez and F. Sancenon,"The chemistry of senescence.", The chemistry of senescence., 2019, (3), 426-411 |
| 15) |
細胞(HepG2) |
蛍光顕微鏡 | 三谷塁一, "肝臓のミトコンドリア活性化に及ぼす大豆イソフラボンの効果と その分子機構に関する研究", 大豆たん白質研究, 2019, 21 |
| 16) |
細胞(PC12) |
蛍光顕微鏡 | N. Wang, H. Wang, L. Li, Y. Li and R. Zhang, "β-Asarone Inhibits Amyloid-β by Promoting Autophagy in a Cell Model of Alzheimer's Disease.", Front Pharmacol., 2020, 10, 1529 |
| 17) |
細胞(A2780) |
フローサイトメーター | Z. Wang, J. Gao, Y. Ohno, H. Liu and C. Xu, "Rosiglitazone ameliorates senescence and promotes apoptosis in ovarian cancer induced by olaparib.", Cancer Chemother Pharmacol., 2020. |
| 18) |
組織 |
蛍光顕微鏡 フローサイトメーター |
J. H. Cho, E. Kim, Y. Son, D. Lee, Y. S. Park, J. H. Choi, K. Cho, K. Kwon and J. Kim, "CD9 Induces Cellular Senescence and Aggravates Atherosclerotic Plaque Formation.", Cell Death Differ., 2020, doi: 10.1038/s41418-020-0537-9 |
| 19) |
細胞(T cell) |
フローサイトメーター | S. Yoshida, H. Nakagami, H. Hayashi, Y. Ikeda, J. Sun, A. Tenma, H. Tomioka, T. Kaawano, M. Shimamura, R. Morishita and H. Rakugi, "The CD153 vaccine is a senotherapeutic option for preventing the accumulation of senescent T cells in mice.", Nat. Commun., 2020, 11, (2482), doi:10.1038/s41467-020-16347-w |
| 20) |
細胞(PC12) |
蛍光顕微鏡 | N. Wang, H. Wang, L. Li, Y. Li and R. Zhang, "β-Asarone Inhibits Amyloid-β by Promoting Autophagy in a Cell Model of Alzheimer's Disease.", Front Pharmacol., 2020, 10, 1529 |
| 21) |
細胞(ARPE-19) |
蛍光顕微鏡 | T. Yamazaki, H. Suzuki, S. Yamada, K. Ohshio, M. Sugamata, T. Yamada and Y. Morita, "Lactobacillus paracasei KW3110 Suppresses Inflammatory Stress-Induced Premature Cellular Senescence of Human Retinal Pigment Epithelium Cells and Reduces Ocular Disorders in Healthy Humans”, Int J Mol Sci, 2020, 21(14), 5091 |
| 22) | 細胞 (ゼブラフィッシュの上皮細胞) | 蛍光顕微鏡 | Y. Haraoka, Y. Akieda, Y. Nagai, C. Mogi and T. Ishitani, "Zebrafish imaging reveals TP53 mutation switching oncogene-induced senescence from suppressor to driver in primary tumorigenesis", Nat. Commun., 2022, doi:10.1038/s41467-022-29061-6. |
| 23) | 組織 (脂肪組織) | 蛍光顕微鏡 | A. Kita, Y. Saito, N. Miura, M. Miyajima, S. Yamamoto, T. Sato, T. Yotsuyanagi, M. Fujimiya and T. Chikenji, "Altered regulation of mesenchymal cell senescence in adipose tissue promotes pathological changes associated with diabetic wound healing", Commun. Biol., 2022, doi:10.1038/s42003-022-03266-3. |
| 24) | 細胞(hMPC) | 蛍光顕微鏡 | X. Liu, Z. Liu, Z. Wu, J. Ren, Y. Fan, L. Sun, G. Cao, Y. Niu, B. Zhang, Q. Ji, X Jiang, C. Wang, Q. Wang, Z. Ji, L. Li, C. R. Esteban, K. Yan, W. Li, Y. Cai, S. Wang, A. Zheng, Y. E. Zhang, S. Tan, Y. Cai, M. Song, F. Lu, F. Tang, W. Ji, Q. Zhou, J. Belmonte, W. Zhang, J. Qu, G. Liu, "Resurrection of endogenous retroviruses during aging reinforces senescence", Cell, 2023, doi:10.1016/j.cell.2022.12.017. |
よくある質問
-
Q
1キット当りの使用回数の目安は?
-
A
目安となる使用回数については、下記の容器毎の数量をご参考ください。
※1ウェル当りに添加する染色溶液の量によって上記の数量は変わります。
使用する容器と必要な1ウェル当りの染色溶液量を予め確認の上、ご使用ください。
-
Q
Bafilomycin A1 を添加する理由を教えて下さい。
-
A
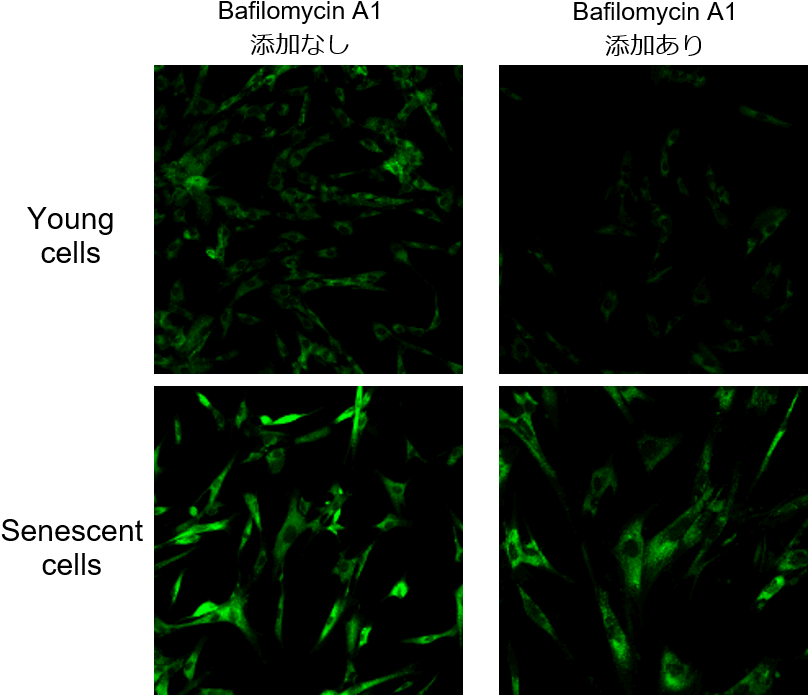
多くの細胞には内在性のβ-ガラクトシダーゼの存在が知られていますが、SPiDER-βGalは、内在性のβ-ガラクトシダーゼと老化マーカーであるSA-β-Galともに反応するため、老化が認められていない細胞でも、バックグラウンドが高くなり、SA-β-Galの検出に支障が出てきます。
Bafilomycin A1は、リソソーム中のATPase活性を阻害し、リソソーム中のpHを酸性から中性付近に変化させますが、この作用により内在性β-ガラクトシダーゼの活性が低下します。そのため、SPiDER-βGalを添加する前にBafilomycin A1で細胞を処理することで、SPiDER-βGalはSA-β-Galと反応して老化細胞を蛍光染色することができます。左図ではBafilomycin A1の添加有無によるSA-β-Gal検出の違いを示しています。
なお、Bafilomycin A1は、オートファジー阻害剤としての利用も知られています。ご利用の際は、実験系に支障があるかご検討の上、支障が有る場合は、固定化細胞の利用をお勧めします。固定化細胞を用いる場合は、バッファーで細胞内pHをコントロールするため、Bafilomycin A1 は使用しません。取扱説明書に記載された手順に従って染色することができます。
-
Q
DMSO stock solutionは、どのくらい安定ですか?
-
A
SPiDER-βGal DMSO stock solution及びBafilomycin A1 DMSO stock solution調製後は、-20℃保存した場合に1か月間安定であることを確認しています。
-
Q
Working solutionは、どのくらい安定ですか?
-
A
SPiDER-βGal working solution及びBafilomycin A1 working solutionは保存できないため、用時調製して下さい。
-
Q
老化細胞を蛍光観察する際の注意点はありますか?
-
A
細胞老化が進むと細胞内にリポフスチンと呼ばれる不溶性物質が蓄積してきます。リポフスチンは自家蛍光を発するため蛍光観察時にバックグラウンドとして影響することがあります。その場合、老化細胞中のSA-β-gal活性を正確に評価するために、SPiDER-βGalを添加しない試料もご用意いただき確認することをお勧めします。
○フローサイトメーターの場合
・「老化細胞」および「老化していない細胞」を用いて、各々①②の平均蛍光強度(MFI)を測定してください。
①SPiDER-βGalを添加した細胞
②SPiDER-βGalを添加していない細胞(バックグラウンド)・「①の平均蛍光強度」から「②の平均蛍光強度」を差し引いてください。
バックグラウンドを差し引いたSA-β-gal由来の蛍光強度をSA-β-gal活性の指標とします。
a:SA-β-gal活性(老化細胞) = ①の平均蛍光強度 - ②の平均蛍光強度
b:SA-β-gal活性(老化していない細胞) = ①の平均蛍光強度 - ②の平均蛍光強度・上記の aおよびb の値を比較することで、SA-β-gal活性として評価してください。
また、上記のaからbを差し引くことで細胞老化に伴うSA-β-gal活性の変化を確認できます。○蛍光顕微鏡の場合
・初めにSPiDER-βGalを添加していない老化細胞を用いて蛍光観察してください。
・リポフスチン由来の蛍光像(バックグラウンド)が影響を与えない程度に感度(gainなど)を調整してください。
・その後、同じ撮影条件でSPiDER-βGalを添加した細胞や老化していない細胞の蛍光観察を行い評価してください。
-
Q
細胞を固定化した後に、SA-β-galは染色できますか?
-
A
可能です。固定化した場合、Bafilomycin A1を用いた細胞の前処理は必要ありませんが、pH6.0に調整したMcIlvain bufferを別途準備して頂く必要があります。詳細は取扱説明書をご覧ください。
-
Q
固定化細胞をフローサイトメーターを用いて検出するプロトコルを教えて下さい。
-
A
下記のプロトコルを参照ください。
(1) 細胞を35 mmディッシュに播種し、37℃、5% CO2インキュベーターで一晩培養する。
(2) 培地を吸引除去し、HBSS 2 mlで1回洗浄する。
(3) トリプシンで細胞を剥がし、培地500 μlで回収する。
(4) 300×gで5分間遠心し、上澄みを除去する。
(5) 2% PFA/PBS 100 μlに懸濁し、室温で5分間固定する。
(6) 300×gで5分間遠心し、上澄みを除去する。
(7) HBSS 500 μLに懸濁し、300×gで5分間遠心後、上澄みを除去する。これを2回繰り返す。
(8) SPiDER-βGal working solution(固定化細胞用) 500 μlを加え、37℃で30分間インキュベートする。
※pHの変動を抑えるため、5% CO2インキュベーターは使用しない。
(9) 300×gで5分間遠心し、上澄みを除去する。
(10) HBSS 500 μlに懸濁し、300×gで5分間遠心後、上澄みを除去する。これを2回繰り返す。
(11) HBSS 500 μlを加えて細胞を回収し、フローサイトメーターにて解析する。
-
Q
細胞を固定化後にSA-β-gal検出および免疫染色はできますか?
-
A
はい、染色は可能ですが、細胞を固定化するとSA-β-galが低下する可能性があります。 (下記の※2に注意事項を記載)
以下の実験例を参照しご検討ください。WI-38細胞を固定化後に、SA-β-gal検出およびγ-H2AX(DNA損傷マーカー)の免疫染色を行った。
<実験操作>
(1) WI-38細胞を35 mm dishに播種し、37℃、5% CO2インキュベーターで一晩培養した。 (2) 培養上清を除き、4% Paraformaldehyde/PBS溶液2 mlを細胞に添加し、室温で3分間インキュベートした※1。 (3) PBS 2 mlで細胞を3回洗浄した。 (4) SPiDER-βGal working solution ※2 2 mlを添加し、37℃で30分間インキュベートした※3。 (5) PBS 2 mlで細胞を2回洗浄した。 (6) 0.1% Triton X-100/PBS 2 mlを細胞へ添加し、室温で30分間インキュベートした。 (7) PBS 2 mlで2回洗浄した。 (8) 1% BSA/PBS溶液2 mlを細胞へ添加し、室温で1時間インキュベートした。 (9) 抗γ-H2AX IgG (マウス由来)を1% BSA/PBS溶液にて希釈後、細胞に添加し4℃で一晩インキュベートした。 (10) PBS 2 mlで細胞を3回洗浄した。 (11) 抗マウスIgG(Cy5標識)を1% BSA/PBSで希釈後、細胞に添加し室温で1時間インキュベートした。 (12) 上清を除き、PBS 2 mlで細胞を2回洗浄し蛍光顕微鏡下で観察した。 ※1 固定化時間を長くすると、SA-β-gal活性が低下します。 ※2 細胞の固定化操作によりSA-β-gal活性が低下する可能性があります。 もしSA-β-gal評価時に十分な蛍光強度が得られない場合は、SPiDER-βGal DMSO stock solution を500-1000倍に希釈しご使用ください。通常はSPiDER-βGal DMSO stock solutionをMcIlvaine buffer(pH 6.0)にて2,000倍の希釈を推奨。
希釈倍率の異なるSPiDER-βGal working solutionの結果をFig.1に示す。※3 インキュベートの際は、5% CO2インキュベーターでは行わないこと。5% CO2インキュベーター内に固定化した細胞をおくと、バッファーが酸性になることで内在性のβ-galactosidase活性が上昇することが考えられる。結果として、バックグラウンドが上昇し、老化細胞と若い細胞のSA-β-gal活性の差が見えにくくなる。 <実験データ>
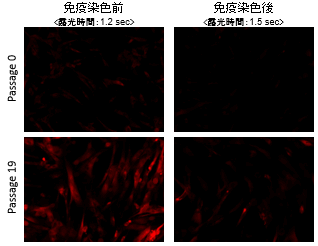
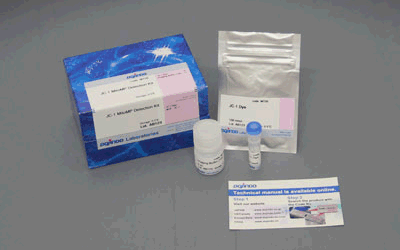
図1 免染前後におけるSPiDER-βGal染色の蛍光強度変化免疫染色の前後でSPiDER-βGalの蛍光強度を比較すると、固定化を行う免疫染色の過程でSPiDER-βGalの蛍光強度が低下していることを確認した。
図2 希釈倍率の異なるSPiDER-βGalによる染色例(免疫染色後)
赤: SPiDER-βGal、青: γ-H2AX <露光時間: 1.5 sec>SPiDER-βGal working solutionの希釈倍率を2000倍から666倍に変更することで、免疫染色(固定化)により低下したSPiDER-βGalの蛍光強度が免疫染色前と同程度の強度を示すことを確認した。
-
Q
染色後の蛍光が弱くて確認できないのですが、対策を教えてください。
-
A
下記の3点についてご確認またはご検討ください。
①ご使用のフィルターが試薬の蛍光特性に合致している。
<推奨フィルター>
・蛍光顕微鏡: 励起(500-540 nm), 蛍光(530-570 nm)
・フローサイトメーター: 励起(488 nm), 蛍光(500-540 nm)
②各working solutionは用時調製したものを使用する。③染色時間を長くする。
SPiDER-βGal working solution添加後、30分間のインキュベーションで蛍光が確認できない場合は、インキュベーション時間を45-60分間を目安にご検討ください。
-
Q
SA-β-Gal発現細胞を染色後、細胞は固定化できますか?
-
A
可能です。4%パラホルムアルデヒドを用いて固定化することを推奨します。
-
Q
培地中の血清やフェノールレッドは検出に影響しますか?
-
A
培地中の血清およびフェノールレッドは、SA-β-galの検出には影響しません。
-
Q
老化細胞とコントロール細胞で蛍光強度に差がない場合、何を確認したら良いですか?
-
A
STEP1:顕微鏡の観察条件を最適化してください。
STEP2:観察条件を最適化しても解決しない場合、染色条件の最適化を行ってください。---------------------------------------------------------------------------
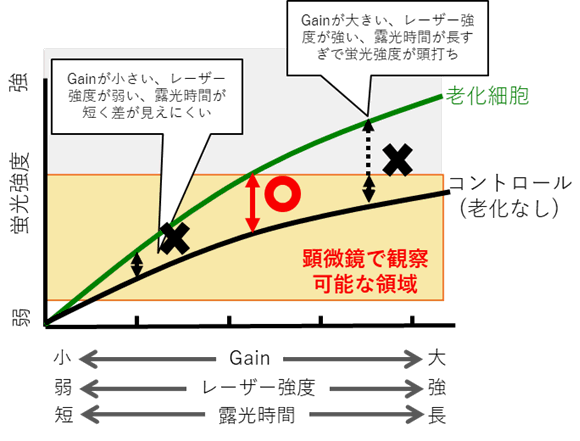
STEP1<顕微鏡の観察条件を最適化>コントロール細胞の蛍光と老化細胞の蛍光に差が見られない場合下記をご確認ください。
・コントロール細胞を観察し蛍光が僅かに確認できる条件までGain、レーザー強度を下げる、または露光時間を短くする。
(共焦点顕微鏡:Gain、レーザー強度の調整 落射型顕微鏡:露光時間の調整)・老化細胞の蛍光を観察し、コントロール細胞との蛍光の差を確認する。
・蛍光の差がみられない場合はSTEP2を確認する。
※観察する部分がガラスボトムシャーレの容器をお使いください。
顕微鏡観察条件とコントロールおよび老化細胞の蛍光強度の関係---------------------------------------------------------------------------
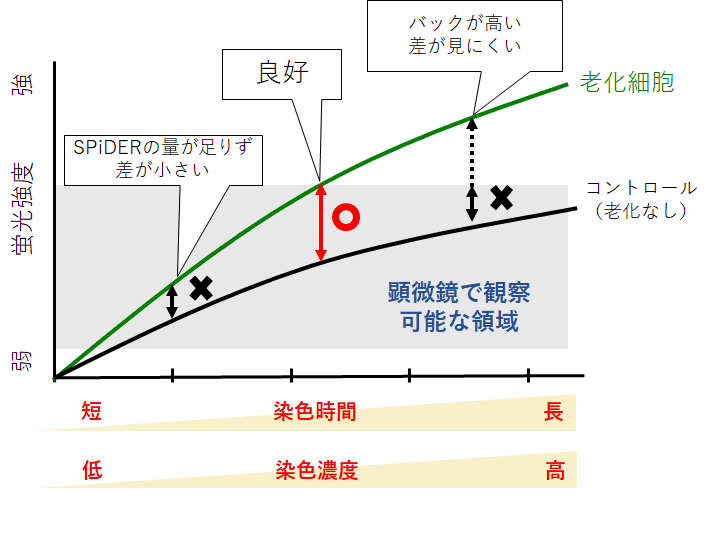
STEP2<染色条件の最適化>細胞によっては、SPiDERの染色時間もしくは濃度の検討が必要な場合がございます。
以下を目安に最適条件をご検討ください。
染色時間:10分~60分
染色濃度:取扱説明書に記載の濃度の1/2量~2倍量
※観察する細胞数が少ないと感度が得られない場合がございます。
必要に応じて、細胞数の最適化を行ってください。
染色条件とコントロールおよび老化細胞の蛍光強度の関係
取扱条件
| 保存条件: 冷蔵 |