Glycolysis/OXPHOS Assay Kit
解糖系/酸化的リン酸化測定キット
- プレートリーダーを使用するため、高額な装置購入が不要
- 必要試薬は全て入ったAll in Oneのキット形態
- 実験操作の流れが解る詳細なプロトコル
-
製品コードG270 Glycolysis/OXPHOS Assay Kit
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 50 tests | ¥57,800 | 343-09921 |
<使用回数の目安>
使用回数は、行う実験の種類や検討方法によって異なります。
詳細は、よくある質問「1キットあたり測定可能なサンプル数を教えて下さい。」をご確認ください。
| 50 tests | ・Dye Mixture ・Lactate Standard ・LDH Solution ・Lactate Assay Buffer ・Reconstitution Buffer ・Substrate ・Luciferase Solution ・ATP Assay Buffer ・Oligomycin ・2-DG |
×1 150 μl×1 12 μl×1 5.5 ml×1 550 μl×1 ×1 10 μl×1 5.5 ml×1 ×1 140 μl×1 |
|---|
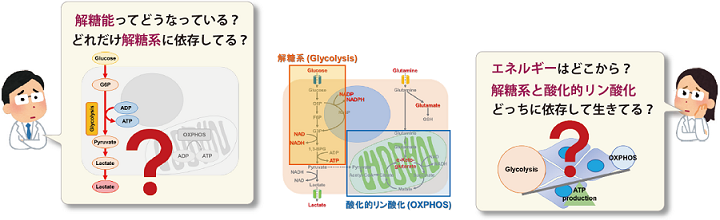
性質
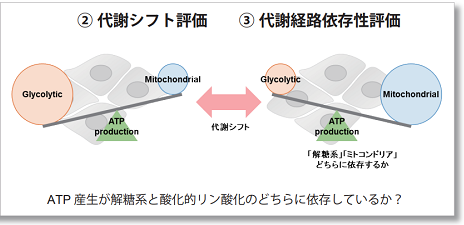
多くのがん細胞は、解糖系に依存したエネルギー代謝によりATPを産生しています。一方で、解糖系が抑制されたがん細胞は、ミトコンドリア機能を亢進させることでエネルギー代謝を酸化的リン酸化にシフトさせ生存していることが、近年報告されています。これらの現象を理解することは、抗がん剤のメカニズム解明に役立つだけではなく、老化、神経変性疾患を含む様々な疾患における治療戦略の開発に繋がるため、注目を集めています。
本キットは、解糖能、代謝シフトおよび、細胞が解糖系と酸化的リン酸化のどちらに依存してエネルギー産生を行っているのかをプレートリーダーを用いて評価するキットです。 本キットには、これらの評価に必要な試薬が全て同梱されています。
マニュアル
技術情報
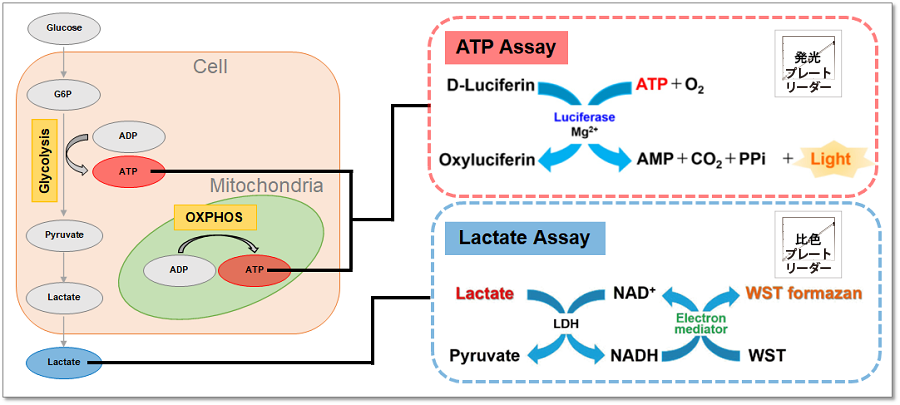
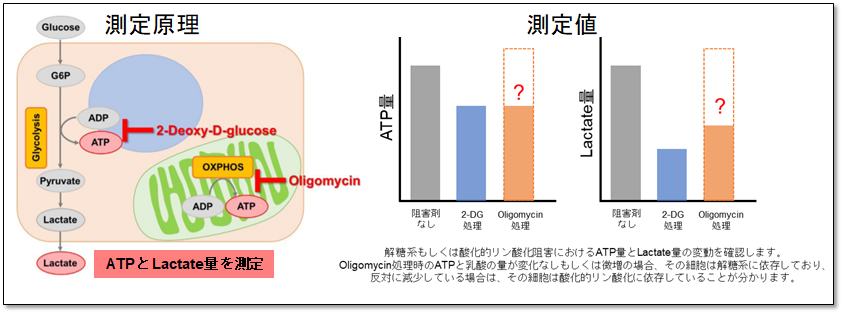
検出原理
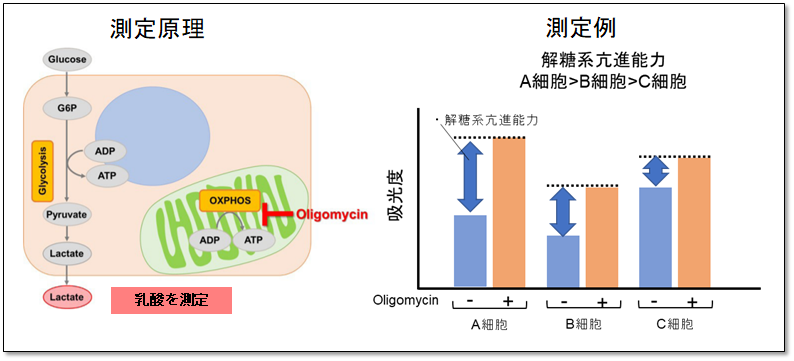
本キットは、細胞内のアデノシン三リン酸(ATP)量をホタル・ルシフェラーゼ発光法で測定し、細胞外へ排出される乳酸量をWSTホルマザンを用いた吸光度測定法にて測定するキットです。解糖系と酸化的リン酸化それぞれに対する阻害剤を使用し得られる結果から、代謝経路を評価することが可能です。また、本キットではマイクロプレートを用いた測定が可能です。
本キットでできる3つの評価
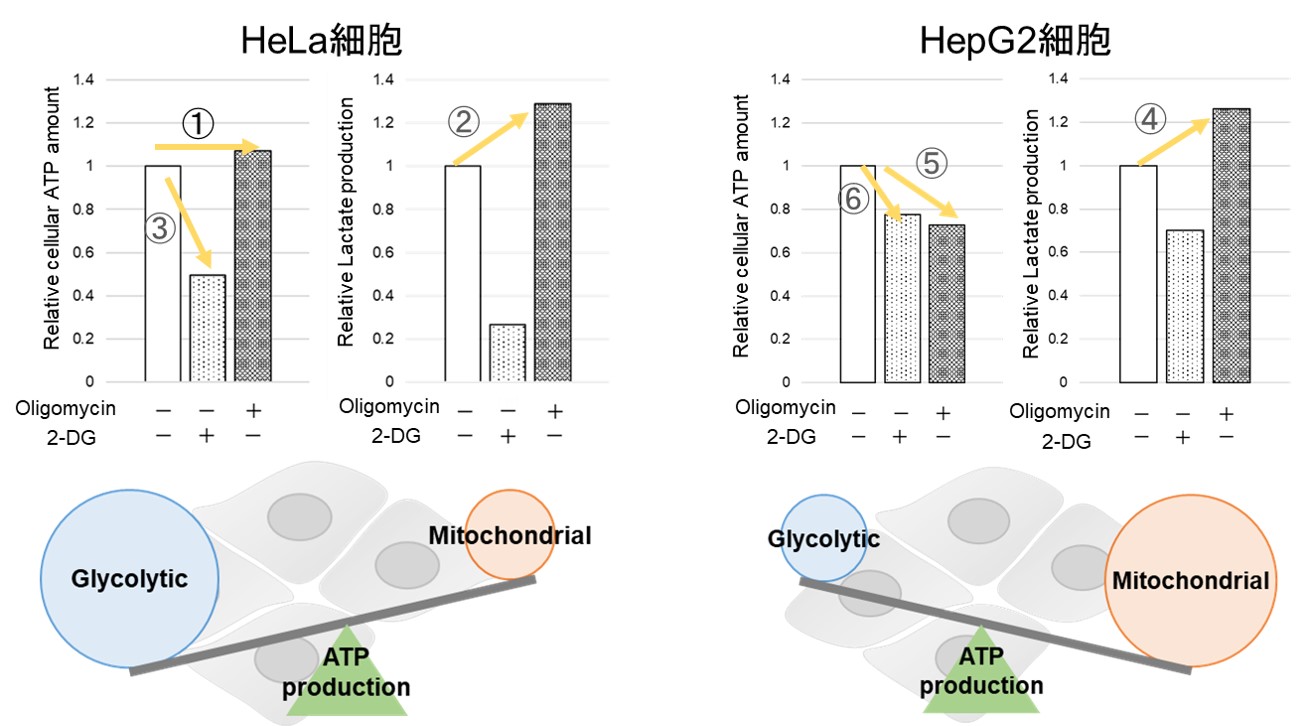
Oligomycin で酸化的リン酸化(OXPHOS)でのATP合成を阻害、あるいは、2-Deoxy-D-glucose(2-DG)で解糖系(Glycolysis)でのATP合成を阻害させた時のATP量(発光値)やLactate量(吸光度)の変化を測定することで、次の①~③の評価を行います。
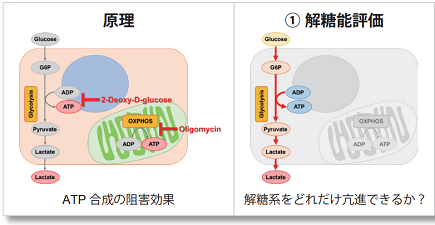
できる事①:解糖能の評価
細胞をOligomycinで処理し酸化的リン酸化でのATP合成を阻害した際に、もう一つのエネルギー生成経路である解糖系をどれだけ亢進させることができるかについて、Lactate生成量を指標に評価できます。
<実験例>
解糖系阻害剤(2-DG濃度:2 mmol/l)で処理したHeLa細胞と未処理のHeLa細胞(コントロール)を用いて、解糖能を比較しました。結果、Oligomycinにより酸化的リン酸化でのATP合成を阻害した場合、コントロール細胞は解糖系を亢進させることが可能でしたが、解糖系を阻害した細胞では確かに解糖系を亢進させることが出来ないことを確認できました。
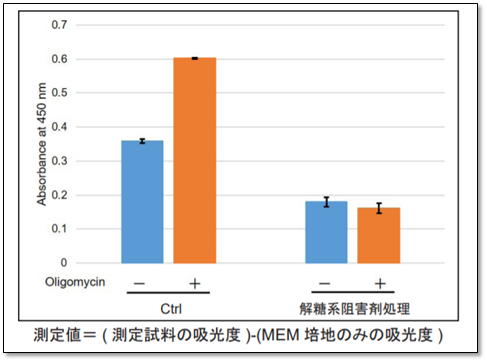
※詳細なプロトコルは、取扱説明書内3ページ「操作①解糖能の評価」の項目を参照ください。
できる事②:代謝シフトの評価
Oligomycin処理を行った細胞から得られるATP量と未処理の総ATP量から、解糖系およびミトコンドリアでのATP生成量を算出し、これらを指標に細胞が代謝シフトしたかを評価できます。
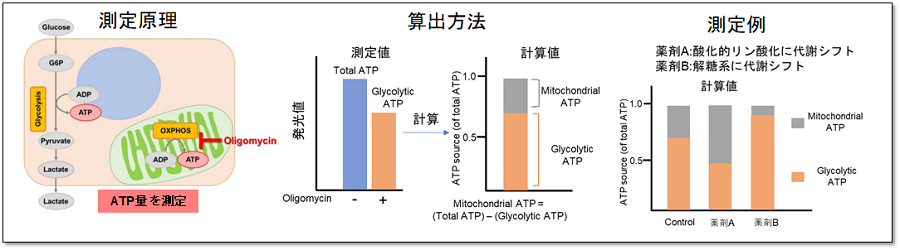
<実験例>
解糖系阻害剤(2-DG濃度:2 mmol/l)処理によりHeLa細胞が代謝シフトを起こすかどうかを評価しました。結果、コントロール細胞群のATP産生能力は大きく解糖系に依存した結果であったことに対して、解糖系が阻害されたHeLa細胞はATP産生を解糖系から酸化的リン酸化にシフトさせ、ミトコンドリアでのATP産生を増加させることが分かりました。
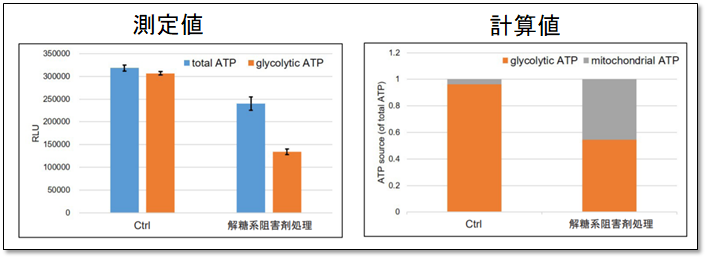
※詳細なプロトコルは、取扱説明書内5ページ「操作②代謝シフトの評価」の項目を参照ください。
できる事③:代謝経路依存性の評価
上記のできる事①②を組み合わせて、細胞の代謝経路依存性を評価することができます。
細胞をOligomycinもしくは2-DGで処理し、酸化的リン酸化もしくは解糖系でのATP合成を阻害した細胞を用いて、それぞれのATP量とLactate生成量を測定します。得られるATP量の変化からエネルギー生産効率を、さらにLactate生成量の変化を見ることで解糖能の変動を確認し、細胞が解糖系と酸化的リン酸化のどちらに依存しているのかを評価できます。

<実験例>
解糖系阻害剤で処理したHeLa細胞の代謝経路依存性を評価しました。
結果、解糖系阻害処理を行っていない細胞群のATP量は2-DG処理により大きく減少し、Oligomycin処理では変化しません。さらに、Lactate生成量はOligomycin処理により増加しました。このことより、解糖系阻害剤処理なしのHeLa細胞の代謝は解糖系に大きく依存していることが判ります。
対して、解糖系阻害処理を行った細胞群は、Oligomycin処理によるLactate生成量の増加がみられず、またATP量がOligomycin処理により大きく減少しました。このことより解糖系を阻害したHeLa細胞の代謝は酸化的リン酸化に依存するようになることが確認できました。
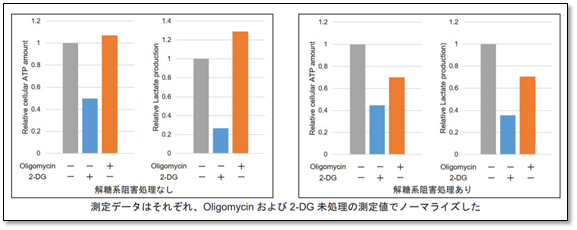
※詳細なプロトコルは、取扱説明書内8ページ「操作③代謝経路依存性の評価」の項目を参照ください。
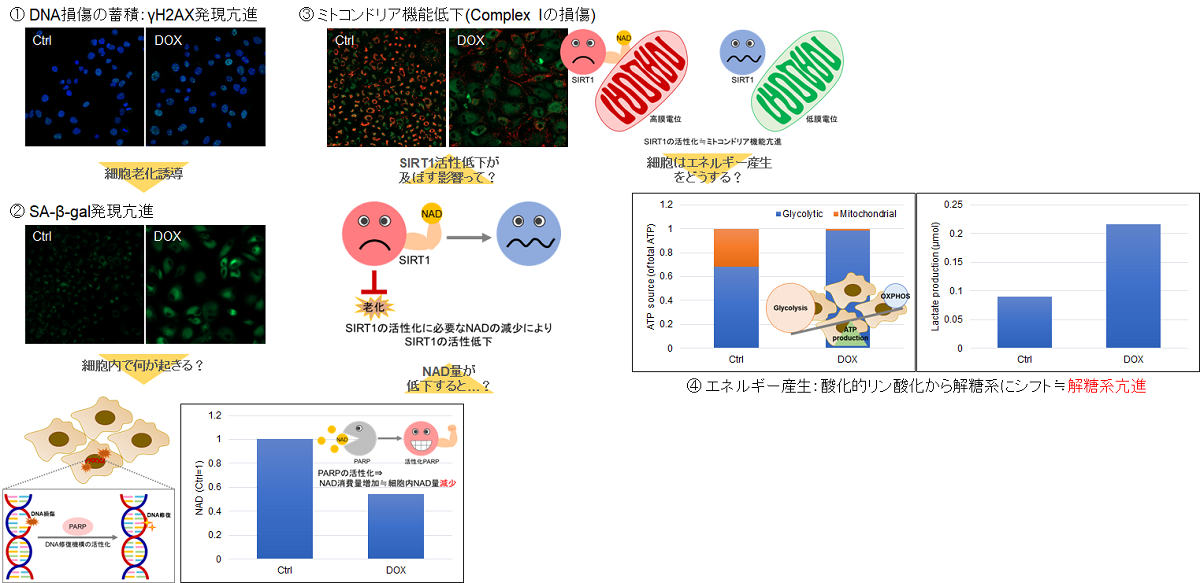
実験例:老化誘導によるA549細胞の代謝シフト
細胞老化が誘導されると、SA-β-galの発現亢進や不可逆的な細胞増殖停止といった現象が見られる他、DNAダメージが蓄積した老化細胞では、ミトコンドリア機能の低下によりエネルギー産生を解糖系にシフトします。そこで、A549細胞をDoxorubicinで処理し老化誘導した際のSA-β-gal発現亢進およびエネルギー産生経路(NAD量、ミトコンドリア膜電位、ATP量、Lactate放出量)のシフトを確認しました。
その結果、DNA損傷が認められましたが、SA-β-gal(Senescence Assosiated -β- Galactosidase)産生量が増加し、細胞内 NAD+ 量が低下したことからミトコンドリア膜電位が低下し、エネルギー生産経路が酸化的リン酸化から解糖系へシフトしたことが確認されました。
<使用製品>
DNAの損傷:DNA Damage Detection Kit - γH2AX (製品コード:G265)
SA-β-gal発現量:Cellular Senescence Detection Kit - SPiDER-βGal (製品コード:SG03)
NAD+量:NAD/NADH Assay Kit-WST (製品コード:N509)
ミトコンドリア膜電位:JC-1 MitoMP Detection Kit (製品コード:MT09)
代謝シフト(ATP量, Lactate放出量):Glycolysis/OXPHOS Assay Kit (製品コード:G270)
実験例:細胞種における代謝経路依存性の比較
多くのがん細胞は解糖系に依存したエネルギー代謝により ATP を産生しています。一方で、解糖系が抑制されたがん細胞はミトコンドリア機能を亢進させることでエネルギー代謝を酸化的リン酸化にシフトさせ生存していることが近年報告されており、細胞種によって代謝経路の依存性が異なります。
2種類のがん細胞(HeLa細胞とHepG2細胞)における酸化的リン酸化と解糖系へのエネルギー産生の依存度合をLactate生成量とATP量およびOCR値より比較しました。
<Lactate生成量とATP量による評価>
Oligomycin刺激により酸化的リン酸化でのATP合成を阻害、また2-Deoxy-D-glucose(2-DG)により解糖系でのATP合成を阻害した際のATP量とLactate生成量の変化を確認したところ、
HeLa細胞は解糖系に依存し、HepG2細胞は酸化的リン酸化に依存してATP合成している結果が得られました。
*結果の補足説明は”技術や使用製品に関する補足”をご参照ください。
使用製品:Glycolysis/OXPHOS Assay Kit (製品コード:G270)
<OCR値による評価>
同じ細胞数にてミトコンドリア脱共役剤であるFCCP刺激により、細胞の酸素消費を促進した際のOCRを測定しました。
結果、HepG2細胞はHeLa細胞よりもOCR値が高く酸化的リン酸化への依存度が大きいことが示唆され、ATP量やLactate量を指標に評価した場合と相関する結果が得られました。
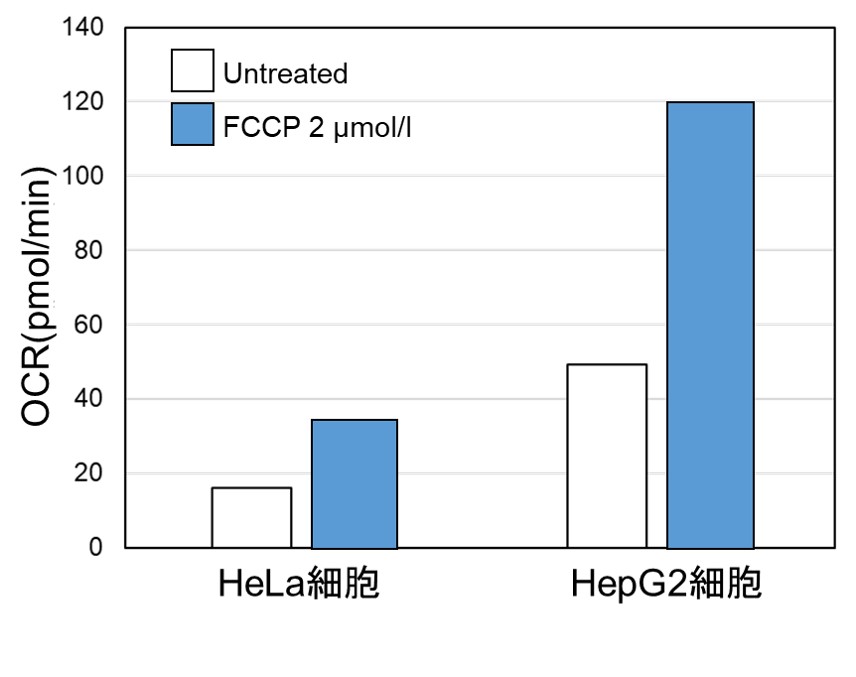
〈実験条件〉
細胞 :HeLa, HepG2
細胞数 :5×104 cells/well
薬剤 :FCCP
薬剤濃度:2 μmol/l
使用製品:Extracellular OCR Plate Assay Kit (製品コード:E297)
技術や使用製品に関する補足
<Lactate生成量とATP量による評価>
HeLa細胞は酸化的リン酸化を阻害した際、ATP量は変わらず(①)、Lactate生成量が増加する(②)ことから、酸化的リン酸化が阻害されても解糖系をさらに活性化することができ、逆に解糖系を阻害するとATP量が大きく減少することから(③)、エネルギー産生を解糖系に依存していることが示唆されました。一方、HepG2細胞は、酸化的リン酸化を阻害した際、Lactate生成量が増加していることから(④)、解糖系の亢進によりエネルギー産生を補おうとしているがATP量は減少している(⑤)、すなわち解糖系を亢進させてもATP産生を補えていないこと、さらに解糖系を阻害した場合よりもATP量が減少する(⑥)ことから、エネルギー産生を解糖系よりも酸化的リン酸化に依存しているということが示唆されました。
参考文献
| No. | 対象サンプル | 他の測定指標 (試薬) | 引用(リンク) |
|---|---|---|---|
| 1 | 細胞 (RAW264.7) |
・酸素消費速度 OCR (XFe96) |
H. Gu, Y. Zhu, J. Yang, R. Jiang, Y. Deng, A. Li, Y. Fang, Q. Wu, H. Tu, H. Chang, J. Wen and X. Jiang, "Liver-Inspired Polyetherketoneketone Scaffolds Simulate Regenerative Signals and Mobilize Anti-Inflammatory Reserves to Reprogram Macrophage Metabolism for Boosted Osteoporotic Osseointegration", Adv sci, 2023, doi:10.1002/advs.202302136. |
| 2 | 細胞 (A549) |
・グルコース取り込み |
L. Z. Liu, B. Wang, R. Zhang, Z. Wu, Y. Huang, X. Zhang, J. Zhou, J. Yi, J. Shen, M. Y. Li and M. Dong, "The activated CD36-Src axis promotes lung adenocarcinoma cell proliferation and actin remodeling-involved metastasis in high-fat environment", Cell Death Dis, 2023, doi:10.1038/s41419-023-06078-3. |
| 3 | 細胞 (イヌ神経膠腫由来細胞株) |
- |
H. Yamazaki, S. Onoyama, S. Gotani, T. Deguchi, M. Tamura, H. Ohta, H. Iwano, H. Nishida, P.J. Dickinson and H. Akiyoshi, 'Influence of the Hypoxia-Activated Prodrug Evofosfamide (TH-302) on Glycolytic Metabolism of Canine Glioma: A Potential Improvement in Cancer Metabolism', Cancers, 2023, doi:10.3390/cancers15235537. |
| 4 | 細胞 (primary Hepatocyte) | S. Tsuno, K. Harada, M. Horikoshi, M. Mita, T. Kitaguchi, M. Y. Hirai, M. Matsumoto and T. Tsubo , 'Mitochondrial ATP concentration decreases immediately after glucose administration to glucose-deprived hepatocytes', FEBS Open Bio, 2023, doi:10.1002/2211-5463.13744. |
よくある質問
-
Q
1キットあたり測定可能なサンプル数を教えて下さい。
-
A
サンプルの測定をそれぞれn=3で行った場合、下記表に記載のサンプル数を測定頂けます。
50 tests Lactate Assay ATP Assay 解糖能評価 代謝シフト評価 代謝経路依存性
評価解糖能評価 代謝シフト評価 代謝経路依存性
評価96 well プレート 48 well分 48 well分 48 well分 48 well分 測定可能なサンプル数
(n=3で行った場合)6 サンプル 4 サンプル 8 サンプル 5 サンプル
※予備実験を行わない場合の最大測定可能サンプル数を記載しています。
※Lactate Assayを行う際、培地に血清を含む場合、バックグラウンドコントロールとして、使用した血清入り培地のみの測定試料を準備することをお勧めします。50 tests Lactate Assay ATP Assay 解糖能評価 代謝シフト評価 代謝経路依存性
評価解糖能評価 代謝シフト評価 代謝経路依存性
評価96 well プレート 9 well分 9 well分 21 well分 9 well分 測定可能なサンプル数
(n=3で行った場合)5 サンプル 4 サンプル 4 サンプル 4 サンプル
※予備実験を行った場合の最大測定可能サンプル数を記載しています。
※Lactate Assayを行う際、培地に血清を含む場合、バックグラウンドコントロールとして、使用した血清入り培地のみの測定試料を準備することをお勧めします。
解糖能評価(Lactate Assay)のプレートレイアウト例(n=3)
(左:予備実験無し、右:予備実験あり)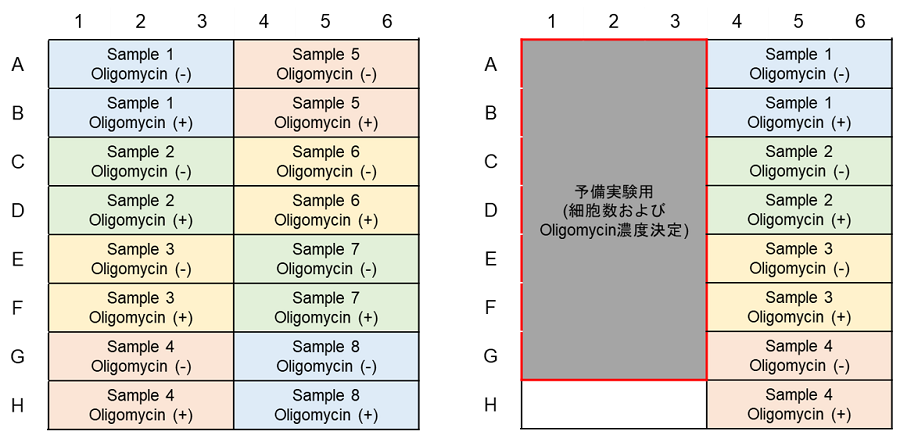
代謝シフト評価(ATP Assay)のプレートレイアウト例(n=3)
(左:予備実験無し、右:予備実験あり)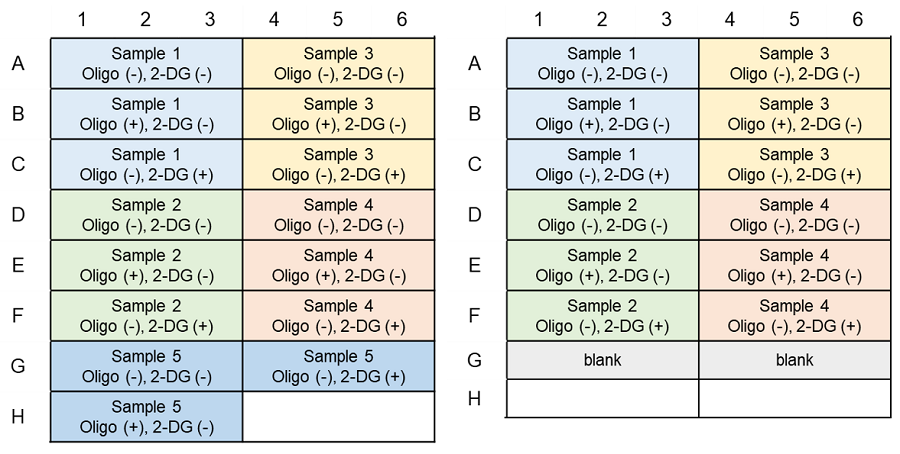
代謝経路依存性評価のプレートレイアウト例(n=3)
(左:ATP Assay、右:Lactate Assay)(予備実験なし)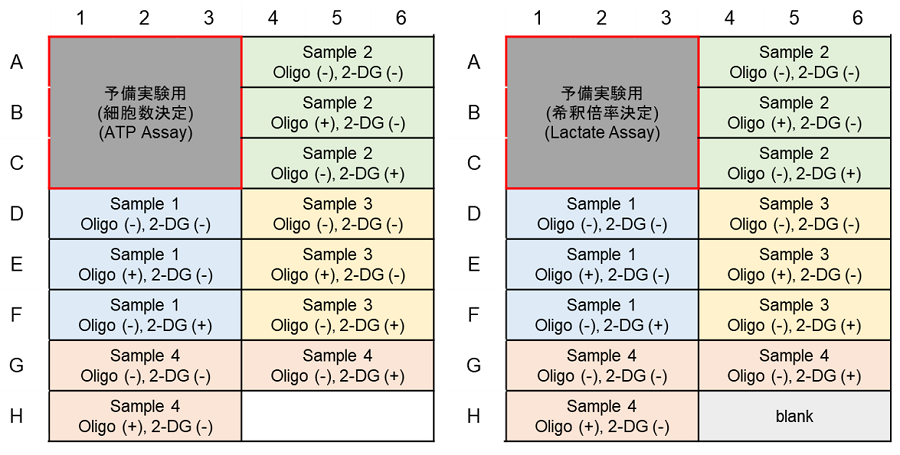
代謝経路依存性評価のプレートレイアウト例(n=3)
(左:ATP Assay、右:Lactate Assay)(予備実験あり)
-
Q
解糖能の評価において、検出されたサンプルの吸光度の値が培地のみ(blank)の吸光度と変わりません。原因と解決策を教えて下さい。
-
A
原因として、細胞から放出される乳酸量が少ないことが考えられます。播種する細胞数を増やし、インキュベート時間をさらに延ばしてください(3時間⇒5時間)。
-
Q
それぞれの評価において、ノーマライズは必要になりますか。また、ノーマライズする場合の方法を教えて下さい。
-
A
Oligomycinおよび2-DG処理5時間では、タンパク量によるノーマライズ前後での結果はほとんど変わらないことを確認しております。ただし、細胞の刺激に使用する薬剤処理等により、細胞数やタンパク量に大きな変化が無いことを予め確認してから本キットでの評価を行って下さい。
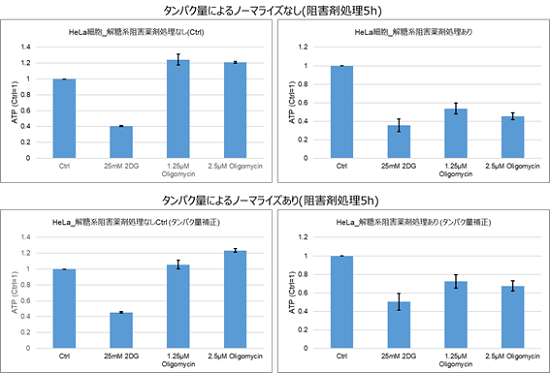
タンパク量でノーマライズする場合は、以下に示す図を参照下さい。
※タンパク量でノーマライズする場合、ATP Assayに使用する試薬の組成上、ATP AssayやLactate Assayに用いた同一細胞サンプルでの評価ができません。そのため、タンパク定量用に別途細胞サンプルをご準備下さい。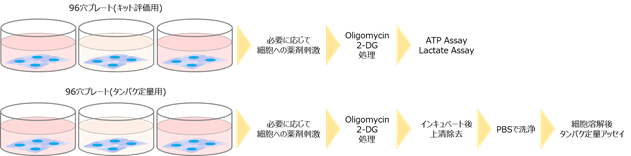
-
Q
Lactate Assayは450 nm以外の吸収フィルターで測定できますか。
-
A
450 nm以外では、490 nmのフィルターでの使用が可能です。ただし、吸光度値は450 nmで測定した場合と比較し低くなります。
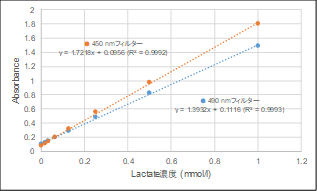
-
Q
還元物質を含むサンプルは測定できますか。
-
A
サンプル中に還元性を持つ物質が含まれていると、色素WSTが誤発色して正確なlactateの変化が測定できません。培地に、還元性を持つ薬剤等を添加して実験を行う場合、バックグラウンドコントロールとして「細胞を含まない培地+薬剤のみ」の試薬ブランクを一緒に測定して下さい。
-
Q
Working solutionはどのくらい安定ですか。
-
A
Working solutionは保存できません。用時調製して下さい。また、光に不安定であるため、調製後は遮光して下さい。遮光下室温で4時間安定です。
-
Q
発光シグナルはどの程度安定ですか。
-
A
発光シグナルは3時間安定です。ただし、温度と光が発光に影響しますので、すぐに測定できない場合は、遮光し温度を一定(25℃付近)に保てる場所で静置して下さい。
-
Q
測定用のプレートは白色以外のプレートを使用できますか。
-
A
測定はできますが、ブラックプレートや透明プレートを用いた場合、発光強度が下がります。また、透明プレートの場合、ブランクが高くなりますので、白色プレートを推奨しております。
使用実績のある白色プレートは以下の通り
メーカー 製品名 ウェル底 Cat No. 住友ベークライト 発光測定プレート96F 白色 白色
MS-8096W Thermo Scientific 96 Well White/Clear Bottom Plate, TC Surface 透明 165306 SPL Life Sciences 96ウェル クリアボトムプレート ホワイト/PS 透明 SPL-33696 (33696) Greiner CELLSTAR, μClear, 96ウェル, マイクロプレート, TC
(透明底, 低蒸発フタ付, ホワイト, 滅菌, PS)透明 655098
-
Q
ATP Assayでの発光測定の波長を教えてください。
-
A
ホタルルシフェリンを使用しているため、発光測定の波長は556nmとなります。
-
Q
より大容量のキットを購入することはできますか?
-
A
Glycolysis/OXPHOS Assay Kitは、Lactate Assay Kit-WST(製品コード:L256)とATP Assay Kit-Luminescence (製品コード:A550)を組み合わせたキットとなっております。そのため、50 testsより多い容量で測定したい場合は各キットの200 testsをご使用下さい。
なお、Glycolysis/OXPHOS Assay Kitに同梱されているコンポーネントと各キットのコンポーネントにおいてコンポーネント名が異なっているものがありますが、組成は同一ですので、安心してご使用下さい。
製品名 Glycolysis/OXPHOS Assay Kit Lactate Assay Kit-WST コンポーネント名 LDH Solution Enzyme Solution Lactate Assay Buffer Assay Buffer 製品名 Glycolysis/OXPHOS Assay Kit ATP Assay Kit-Luminescence コンポーネント名 Luciferase Solution Enzyme Solution ATP Assay Buffer Assay Buffer
取扱条件
| 保存条件: 冷蔵,遮光 |