Cellular Senescence Detection Kit - SPiDER Blue
固定化老化細胞検出キット
- SA-β-galの定量が可能
- 免疫染色との共染色が可能
- 汎用される緑・赤色との多重染色が可能
-
製品コードSG07 Cellular Senescence Detection Kit - SPiDER Blue
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 1 plate | ¥39,000 | 344-10201 |
*使用回数の目安: 1 plateあたり、35 mm dish : 5 枚、μ-Slide 8 well 5 枚、6-well Plate 1 枚, 96-well Plate 1 枚
<SA-βGal検出製品に関して>
本製品SPiDER Blueは固定化細胞専用の老化検出色素で、免疫染色等との多重染色解析に最適な色素です。初めてSA-βGal検出を行う際には、生細胞・固定細胞どちらにも使える汎用的な緑色色素のSPiDER-βGalをおすすめいたします。
SPiDER-βGalシリーズ
蛍光顕微鏡、フローサイトメトリーによる細胞サンプルの解析:Cellular Senescence Detection Kit - SPiDER-βGal
プレートリーダーによる細胞サンプルの解析:Cellular Senescence Plate Assay Kit - SPiDER-βGal
| 1 plate | ・SPiDER Blue ・Assay Buffer |
x 1 x 1 |
|---|
老化研究をより深めるために多重染色で観察する
細胞老化は、近年ガン化因子として知られるSASP の発見や、Stem cell分野での老化現象の発見など、各分野で重要視されはじめています。
細胞老化過程は細胞死や代謝変化、オートファジーなどの事象が相互に関与し、複雑に進行するため関連マーカーとの同時解析:抗体や蛍光低分子を利用した多重染色が有用な解析方法となっています。
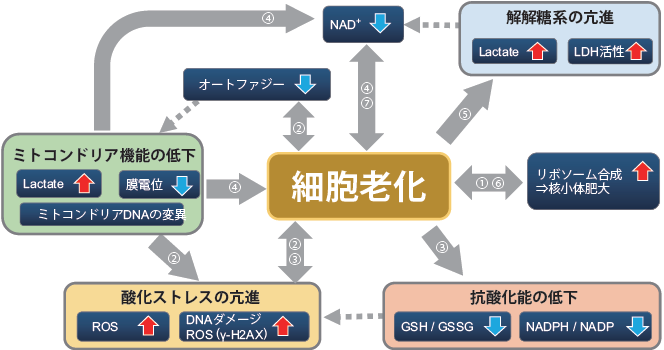
参考文献(図矢印中番号)
1)H. Tanaka, et al., Cell Reports, 2017, 18(9), 2148.
2)L. Garcia-Prat, et al., Oncotarget, 2016, 7(11), 12286.
3)M. Bitar, et al., Am J Physiol Endocrinol Metab., 2013, 305(8), E951.
4)C. Wiley, et al., Cell Metab., 2016, 23(2), 303.
5)E. Liao, et al., Cell Death Dis., 2014, 5, e1255.
6)K. Nishimura, et al., Cell Rep. 2015, 10(8), 1310.
7)M. J. Son, et al., tem Cells. 2016, 34(12), 2840.
性質
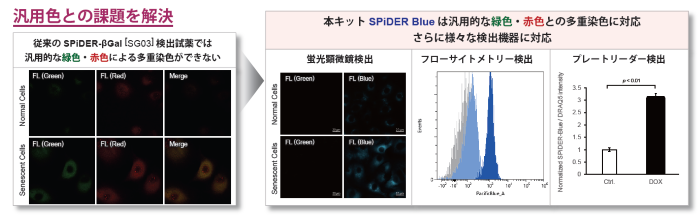
本キットには、従来品β-galactosidase検出試薬SPiDER-βGalの検出原理を採用した青色色素SPiDER Blueが含まれています。 SPiDER Blueは従来品SPiDER-βGalではできなかった汎用される緑色・赤色色素との多重染色を可能とした老化関連β-ガラクトシダーゼ(SA-β-Gal, Senescence-associated β-galactosidase)の検出色素です。内在性β -ガラクトシダーゼのバックグラウンドの影響を抑えられるAssay Bufferも同梱されています。

老化細胞検出用試薬の選択ガイド
| 製品名 | サンプル | 対応装置 | 色素 / 検出波長 |
| 生細胞 固定化細胞 |
 |
SPiDER-βGal |
|
| Cellular Senescence Detection Kit- SPiDER Blue |
固定化細胞 |  |
SPiDER-Blue Ex: 350-450 nm / Em: 400-500 nm |
| SPiDER-βGal | 組織 |  |
SPiDER-βGal Ex: 500-540 nm / Em: 530-570 nm |
| Cellular Senescence Plate Assay Kit- SPiDER-βGal |
生細胞 |  |
SPiDER-βGal |
マニュアル
技術情報
原理
正常細胞は、分裂を繰り返すことや、酸化ストレス等によりDNA に損傷を生じます。損傷DNA が修復されない場合には、不可逆的に細胞分裂を停止することにより細胞の癌化を抑制します。不可逆的な細胞分裂の停止は細胞老化と呼ばれており、老化細胞にはSA-β-gal (senescence-associated β-galactosidase) が過剰発現しています。このため、SA-β-gal は、老化マーカーのひとつとしてその判別に汎用されています 1, 2)。本製品は、SA-β-gal を簡便かつ高感度に検出するためのキットです。固定化細胞中のSA-β-gal と反応することで青色蛍光を発するため、緑や赤色の蛍光特性を持つ色素や蛍光標識抗体による免疫染色との共染色が可能です。
1) Dimri, G. P. et al., Cell Biology, 1995, 92, 9363–9367.
2) Park, A. M. et al., J. Biol. Chem., 2018, 293(41), 15815-15826.
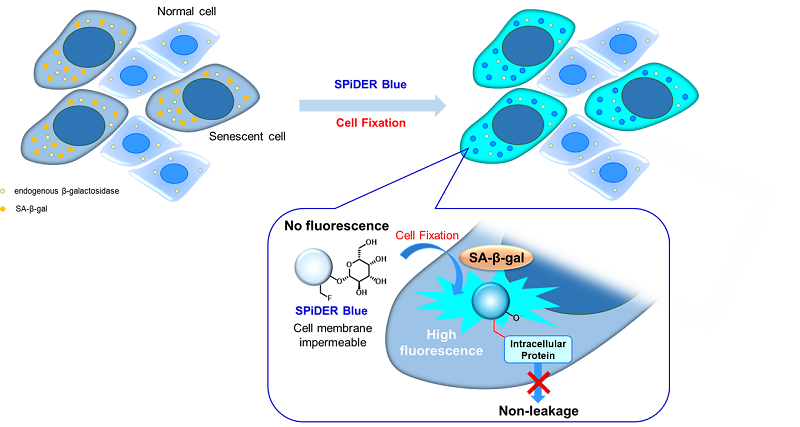
図1 SPiDER Blue による老化細胞の検出原理
蛍光特性(β-galactosidase と反応後のSPiDER Blue )
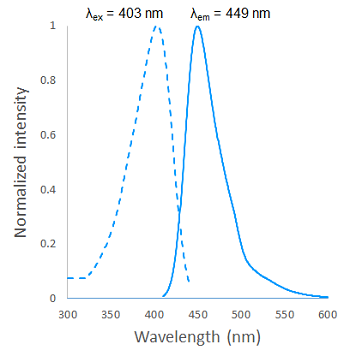
図2 β-galactosidase と反応後のSPiDER Blue の励起・蛍光スペクトル
SPiDER色素ラインナップと比較表
| 製品名 | 特徴 | 生細胞 | 固定化細胞 | 装置の対応 | 検出 |
| Cellular Senescence Detection Kit SPiDER Blue |
免疫染色等との多重染色による 詳細な解析が可能 |
- | ✓ |  |
Ex=350-450 nm Em=400-500 nm |
| Cellular Senescence Detection Kit SPiDER-βGal |
生細胞・固定化細胞に使用でき、 初めての検出に最適 |
✓ | ✓ |  |
Ex=500-540 nm Em=530-570 nm |
| Cellular Senescence Plate Assay Kit SPiDER-βGal |
✓ | - |  |
Ex=500-540 nm Em=530-570 nm |
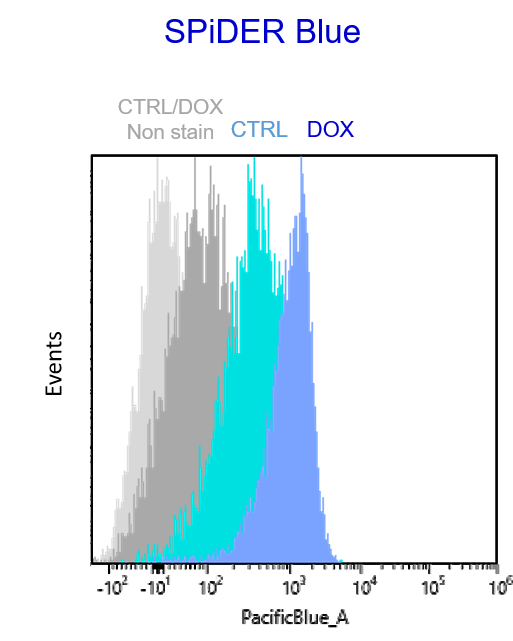
実験例:Doxorubicin誘導老化細胞を用いた酸化ストレス関連マーカーとの多重染色解析(フローサイトメトリー
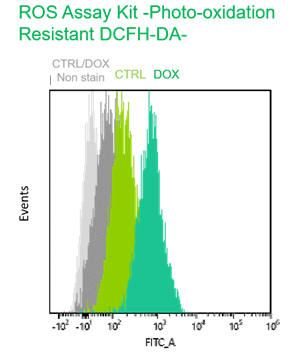
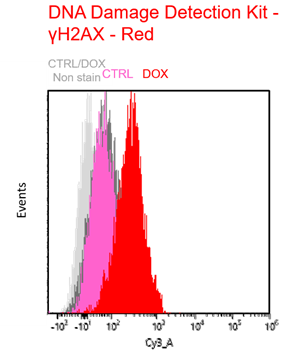
Doxorubicin処理により老化誘導したA549細胞(DOX)と通常細胞(CTRL)を用いて、老化細胞の酸化ストレス関連マーカーの変化をフローサイトメトリーで多重染色解析しました。老化マーカーとしてSA-β-GalをCellular Senescence Detection Kit - SPiDER Blue, 酸化ストレスマーカーとしてtotal ROSの検出をROS Assay Kit -Photo-oxidation Resistant DCFH-DA-, DNAダメージマーカーとしてγH2AXをDNA Damage Detection Kit - γH2AX – Redで検出しました。
その結果、 SA-β-Gal陽性の老化細胞において、total ROS, γH2AXが増大し、老化に伴う酸化ストレス関連マーカーの増加を多重染色により検出することができました。
【検出条件】
使用装置:SONY 社: SA3800
SPiDER Blue: PacificBlue
Photo-oxidation Resistant DCFH-DA: FITC
γH2AX – Red: Cy3
<実験手順>
•事前に、通常培地で培養した細胞 (CTRL) と、DOX 処理 (0.2 μM DOX 3 days → 通常培地 3 days) した細胞 (DOX) を準備
1. A549 細胞 (5 x 105 cells/ml) の細胞懸濁液を準備した。
2. 細胞懸濁液を1.5 ml チューブに1 ml 入れ、ピペッティングにより懸濁した。
3. 300 x g で5 分間遠心した。
4. 培地を除去し、Photo-oxidation Resistant DCFH-DA Dye Working Solution を500 μl 添加し、ピペッティングにより懸濁した。
5. 37℃で30 分間静置し、300 x g で5 分間遠心した。
6. 上澄みを除去し、 4% PFA/PBS 溶液を200 μl 添加し、4℃で一晩静置した。 (30 min でも可)
7. 1,000 x g で5 分間遠心した。
8. 上澄みを除去し、 15 µmol/l SPiDER Blue 溶液 (Assay buffer) を500 μl 添加し、ピペッティングにより懸濁した。
9. 37℃で30 分間静置し、1,000 x g で5 分間遠心した。
10. 上澄みを除去し、 0.1% TritonX-100 溶液 (PBS) を100 μl 添加し、ピペッティングにより懸濁した。
11. 室温で20 分間静置し、1,000 x g で5 分間遠心した。
12. 上澄みを除去し、 Blocking Solution を300 μl 添加し、ピペッティングにより懸濁した。
13. 室温で20 分間静置し、1,000 x g で5 分間遠心した。
14. 上澄みを除去し、 Anti γH2AX antibody staining solution 500 μl を添加した。
15. 室温で1 時間静置し、1,000 x g で5 分間遠心した。
16. 上澄みを除去し、 Secondary antibody-Red staining solution 500 μl を添加した。
17. 室温で1 時間静置し、1,000 x g で5 分間遠心した。
18. 上澄みを取り除き、PBSを 500 μl 添加し、ピペッティングにより懸濁した。
19. 1,000 x g で5 分間遠心した。
20. 上澄みを除去し、PBSを 500 μl 添加した。
21. サンプルをフローサイトメーター測定用のセルストレーナーに通した。
22. フローサイトメーター (SONY 社: SA3800) で測定した。
実験例:固定化細胞を用いた脂肪滴染色と細胞老化アッセイ(イメージング)
Doxorubicin処理により老化誘導したA549細胞(DOX)と通常細胞(CTRL)を用いて、老化細胞の脂肪滴蓄積をイメージング解析しました。老化マーカーとしてSA-β-GalをCellular Senescence Detection Kit - SPiDER Blue, 脂肪滴をLipi-Deep Redで検出しました。
その結果、 SA-β-Gal陽性の老化細胞において、Lipi-Deep Redのシグナルが増加したことから老化細胞での脂肪滴蓄積を共染色により検出することができました。
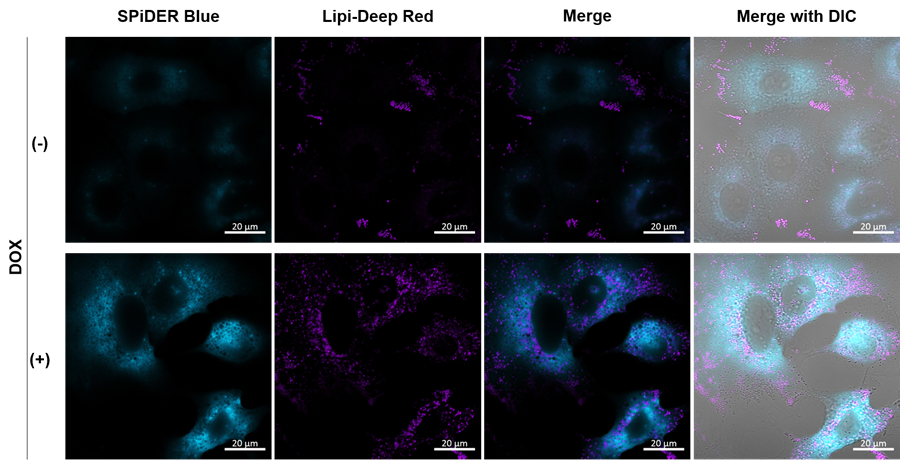
[検出条件]
SPiDE Blue 検出波長: 405 nm (Ex), 400–550 nm (Em), 1.0%, 600V
Lipi-Deep Red 検出波長: 633 nm (Ex), 650–700 nm (Em), 1.0%, 650V
*事前に、通常培地で培養した細胞 (CTRL) と、DOX 処理 (0.2 μM DOX 3 days → 通常培地 3 days) した細胞 (DOX) を準備
1. A549 細胞をμ-slide 8 well plate (ibidi 社) に播種し、37℃ CO2 インキュベーターで一晩培養した。(1 x 105 cells/ml の細胞懸濁液を200 µl 入れた)
2. 上澄みを取り除き、PBS で1回洗浄後、4% パラホルムアルデヒド (PFA) / PBS 溶液を添加し、室温で30 分間固定化した。
3. 上澄みを取り除き、細胞をPBS で1 回洗浄した。
4. Assya bufferで調製した15 μM SPiDER Blue + 0.1 µM Lipi-Deep Red を添加し、 37℃で30 分間インキュベートした。
*5% CO2 インキュベーターは使用しない
5. 上澄みを取り除き、PBS で1 回洗浄後、PBS を200 µl添加し共焦点レーザー顕微鏡 (60 倍率) で観察した。
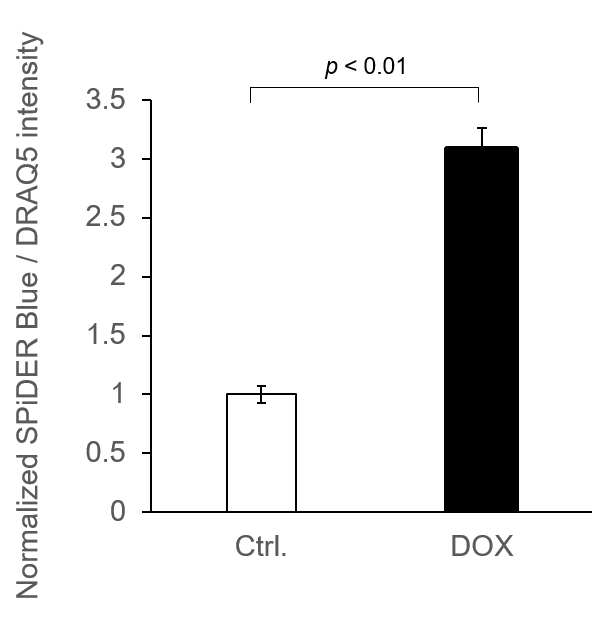
実験例:蛍光プレートリーダーでの数値化解析
*事前に、通常培地で培養した細胞 (CTRL) と、DOX 処理 (0.2 μM DOX 3 days → 通常培地 3 days) した細胞 (DOX) を準備
1. A549 細胞を96 well Black Plate (クリアボトム) に播種し、37℃ CO2 インキュベーターで一晩培養した。(1 x 105 cells/ml 細胞懸濁液を200 µl 加えた)
2. 上澄みを除去し、PBSを 100 μl 添加し、細胞を洗浄した。
3. 4% PFA/PBS 溶液を100 μl 添加し、室温で30 分間静置した。
4. 上澄みを除去し、PBSを 100 μl 添加し、細胞を洗浄した。
5. 15 µmol/l SPiDER Blue 溶液 (キット付属のAssay Bufferに希釈した) を100 μl 添加し、37℃で30 分間インキュベートした。
6. 上澄みを除去し、PBSを 100 μl 添加し、細胞を洗浄した。
7. 5 µmol/l DRAQ5 溶液 (PBS) を100 μl 添加し、37℃で5 分間インキュベートした。上澄みを除去し、PBSを 100 μl 添加し、細胞を洗浄し蛍光プレートリーダーで測定した。
細胞数による補正のため、 DRAQ5 を使用し核酸染色を行い、蛍光値を測定した。(下方励起、下方蛍光測定)
8. 上澄みを除去し、PBSを 100 μl 添加し、細胞を洗浄した。
9. Lysis Buffer*1 100 μl を各ウェルに添加し、室温で10 分間インキュベートした。
10. Stop Solution*2 100 μl を各ウェルに添加した。
11. 蛍光プレートリーダーでSPiDER Blueのシグナルを検出した。 (上方励起、上方蛍光測定)
*1 Lysis Buffer: 20 mMクエン酸, 40 mM リン酸緩衝液 pH 6.0, 0.05% NP-40
*2 Stop Solution: 0.5 M 炭酸ナトリウム-重炭酸ナトリウム緩衝液 pH 10.0
-
*N=3
*DRAQ5 の蛍光値でノーマライズ<検出条件>
•SPiDER Blue: Ex/Em = 405/460 nm
•DRAQ5: Ex/Em = 633/681 nm
実験例:老化マウス肝臓脂肪組織切片の染色(SPiDER-βGalとの比較)
1. 8 週齢、35 週齢のマウス肝臓脂肪組織 (凍結切片) をスライドガラスに貼付したサンプルを準備した。
2. PBS で1回洗浄後、4% パラホルムアルデヒド (PFA) / PBS 溶液を200 µl 添加し、室温で30 分間固定化した。
3. 上澄みを取り除き、PBS で1 回洗浄した。
4. Assay buffer で調製した15 µM SPiDER Blue、15 µM SPiDER-βGal を200 µl 添加し、 37℃で2 時間インキュベートした。
5. 上澄みを取り除き、PBS で1 回洗浄した。
6. 封入剤 (ProLong Glass Antifade Mountant, Thermo) を1 滴添加し、カバーガラスで封入した。
7. 共焦点レーザー顕微鏡 (40 倍率) で観察した。

[検出条件]
•SPiDER Blue 検出波長: 405 nm (Ex), 400–500 nm (Em), 2.0%, 700V
•SPiDE-βGal 検出波長: 488 nm (Ex), 500–600 nm (Em), 1.0%, 600V
よくある質問
-
Q
Working solutionは、どのくらい安定ですか?
-
A
Working solutionは保存できないため、用時調製して下さい。
-
Q
染色後サンプルを保存し後日観察したいのですが、可能ですか?
-
A
小社ではA549細胞にDOX処理した老化細胞を15 μM SPiDER Blueで染色した後に、4℃で3日保存したサンプルを観察した実績がございます。
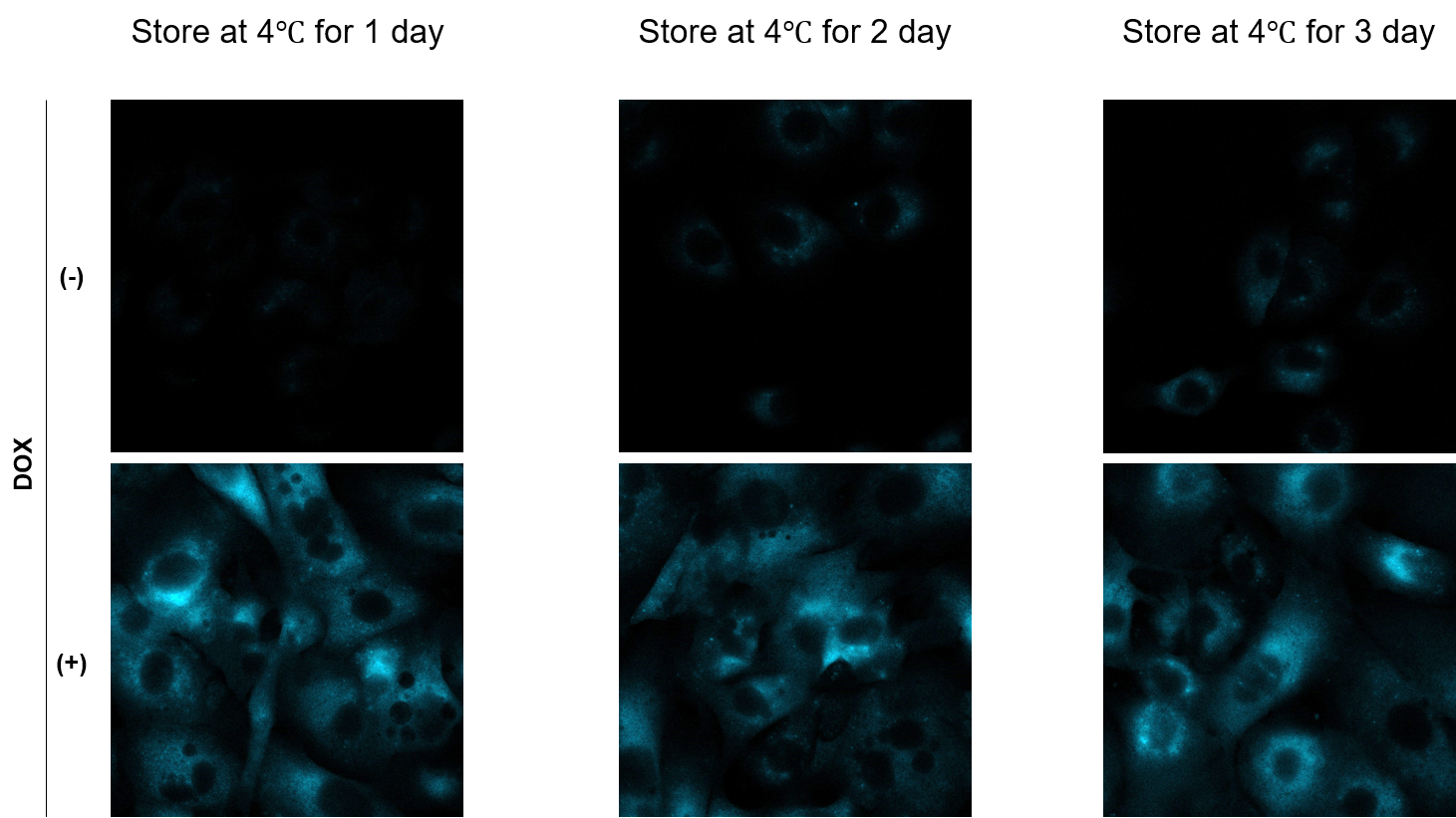
-
Q
落射型顕微鏡でも観察可能ですか?
-
A
可能です。小社では落射型顕微鏡(KEYENCE社)での観察実績がございます。
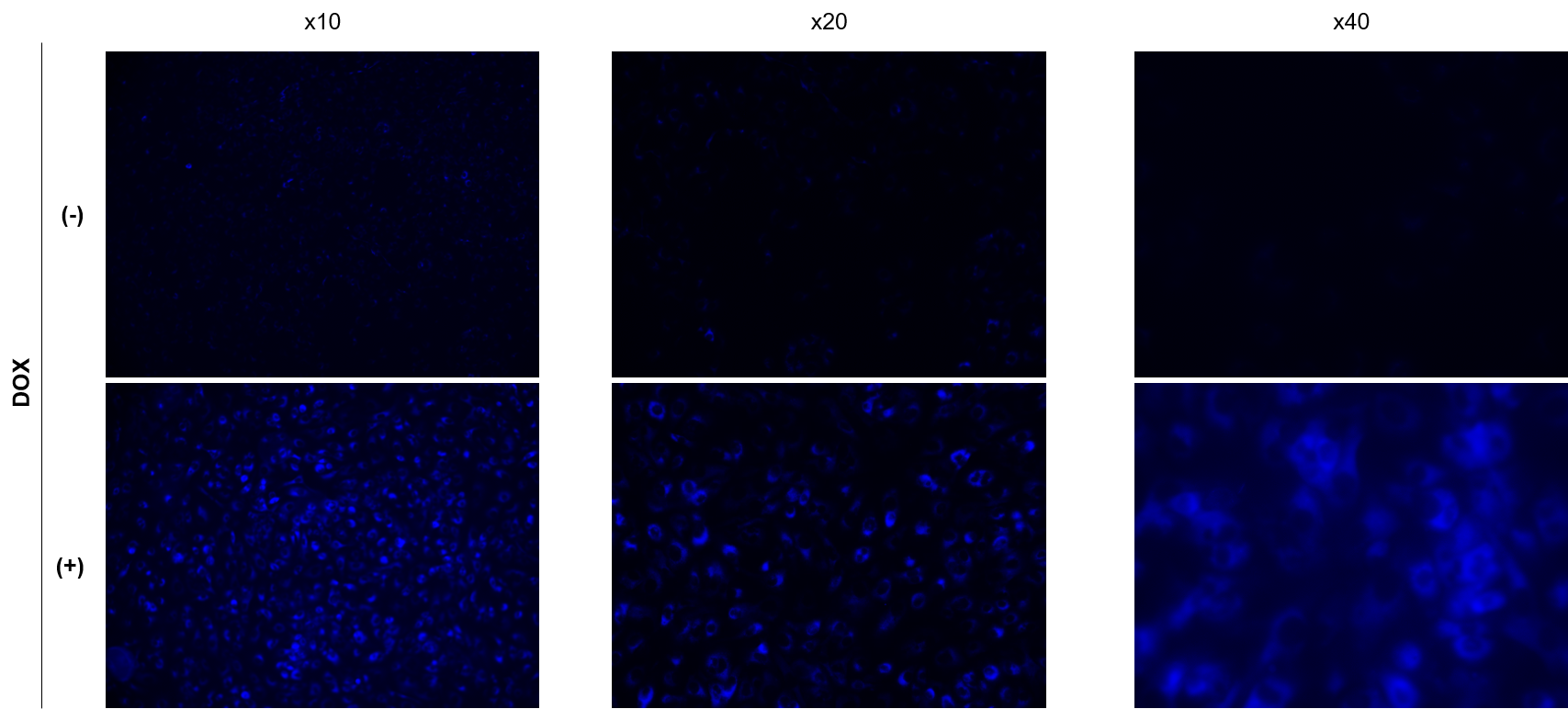
SPiDER Blue: 15 µM
露光時間:1s (Ex = 340 - 380 nm, Em = 435 - 485 nm)
取扱条件
| 保存条件: 冷凍 | |
|
危険・有害 シンボルマーク |

|
|---|---|