はじめに
正常細胞は、分裂を繰り返すことや、酸化ストレス等によりDNA に損傷を生じます。損傷DNA が修復されない異常細胞がこれ以上増えないようにするため、不可逆的に分裂を停止する細胞老化が引き起こされます。このようにして生じた老化細胞において過剰発現が認められるSA-β-gal(senescence-associated β-galactosidase) は、老化マーカーの1 つとして広く用いられています。代表的なSA-β-gal の検出方法としてX-gal 染色が広く利用されていますが、(1)細胞膜透過性が乏しいため細胞を固定化する必要がある、(2) 染色された細胞を目視により判別する必要があるため定量性に欠ける、(3) 染色に時間を要する、などが課題となっています。
本製品は、SA-β-gal を簡便かつ高感度に検出するためのキットです。キット付属のSPiDER-βGal は、細胞膜透過性が高く、優れた細胞内滞留性を有する新規のβ- ガラクトシダーゼ検出用蛍光プローブであり、内在性のβ- ガラクトシダーゼ活性を抑制するための試薬(Bafilomycin A1) と併用することで、固定化細胞だけでなく生細胞内のSA-β-gal を特異的に検出することができます。そのため、フローサイトメトリーを用いた定量解析にも有用です。
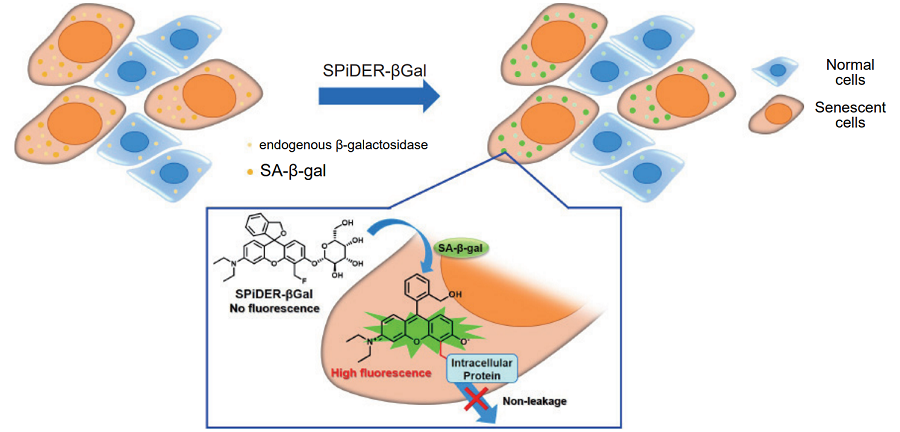
図1 SPiDER-βGal による老化細胞の検出原理
- <推奨フィルター>
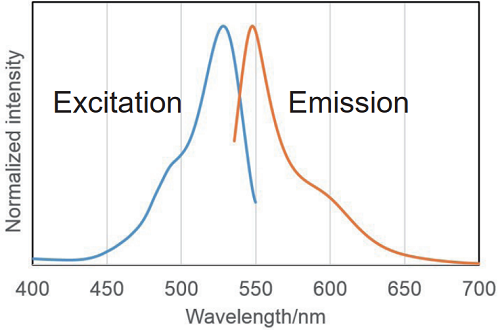
励起:500 ~ 540 nm
蛍光:530 ~ 570 nm
共焦点レーザー顕微鏡およびフローサイトメーターでは、
488 nm 励起により検出した実績があります。
図2 β- ガラクトシダーゼと反応後のSPiDER-βGal の励起・蛍光スペクトル
キット内容
|
SPiDER-βGal |
x 1 |
|
Bafilomycin A1 |
x 1 |
- Bafilomycin A1 は極少量であるため、内容物が見え難くなっています。取扱いにご注意下さい。
キット容量
10 assays (35 mm dish)
必要なもの(キット以外)
- Dimethyl sulfoxide (DMSO)
- 培地またはHBSS
- マイクロピペット
溶液調製
SPiDER-βGal DMSO stock solution の調製
SPiDER-βGal を含むチューブにDMSO 14 μl を加え、ピペッティングにより溶解する。
溶解後のSPiDER-βGal DMSO stock solution は、-20℃ 以下で保存して下さい。
Bafilomycin A1 DMSO stock solution の調製
Bafilomycin A1 を含むチューブにDMSO 24 μl を加え、ピペッティングにより溶解する。
溶解後のBafilomycin A1 DMSO stock solution は、-20℃ 以下で保存して下さい
操作
- 細胞老化が進むと細胞内にリポフスチンと呼ばれる不溶性物質が蓄積してきます。リポフスチンは自家蛍光を発するため、蛍光観察時にバックグラウンドとして影響することがあります。その場合、老化細胞中のSA-β-gal 活性を正確に評価するために、SPiDER-βGal を添加しない試料もご用意いただき確認することをお勧めします。詳細は小社製品HP中のFAQ『蛍光観察時の注意点』をご確認ください。
- 生細胞を用いたアッセイ -
Bafilomycin A1 working solution の調製
Bafilomycin A1 DMSO stock solution を培地またはHBSS で1,000 倍希釈する。
SPiDER-βGal working solution の調製
SPiDER-βGal DMSO stock solution とBafilomycin A1 DMSO stock solution を培地またはHBSS で1,000 倍希釈する。
- 1 ml 調製する場合、SPiDER-βGal DMSO stock solution 1 μl とBafilomycin A1 DMSO stock solution 1 μl を培地またはHBSS 1 mlに加えて調製する。
- 細胞を35 mm ディッシュに播種し、37℃、5% CO2 インキュベーターで一晩培養する。
- 培地を吸引除去し、培地またはHBSS 2 ml で1 回洗浄する。
- 調製したBafilomycin A1 working solution 1 ml を加え、37℃、5% CO2 インキュベーターで1 時間静置する。
- 調製したSPiDER-βGal working solution 1 ml を加え、37℃、5% CO2 インキュベーターで30 分間静置する。
- 上澄みを吸引除去し、培地またはHBSS 2 ml で2 回洗浄後、蛍光顕微鏡で観察あるいはフローサイトで測定する。
- 固定化細胞を用いたアッセイ -
SPiDER-βGal working solution の調製
SPiDER-βGal DMSO stock solution をMcIlvaine buffer(pH 6.0)で2,000 倍希釈する。
- McIlvaine buffer(pH 6.0): 0.1 mol/l クエン酸水溶液3.7 ml と0.2 mol/l リン酸水素二ナトリウム水溶液6.3 ml を混合して調製し、pH 6.0 であることを確認する。pH 6.0 でない場合は、クエン酸水溶液あるいはリン酸水素二ナトリウム水溶液でpH 6.0 に調整する。この水溶液を超純水で5 倍希釈する。
- 細胞を35 mm ディッシュに播種し、37℃、5% CO2 インキュベーターで一晩培養する。
- 培地を吸引除去し、HBSS 2 ml で1 回洗浄後、4% パラホルムアルデヒド(PFA)/PBS 溶液2 ml を添加し、室温で3 分間固定化する。
- 4% PFA/PBS 溶液を吸引除去し、HBSS 2 ml で3 回洗浄する。
- 調製したSPiDER-βGal working solution 2 ml を加え、37℃ で30 分間インキュベートする。
- 固定化細胞を用いてSA-β-gal を検出する際は、5% CO2 インキュベーターは使用しないで下さい。
5% CO2 インキュベーターを使用した場合、working solution のpH が酸性側に傾き、内在性のβ- ガラクトシダーゼと反応することにより、バックグラウンドが上昇する恐れがあります。
- 固定化細胞を用いてSA-β-gal を検出する際は、5% CO2 インキュベーターは使用しないで下さい。
- インキュベート後、HBSS 2 ml で2 回洗浄し、蛍光顕微鏡で観察あるいはフローサイトで測定する。
実験例
SA-β-gal の蛍光イメージング
-
- 継代数0 回および継代数12 回のWI-38 細胞(5×104 cells/dish、10% fetal bovine serum、1% penicillin-streptomycin を含むMEM 培地)をそれぞれμ-Dish 35 mm(ibidi 社製)に播種し、37℃、5%CO2 インキュベーターで一晩培養した。
- 培地を吸引除去し、HBSS 2 ml で1 回洗浄した。
- 調製したBafilomycin A1 working solution 1 ml を加え、37℃、5% CO2 インキュベーターで1 時間静置した。
- 調製したSPiDER-βGal working solution 1 ml に1 mg/ml Hoechst 33342水溶液1μl を混合した溶液を加え、37℃、5% CO2 インキュベーターで30 分間静置した。
- 上澄みを吸引除去し、HBSS 2 ml で2 回洗浄後、HBSS 2 ml を加え共焦点レーザー顕微鏡で観察した。(励起波長: 488 nm、蛍光波長: 500-600 nm)
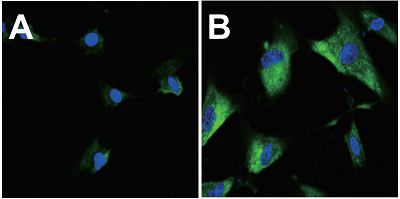
図3 SA-β-gal の蛍光イメージング画像
A. 継代数0 回 B. 継代数12 回
(緑: SPiDER-βGal、青: Hoechst 33342)
フローサイトメトリーによるSA-β-gal 陽性細胞の定量解析
-
- 継代数1 回および継代数12 回のWI-38 細胞(1×105 cells/dish、10% fetal bovine serum、1% penicillin-streptomycin を含む MEM 培地)をそれぞれ μ-Dish 35 mm( ibidi 社製)に播種し、37℃、5% CO2 インキュベーターで一晩培養した。
- 培地を吸引除去し、HBSS 2 ml で1 回洗浄した。
- 調製したBafilomycin A1 working solution 1 ml を加え、37℃、5% CO2インキュベーターで1 時間静置した。
- 調製したSPiDER-βGal working solution 1 ml を加え、37℃、5% CO2インキュベーターで30 分間静置した。
- 上澄みを吸引除去し、HBSS 2 ml で2 回洗浄した。
- トリプシン処理により細胞を剥がした後、MEM 培地(10% fetal bovineserum、1% penicillin-streptomycin)で希釈し、フローサイトメーターで測定した(励起波長: 488 nm、蛍光波長: 515-545 nm)。
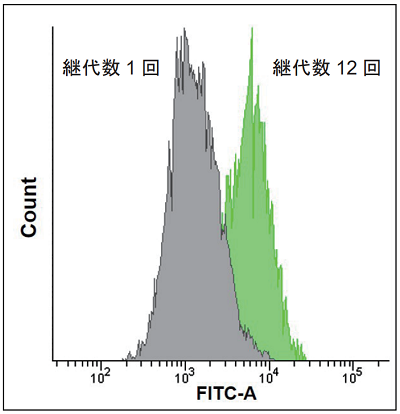
図4 SA-β-gal 陽性WI-38 細胞の定量
参考文献
- T. Doura, M. Kamiya, F. Obata, Y. Yamaguchi, T. Y. Hiyama, T. Matsuda, A. Fukamizu, M. Noda, M. Miura and Y. Urano, Angew. Chem. Int. Ed., 2016, 55, 9620.
よくある質問/参考文献
SG03: Cellular Senescence Detection Kit - SPiDER-βGal
Revised Aug., 25, 2023


 を押して省略できます。
を押して省略できます。