Nucleolus Bright Green

核小体蛍光染色
- 添加するだけで核小体をイメージング
-
製品コードN511 Nucleolus Bright Green
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 60 nmol | ¥34,900 | 341-09341 |
<使用回数の目安> 35 mm dish 30枚分(色素濃度 1 μmol/lで使用した場合)
性 質
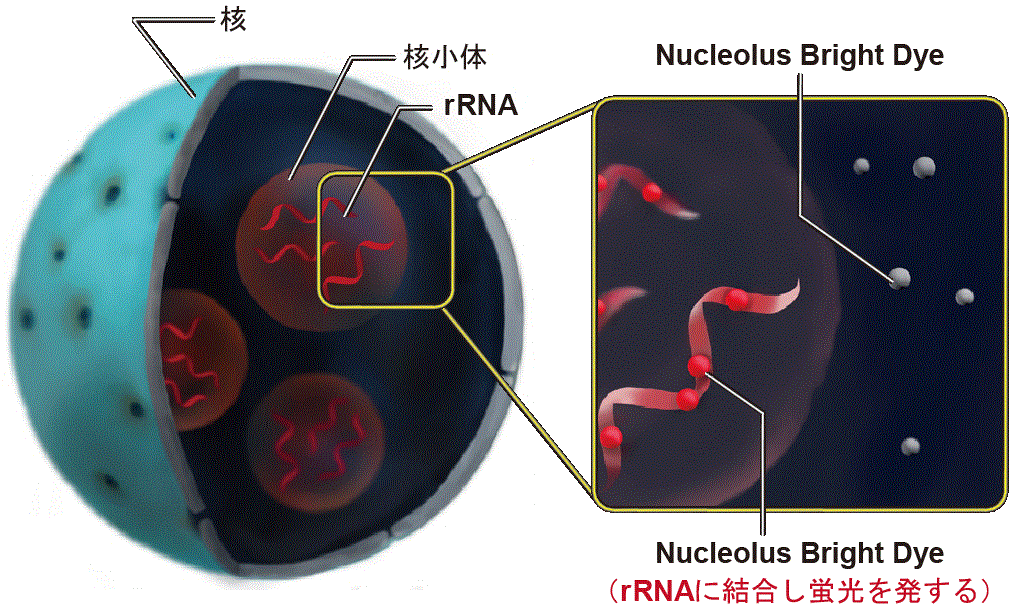
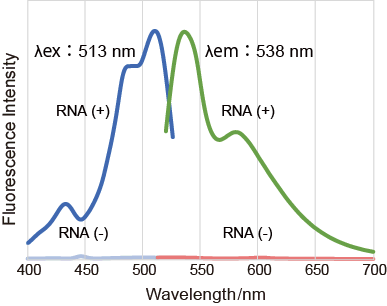
Nucleolus Bright はRNA に結合し蛍光性となる低分子蛍光色素で、固定化した細胞に試薬を添加するだけで簡便にイメージングすることができます。なおNucleolus Bright は、核小体以外に存在するRNA にも反応しますが、RNA の中でも細胞内に最も多く存在するrRNAの産生の場である核小体で特に強い蛍光を示します。
イメージングの際には、核染色試薬DAPI[製品コード:D523]と共染色することで、核小体をよりわかり易く確認頂けます。詳細は、取扱説明書中の実験例を参照ください。
マニュアル
技術情報
核小体を特定する検出原理
核小体は膜を持たない核内構造体であり、リボソーム生合成の起点となる場所です。核小体にはリボソームを構成するリボソームRNA (rRNA) が多く存在し、rRNA の転写やプロセシングなどが行われます。
また、核小体の変化は多くの細胞内イベントに関わっていると考えられており、以前よりがんの病理診断の指標として知られていましたが、近年では核小体ストレスを含め核小体とDNA 損傷、ウイルス感染、オートファジー及び細胞老化との関連性が報告されており、様々な研究分野で注目されています。
核小体染色試薬の比較
|
極大励起波長 |
極大蛍光波長 |
MeOH固定化後の染色 |
PFA固定化後の染色 |
生細胞染色 |
|
| Nucleolus Bright Green |
513 nm |
538 nm |
〇 |
〇 |
△※ |
| Nucleolus Bright Red |
537 nm |
605 nm |
〇 |
〇 |
△※ |
※ 生細胞にて評価をご希望の際は、小社カスタマーサポートまでお問合せください。
鮮やかに核小体を見る
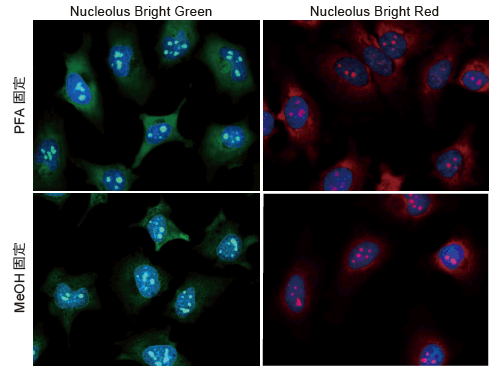
HeLa 細胞を4% PFA またはMeOH にて固定化後、PBS 洗浄および膜透過処理(Triton X-100)し、Nucleolus Bright Green またはRedおよび核染色試薬(DAPI)を添加、インキュベーション後に共焦点蛍光顕微鏡により観察しました。
結果、DAPI により染色された核内(青)に複数個の核小体が存在することが確認されました。
<染色条件>
・PFA 固定
4% PFA に細胞を室温で5 分間、Triton X-100 に室温で20 分間浸漬後、各蛍光プローブにて5 分間インキュベーション。
・MeOH 固定
冷MeOH に細胞を1 分間、Triton X-100 に室温で20 分間浸漬後、各蛍光プローブにて5 分間インキュベーション。
| <検出条件> | |
|
Nucleolus Bright Green |
:Ex. 488 nm / Em. 500-600 nm |
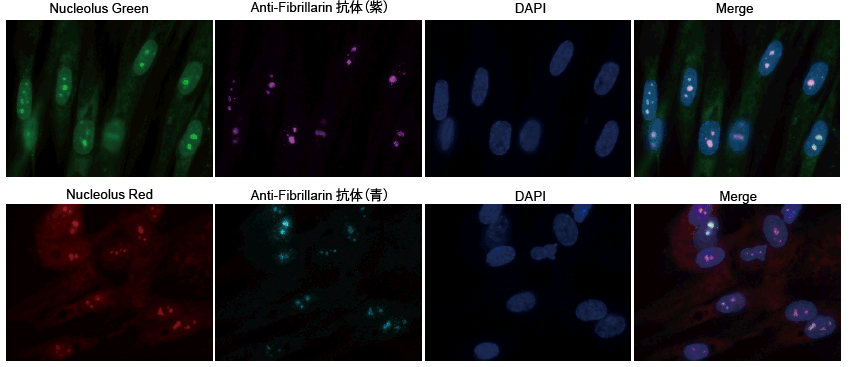
核小体への局在性
WI-38 細胞を 4% PFA にて固定化後、抗 Fibrillarin 1 次抗体および蛍光標識 2 次抗体により免疫染色し、Nucleolus Bright Green またはRed および核染色試薬(DAPI)を添加、インキュベーション後に落射型蛍光顕微鏡(キーエンス、BZ-X710)により観察しました。
結果、Nucleolus Bright Green 及び Nucleolus Bright Red は、核小体マーカー(dense fibrillar component)と染色部位が一致しました。
<検出条件>
| Nucleolus Bright Green | :Ex. 450-490 nm / Em. 500-550 nm |
|
:Ex. 533-548 nm / Em. 570-640 nm |
|
| DAPI | :Ex. 340-380 nm / Em. 435-485 nm |
|
Anti-Fibrillarin 抗体 |
:Ex. 590-650 nm / Em. 668-733 nm |
核小体に関連した分野の報告例
| 関連分野 | 概要 | 論文 |
|---|---|---|
| レビュー(老化) | 様々な細胞機能に関与している核小体について、既に知られている癌や早老症との関わりを含め、特に老化に関する核小体機能について言及している。 | V. Tiku, A. Antebi,  “Nucleolar Function in Lifespan Regulation.”, Trends Cell Biol., 2018, 28(8), 662. “Nucleolar Function in Lifespan Regulation.”, Trends Cell Biol., 2018, 28(8), 662. |
| 細胞老化 | 老化抑制に関与するタンパク質欠損により、核小体数の減少と核小体の総面積の増加がみられている。 | H. Tanaka, S. Takebayashi, A. Sakamoto, T. Igata, Y. Nakatsu, N. Saitoh, S. Hino, M. Nakao,  “The SETD8/PR-Set7 Methyltransferase Functions as a Barrier to Prevent Senescence-Associated Metabolic Remodeling.”, Cell Rep.,2017, 18(9), 2148. “The SETD8/PR-Set7 Methyltransferase Functions as a Barrier to Prevent Senescence-Associated Metabolic Remodeling.”, Cell Rep.,2017, 18(9), 2148. |
| 細胞老化 | rRNAプロセシング因子の枯渇により核小体が肥大化、併せてSA-βGalやp16発現が亢進した。 | K. Nishimura, T. Kumazawa, T. Kuroda, N. Katagiri, M. Tsuchiya, N. Goto, R. Furumai, A. Murayama, J. Yanagisawa, K. Kimura,  “Perturbation of ribosome biogenesis drives cells into senescence through 5S RNP-mediated p53 activation.”, Cell Rep., 2015, 10(8), 1310. “Perturbation of ribosome biogenesis drives cells into senescence through 5S RNP-mediated p53 activation.”, Cell Rep., 2015, 10(8), 1310. |
| オートファジー | RNAポリメラーゼの転写阻害によりオートファジーの誘導と核小体の形状変化を確認している。 | N. Katagiri, T. Kuroda, H. Kishimoto, Y. Hayashi, T. Kumazawa and K. Kimura,  “The nucleolar protein nucleophosmin is essential for autophagy induced by inhibiting Pol I transcription”, Scientific Reports, 2015, 8903, DOI: 10.1038/srep08903. “The nucleolar protein nucleophosmin is essential for autophagy induced by inhibiting Pol I transcription”, Scientific Reports, 2015, 8903, DOI: 10.1038/srep08903. |
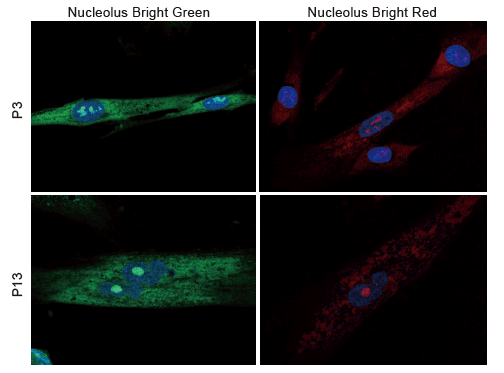
老化細胞での評価
継代数の異なるWI-38 細胞を4% PFA にて固定化後、PBS 洗浄および1% Triton X-100 による膜透過処理し、Nucleolus Bright Green またはRed および核染色試薬のDAPI を添加しインキュベーション後に共焦点顕微鏡により蛍光を確認しました。
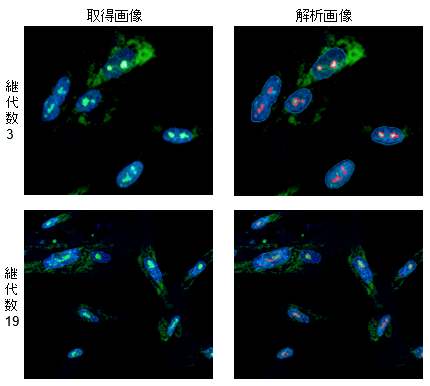
結果、継代数3 回の細胞では1 つの核に複数個の核小体が存在することが確認されましたが、継代を18 回行った細胞では核小体は肥大化し一つになっていることが確認されました。
老化に関連した論文は「参考論文」の項にご案内しています。
<染色条件>
4% PFA に細胞を5 分間、Triton X-100 に20 分間浸漬後、各蛍光プローブにて5 分間インキュベーション。
| <検出条件> | |
|
Nucleolus Bright Green |
:Ex. 488 nm / Em. 500-600 nm |
共焦点定量イメージサイトメーターによる定量解析
共焦点定量イメージサイトメーター(横河電機株式会社 CQ1)を用いた老化細胞の定量解析を行いました。
継代数の異なるWI-38細胞を固定化後、Nucleolus Bright Greenにより核小体を、DAPIにて核を染色し、共焦点定量イメージサイトメーターで定量解析を行いました。
画像解析による核小体の解析
共焦点定量イメージサイトメーターを用いて405 nmで核画像を、488 nmで核小体画像を撮影、解析ソフトウェアCellPathfinderで個々の核内の核小体を認識しその数を算出しました。
|
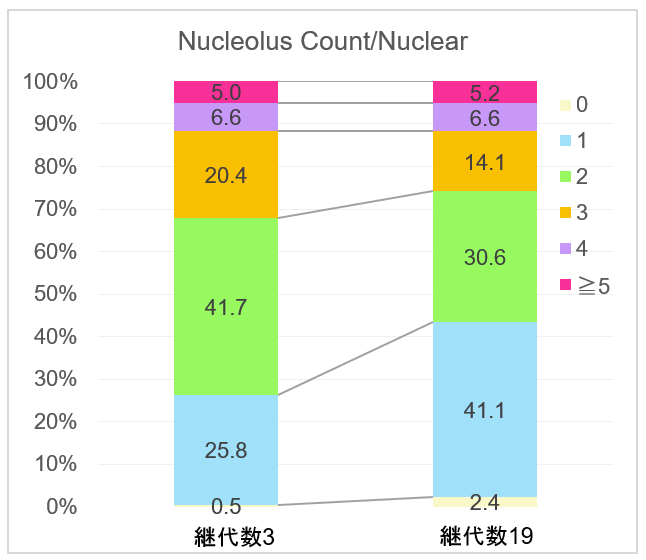
核小体数の解析
継代数の多い細胞において、1個の核に対して1個の核小体が存在する割合が増大し、2個以上の核小体が存在する割合は減少する結果が得られました。この結果は、下記論文中にある老化したWI-38細胞における核小体数の減少(論文中のTable 3)*1、およびSETD8ノックダウンにより老化誘導した細胞の核小体の変化(論文中のFigure 4D)*2と同様の結果になりました。
*1 P. M. Bemiller, L. Lee, “Nucleolar changes in senescing WI-38 cells”, Mech. Ageing Dev., 1978, 8 , 417.
*2 H. Tanaka, S. Takebayashi, A. Sakamoto, T. Igata, Y. Nakatsu, N. Saitoh, S. Hino, M. Nakao, “The SETD8/PR-Set7 Methyltransferase Functions as a Barrier to Prevent Senescence-Associated Metabolic Remodeling.”, Cell Rep., 2017, 18(9), 2148.