はじめに
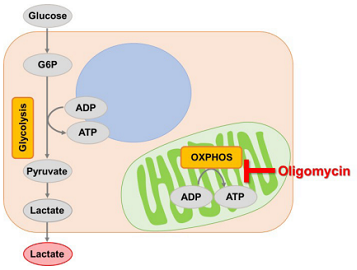
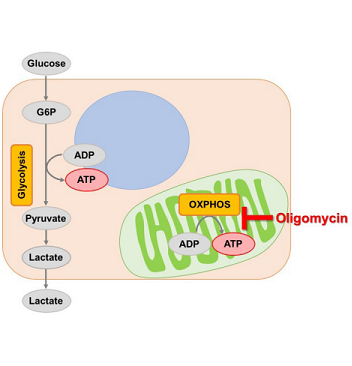
解糖系およびミトコンドリアの酸化的リン酸化で産生されるATPは、細胞が生きていくためのエネルギー源として重要です。中でも多くのがん細胞は、解糖系に依存したエネルギー代謝によりATPを産生しています。ところが最近の研究によりがん細胞は、解糖系が抑制されても、ミトコンドリア機能を亢進させることでエネルギー代謝を酸化的リン酸化にシフトさせ、生存に必要なATPを産生するようになることが報告されています1, 2)。これらの現象を見ることは、抗がん剤のメカニズム解明に役立つだけでなく、老化、がん、神経変性疾患を含む様々な疾患における治療戦略の開発に繋がることが期待されています3)。
Glycolysis/OXPHOS Assay Kitは、阻害剤(Oligomycinと2-DG)を使用し、細胞の解糖能、代謝シフトおよび、細胞が解糖系と酸化的リン酸化のどちらに依存してエネルギー産生を行っているのかといったことを評価するキットです。本キットには、これらの評価に必要な試薬が全て同梱さています。
キット内容
| Dye Mixture (青キャップ) | x 1 | Lactate Assayに使用します |
| Lactate Standard (10 mmol/l) (青キャップ) | 150 μl x 1 | |
| LDH Solution (紫キャップ) | 12 μl x 1 | |
| Lactate Assay Buffer | 5.5 ml x 1 | |
| Reconstitution Buffer (白キャップ) | 550 μl x 1 | |
| Substrate (緑キャップ) | x 1 | ATP Assayに使用します |
| Luciferase Solution (緑キャップ) | 10 μl x 1 | |
| ATP Assay Buffer | 5.5 ml x 1 | |
| Oligomycin (黄キャップ) | x 1 | 阻害剤として使用します |
| 2-DG (赤キャップ) | 140 μl x 1 |
- 本キットには、96穴マイクロプレート48 well分のLactate Assay用試薬、ATP Assay用試薬、阻害剤が含まれます。
本キットで測定可能なサンプル数については製品webページに掲載しています。 - 本キットでの評価は、吸光度および発光値を用いた相対評価で行います。
保存条件
0-5 °Cで保存して下さい。
必要なもの (キット以外)
- マイクロプレートリーダー(450 nmの吸光フィルター、発光測定に対応しているもの)
- 96 穴マイクロプレート
- 96穴白色マイクロプレート
- 接着細胞での実験を行う場合には細胞培養用のプレートを選択してください。
- 細胞播種後に細胞を観察したい場合やボトムリーディングで測定したい場合にはクリアボトムの白色プレートをご使用ください。
- 実績のある白色プレートについてはFAQをご参照ください。
- インキュベーター(37 °C)
- 20-200 μlのマルチチャンネルピペット
- 100-1000 μl、20-200 μl、2-20 μlマイクロピペット
- DMSO
- コニカルチューブ
使用上のご注意
- キットの中の試薬は、室温に戻してからご使用下さい。
- 輸送中の振動等により、内容物がスクリューキャップマイクロチューブ壁面やキャップ裏面に付着している場合がありますので、内容物を底面に落とした後に開封して下さい。
- LDH Solutionは酵素懸濁液です。静置しておくと酵素が沈殿しますので、ピペッティングにより均一な懸濁液にしてご使用下さい。
- 正確な測定値を得るために、1つの測定試料につき複数(n=3以上)のウェルをご使用下さい。
- Lactate Assay用のLactate working solutionをサンプルに加えると直ちに発色が始まります。各ウェル間のタイムラグによる測定誤差を少なくするためにマルチチャンネルピペットをご使用下さい。
- 本キットにはガラス製容器およびアルミ製シールキャップを使用しております。取扱いに際しては、保護手袋を着用して下さい。
溶液調製 (阻害剤)
Oligomycin stock solution (10 mmol/l)の調製
Oligomycin (黄キャップ)にDMSO 10 μlを加え、ピペッティングにより溶解する。
- 内容物が見えづらくなっています。DMSOを添加後、ピペッティングを数回繰り返し、ボルテックスなどでよく混合してからご使用下さい。
- Oligomycin stock solutionは冷凍保存(-20 oC)して下さい(2ヶ月間安定)。
溶液調製・測定法 (Lactate Assay)
Dye Mixture stock solutionの調製
Dye Mixtureのバイアル瓶にReconstitution Buffer (白キャップ)を全量加えて溶解する。
- Dye Mixture stock solutionはReconstitution Bufferが入っていた瓶に移し、遮光下、冷蔵保存(0-5 °C)して下さい(4ヶ月間安定)。
Lactate working solutionの調製
- コニカルチューブにDye Mixture stock solutionを加え、Lactate Assay Bufferで希釈する。
- 操作(1)で調製した溶液にLDH Solution (紫キャップ)を加える。
- Lactate working solution調製における各溶液使用量は、表1を参照して下さい。
- Lactate working solutionは光に不安定であるため、使用直前に調製し、調製後はアルミホイルで覆うなどして遮光して下さい。また、調製後のLactate working solutionは保存できません。
| 24 well分 | 48 well分 | |
| Dye Mixture stock solution | 250 μl | 500 μl |
| Lactate Assay Buffer | 2.25 ml | 4.5 ml |
| LDH Solution (紫キャップ) | 5 μl | 10 μl |
測定用サンプルの調製
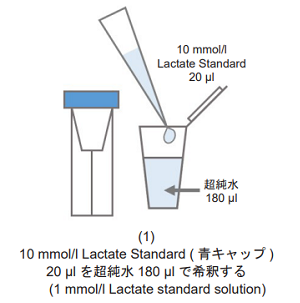
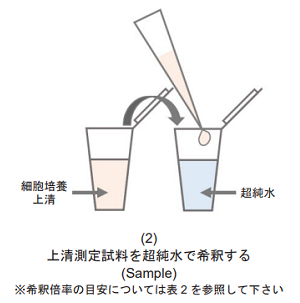
細胞培養上清測定試料を準備する。
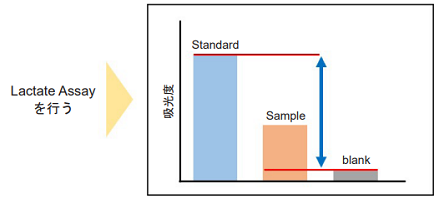
- 測定試料は、1 mmol/l Lactate standard solutionの吸光度の値よりも低くなるように、超純水で希釈したものを調製して下さい(図1参照)。
- 培地に血清を含む場合、バックグラウンドが高くなります。バックグラウンドコントロールとして、使用した血清入り培地のみの測定試料を準備することをお勧めします。
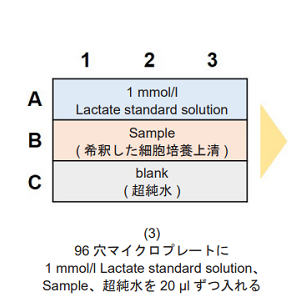
- 測定試料は1ウェルあたり20 μl必要です。
-
(4)
得られた吸光度の値を比較するStandardの吸光度の値よりも低く、blankの吸光度の値よりも高いかどうかを確認する
※直線性がある範囲はLactate濃度0-1 mmol/lです
図1 Lactate Assay 測定用サンプルの希釈倍率の決定法
| 阻害剤処理時間 | ||||
| 3 時間 | 5 時間 | 24 時間 | ||
| 24 穴プレート | HeLa, HepG2, A549 (5×104 cells/well) | 10 倍希釈 | 10 倍希釈 | 20 倍希釈 |
| WI-38 (5×104 cells/well) | 10 倍希釈 | 10 倍希釈 | 15 倍希釈 | |
| Jurkat (1×105 cells/well) | 10 倍希釈 | 10 倍希釈 | 15 倍希釈 | |
| 96 穴プレート | HeLa, HepG2, A549 (5×103 cells/well) | 10 倍希釈 | 15 倍希釈 | |
| WI-38 (5×103 cells/well) | 10 倍希釈 | 10 倍希釈 | ||
| Jurkat (1×104 cells/well) | 10 倍希釈 | 10 倍希釈 | ||
測定法

- 測定用サンプル20 μl を各ウェルに入れる。
- 正確な測定値を得るために、1 つの測定試料につき複数(n=3 以上) のウェルをご使用下さい。
- Lactate working solution 80 μl を各ウェルに入れる。
- Lactate working solution を加えると直ちに発色が始まります。各ウェル間のタイムラグを少なくするためにマルチチャンネルピペットをご使用下さい。
- 37 oC で30 分間インキュベートする。
- インキュベートする際は、溶液の揮発を防ぐため、マイクロプレート用シール等をご使用下さい。
- プレートリーダーを用いて450 nm の吸光度を測定する。
溶液調製・測定法 (ATP Assay)
ATP working solution の調製
- Substrate のバイアル瓶にATP Assay Buffer を1 ml 加える。
- Substrate のバイアル瓶の中は減圧になっております。開封する際に中身が飛び出る可能性がありますので、ゆっくりゴム栓を開けて下さい。
- ATP Assay Buffer を加えたバイアル瓶にゴム栓をして転倒混和し全てATP Assay Buffer の容器に戻す。
- Luciferase Solution ( 緑キャップ) 10 μl をATP Assay Buffer の容器に加え転倒混和する。
- ATP working solution 調製後は冷凍保存(-20 °C) して下さい(1 ヶ月間安定)。
測定法

- 96 穴白色マイクロプレートに細胞を準備する。
- 正確な測定値を得るために、1 つの測定試料につき複数(n=3 以上) のウェルをご使用下さい。
- ATP working solution 100 μl を各ウェルに入れる。
- 気泡は発光値に影響しますので、電動ピペットをご使用の際は気泡が生じにくいリバースピペットモードのご使用をお勧めします。
- ATP working solution 添加後、プレートシェーカー等で2 分間振盪することをお勧めします。光によって発光シグナルが不安定になりますので、光が差し込む場所で振盪する際は、アルミホイル等で遮光して下さい。
- ATP working solution を添加したプレートを25 °C に設定したプレートリーダーの中に入れ、10 分間インキュベートする。
- プレートリーダーで温度設定ができない場合は、遮光し25 °C のインキュベーターもしくは25 °C 付近の室温で10 分間インキュベートして下さい。
- 上記インキュベートは細胞から効率よくATP を抽出し、発光シグナルを安定させるために必要です。
- 発光量(RLU) を測定する。
操作① 解糖能の評価
評価の概要
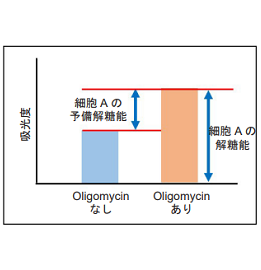
細胞をOligomycin で処理し酸化的リン酸化でのATP 合成を阻害した際に、もう一つのエネルギー生成経路である解糖系をどれだけ亢進させることができるかについて、Lactate 生成量を指標に評価します。
使用する試薬
| Dye Mixture ( 青キャップ) | ×1 | Lactate Assay に使用します |
| Lactate Standard (10 mmol/l) ( 青キャップ) | 150 μl×1 | |
| LDH Solution ( 紫キャップ) | 12 μl×1 | |
| Lactate Assay Buffer | 5.5 ml×1 | |
| Reconstitution Buffer ( 白キャップ) | 550 μl×1 | |
| Oligomycin ( 黄キャップ) | ×1 | 阻害剤として使用します |
Oligomycin 含有培地の調製
- 10 mmol/l Oligomycin stock solution を培地で1,000 倍希釈する(10 μmol/l Oligomycin solution)。
- 1 ml 調製する場合、10 mmol/l Oligomycin stock solution 1 μl を培地1 ml に加えて調製する。
- 操作(1) の溶液を培地でさらに8 倍希釈する(1.25 μmol/l Oligomycin solution)。
- 薬剤刺激を行う細胞を用いた評価を行う場合、Oligomycin 含有培地の調製に使用する培地にも刺激時と同濃度になるように薬剤を加えて下さい( 図2 参照)。
- 調製後のOligomycin 含有培地は保存できません。
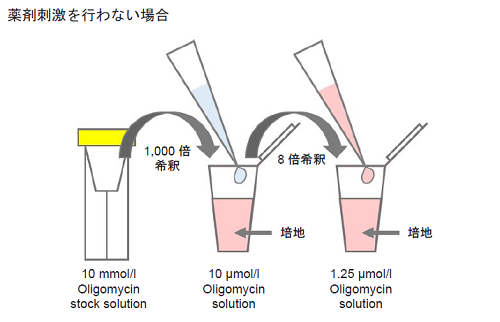
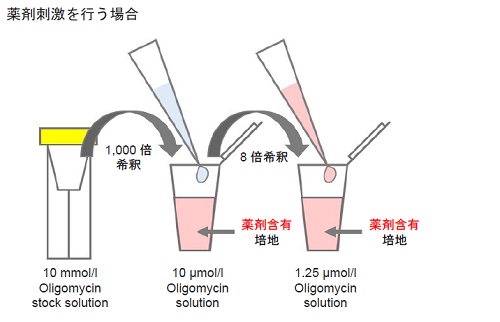
図2 Oligomycin 含有培地の調製法
実験操作
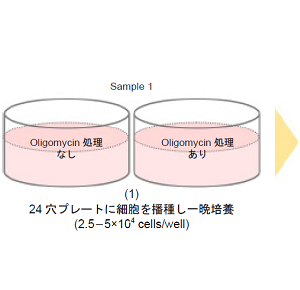
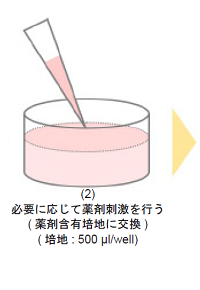
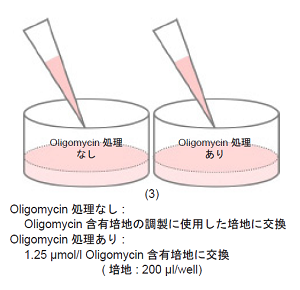

-
- 細胞(2.5-5×104 cells/well) を24 穴プレートに播種し、インキュベーター(37 °C、5% CO2 存在下) で一晩培養する。
- 1 サンプルにつき、Oligomycin 処理あり、Oligomycin 処理なしの2 ウェル分が必要です。
- 培地を吸引除去し、必要に応じて薬剤刺激を行う。
- 培地を吸引除去し、1.25 μmol/l Oligomycin 含有培地およびOligomycin 含有培地の調製に使用した培地のみを各ウェルに200 μl ずつ加え、インキュベーター(37 °C、5% CO2 存在下)で3-5 時間培養する。
- 1.5 ml マイクロチューブに細胞培養上清100 μl を回収し、Lactate Assay を行う。
- Lactate Assay を行う際のプレートレイアウトは図3 を参照して下さい。
- 得られた吸光度の値を比較する。
- 細胞(2.5-5×104 cells/well) を24 穴プレートに播種し、インキュベーター(37 °C、5% CO2 存在下) で一晩培養する。
-

図3 解糖能におけるプレートレイアウト例 (n=3)
実験例:解糖系阻害剤により解糖系を阻害したHeLa 細胞の解糖能評価
- HeLa 細胞(2.5×104 cells/well、10% fetal bovine serum、1% penicillin-streptomycin を含むMEM 培地) を24 穴プレートの4 ウェル分に播種し、インキュベーター(37 °C、5% CO2 存在下) で一晩培養した。
- 解糖系阻害剤処理用に2 ウェル、コントロール用に2 ウェル分を準備した。
- 培地を吸引除去し、2 ウェル分にはMEM 培地で希釈した解糖系阻害剤溶液500 μl を加え、残り2 ウェル分にはコントロールとしてMEM 培地のみを500 μl 加えた。
- インキュベーター(37 °C、5% CO2 存在下) で一晩培養した。
- 培地を吸引除去し、調製した1.25 μmol/l Oligomycin 含有培地200 μl をOligomycin 処理ありの各ウェルに加えた。
- Oligomycin 処理なしの各ウェルには、Oligomycin 含有培地の調製に使用した培地のみを200 μl 加えた。
- インキュベーター(37 °C、5% CO2 存在下) で3 時間培養した。
- 1.5 ml マイクロチューブに細胞培養上清100 μl 回収し、超純水で10 倍希釈したものを調製した。
- バックグラウンドコントロール用に、MEM 培地のみを超純水で10 倍希釈したものも調製した。
- 調製した測定試料を20 μl ずつ、96 穴マイクロプレートに入れた。
- 調製したLactate working solution 80 μl を各ウェルに加えた。
- 37 °C で30 分間インキュベートした。
- プレートリーダーを用いて450 nm の吸光度を測定し、得られた吸光度の値を比較した。
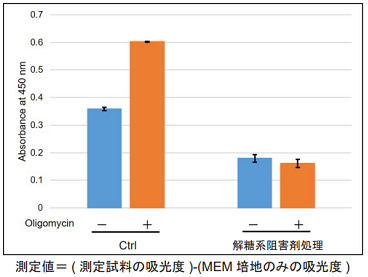
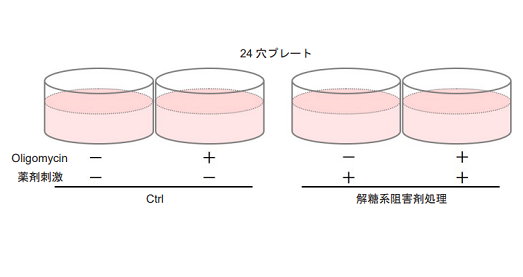
図4 解糖系阻害剤処理により解糖系を阻害したHeLa 細胞の解糖能の変化
Oligomycin で処理し酸化的リン酸化でのATP 合成を阻害した場合、Ctrl 細胞は解糖系を亢進させることが
可能であるが、解糖系阻害剤処理したHeLa 細胞は解糖系を亢進させることができないことを確認した。
操作② 代謝シフトの評価
評価の概要
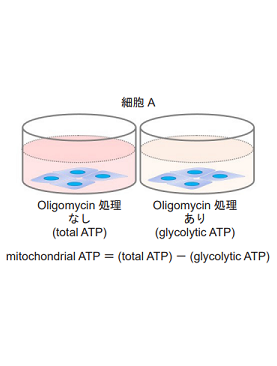
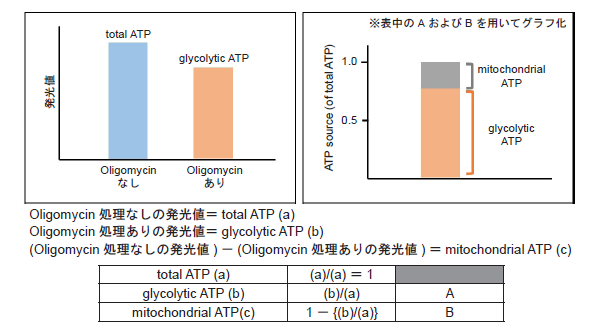
細胞をOligomycin で処理し酸化的リン酸化でのATP 合成を阻害した際のATP 量と、細胞の総ATP 量から、解糖系でのATP 生成量およびミトコンドリアでのATP 生成量を求め、これらを指標に細胞が代謝シフトしたかどうかを評価します。
使用する試薬
| Substrate ( 緑キャップ) | ×1 | ATP Assayに使用します |
| Luciferase Solution ( 緑キャップ ) | 10 μl×1 | |
| ATP Assay Buffer | 5.5 ml×1 | |
| Oligomycin ( 黄キャップ) | ×1 | 阻害剤として使用します |
Oligomycin 含有培地の調製
- 10 mmol/l Oligomycin stock solution を培地で1,000 倍希釈する(10 μmol/l Oligomycin solution)。
- 1 ml 調製する場合、10 mmol/l Oligomycin stock solution 1 μl を培地1 ml に加えて調製する。
- 操作1. の溶液を培地でさらに4 倍希釈する(2.5 μmol/l Oligomycin solution)。
- 操作2. の溶液を培地でさらに2 倍希釈する(1.25 μmol/l Oligomycin solution)。
- 薬剤刺激を行う細胞を用いた評価を行う場合、Oligomycin 含有培地の調製に使用する培地にも刺激時と同濃度になるように薬剤を加えて下さい( 図5 参照)。
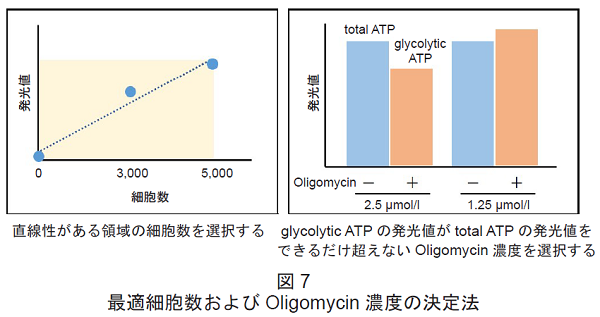
- 2.5 μmol/l あるいは1.25 μmol/l Oligomycin solution のどちらを実験に使用するかについては、予備実験を行い選択して下さい。
( 実験操作-予備実験( 細胞数およびOligomycin 濃度の最適化) -を参照)。 - 調製後のOligomycin 含有培地は保存できません。
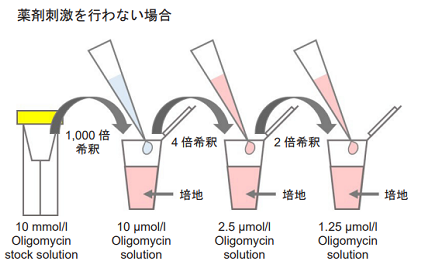
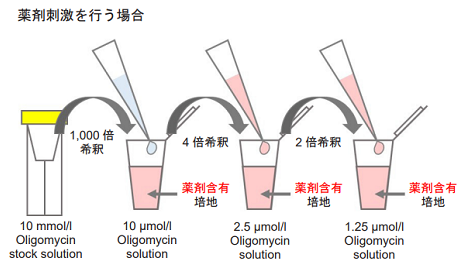
図5 Oligomycin 含有培地の調製法
実験操作
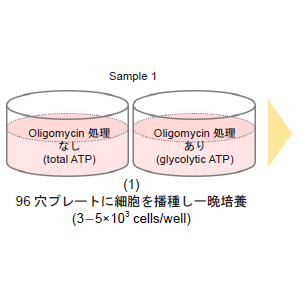
-予備実験 ( 細胞数およびOligomycin 濃度の最適化) -
- 細胞(3-5×103 cells/well) を96 穴白色マイクロプレートに播種し、インキュベーター(37 °C、5% CO2 存在下)で培養する。
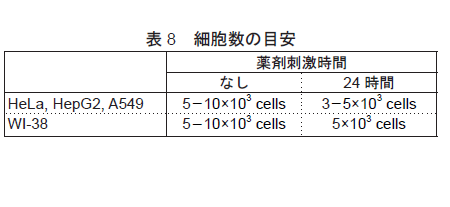
- 薬剤刺激の時間に応じて、播種する最適細胞数を調整して下さい( 表5 参照)。
- 予備実験を行う際のプレートレイアウトは図6 を参照して下さい。
- 培養時間は、薬剤刺激を行う時間も含めた時間に合わせて下さい。
例) 薬剤刺激時間が24 時間の場合、細胞播種後一晩培養し、さらに24 時間培養する。
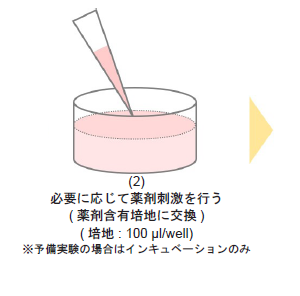
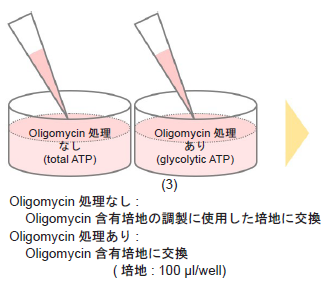
- 培地を吸引除去し、Oligomycin 含有培地およびOligomycin 含有培地の調製に使用した培地のみを各ウェルに100 μl ずつ加え、インキュベーター(37 °C、5% CO2 存在下) で1-3 時間培養する。
- インキュベート時間が1-3 時間では、得られる結果はほとんど同じです。
- ATP Assay を行う。
- 得られた発光値を比較する。
- 表6 および図7 を参考に最適細胞数およびOligomycin 濃度を選択して下さい。



-実験方法-
- 細胞(予備実験により選択した細胞数)を96穴白色マイクロプレートに播種し、インキュベーター(37 °C、5% CO2存在下)で一晩培養する。
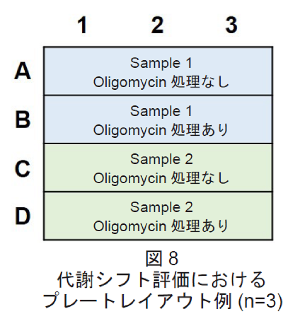
- プレートレイアウトは図8を参照して下さい。
- 培地を吸引除去し、必要に応じて薬剤刺激を行う。
- 培地を吸引除去し、予備実験により選択した濃度のOligomycin含有培地およびOligomycin含有培地の調製に使用した培地のみを各ウェルに100 μlずつ加え、インキュベーター(37 °C、5% CO2存在下)で1-3時間培養する。
- インキュベート時間が1-3時間では、得られる結果はほとんど同じです。
- ATP Assayを行う。
- 得られた発光値を比較する。
実験例:解糖系阻害剤により解糖系を阻害したHeLa細胞の代謝シフト評価
- HeLa細胞(5×103 cells/well、10% fetal bovine serum、1% penicillin-streptomycinを含むMEM培地)を96穴白色マイクロプレートに播種し、インキュベーター(37 °C、5% CO2存在下)で一晩培養した。
- 解糖系阻害剤処理用に6ウェル、コントロール用に6ウェル分を準備した。
- 培地を吸引除去し、6ウェル分にはMEM培地で希釈した解糖系阻害剤溶液100 μlを加え、残り6ウェル分にはコントロールとしてMEM培地のみを100 μl加えた。
- インキュベーター(37 °C、5% CO2存在下)で一晩培養した。
- 培地を吸引除去し、調製した1.25 μmol/l Oligomycin含有培地100 μlをOligomycin処理ありの6ウェル分に加えた。
- Oligomycin処理なしの6ウェル分には、Oligomycin含有培地の調製に使用した培地のみを100 μl加えた。
- インキュベーター(37 °C、5% CO2存在下)で3時間培養した。
- 調製したATP working solution 100 μlを各ウェルに加えた。
- プレートをプレートリーダーで2分間振盪した。
- プレートを25 °Cに設定したプレートリーダーの中に入れ、10分間インキュベートした。
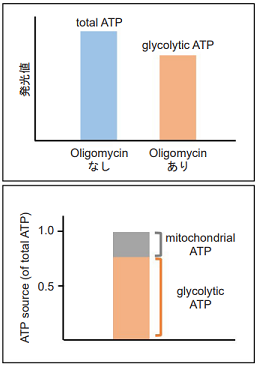
- 発光量(RLU)を測定し、得られた発光値よりtotal ATP、glycolytic ATP、mitochondrial ATPを求めた。
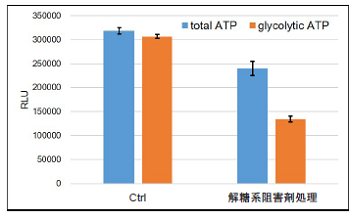
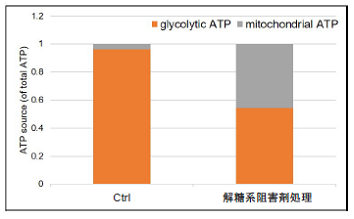
図9 解糖系阻害剤処理により解糖系を阻害したHeLa細胞の代謝シフト
解糖系阻害剤処理により、HeLa細胞は解糖系から酸化的リン酸化に代謝シフトすることを確認した。
操作③ 代謝経路依存性の評価
評価の概要
細胞をOligomycinで処理し酸化的リン酸化でのATP合成を阻害、また、2-DGで処理し解糖系でのATP合成を阻害した際のATP量とLactate生成量から、細胞が解糖系と酸化的リン酸化のどちらに大きく依存しているのかを評価します。
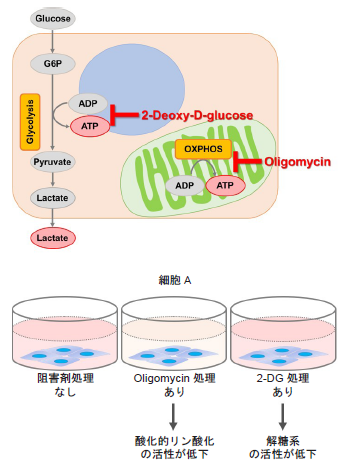
使用する試薬
| Dye Mixture (青キャップ) | ×1 | Lactate Assayに使用します |
| Lactate Standard (10 mmol/l) (青キャップ) | 150 μl×1 | |
| LDH Solution (紫キャップ) | 12 μl×1 | |
| Lactate Assay Buffer | 5.5 ml×1 | |
| Reconstitution Buffer (白キャップ) | 550 μl×1 | |
| Substrate (緑キャップ) | ×1 | ATP Assayに使用します |
| Luciferase Solution (緑キャップ) | 10 μl×1 | |
| ATP Assay Buffer | 5.5 ml×1 | |
| Oligomycin (黄キャップ) | ×1 | 阻害剤として使用します |
| 2-DG (赤キャップ) | 140 μl×1 |
Oligomycin含有培地の調製
- 10 mmol/l Oligomycin stock solutionを培地で1,000倍希釈する(10 μmol/l Oligomycin solution)。
- 1 ml調製する場合、10 mmol/l Oligomycin stock solution 1 μlを培地1 mlに加えて調製する。
- 操作1.の溶液を培地でさらに8倍希釈する(1.25 μmol/l Oligomycin solution)。
- 薬剤刺激を行う細胞を用いた評価を行う場合、Oligomycin含有培地の調製に使用する培地にも刺激時と同濃度になるように薬剤を加えて下さい(図10参照)。
- 調製後のOligomycin含有培地は保存できません。
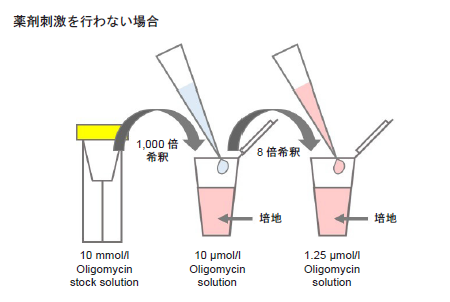
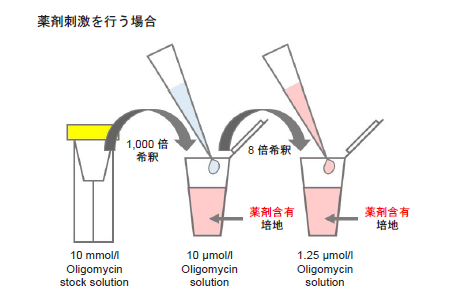
図10 Oligomycin含有培地の調製法
2-DG含有培地の調製
2-DG (赤キャップ)を培地で40倍希釈する(22.5 mmol/l 2-DG solution)。
- 1 ml調製する場合、2-DG 25 μlを培地975 μlに加えて調製する。
- 薬剤刺激を行う細胞を用いた評価を行う場合、2-DG含有培地の調製に使用する培地にも刺激時と同濃度になるように薬剤を加えて下さい(図11参照)。
- 調製後の2-DG含有培地は保存できません。
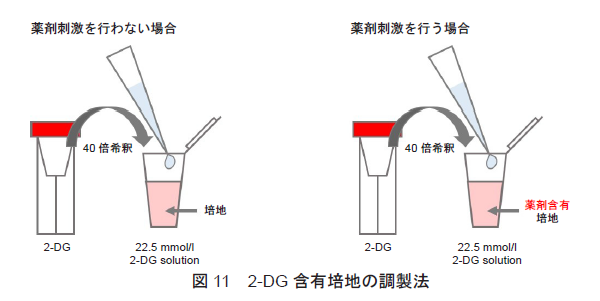
実験操作
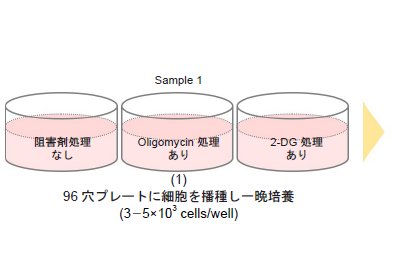
-予備実験 (細胞数の最適化)-
- 細胞(3-5×103 cells/well)を96穴白色マイクロプレートに播種し、インキュベーター(37 °C、5% CO2存在下)で一晩培養する。
- 薬剤刺激の時間に応じて、播種する最適細胞を調整して下さい(表8参照)。
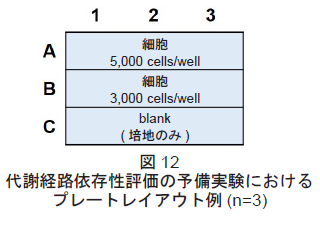
- 予備実験を行う際のプレートレイアウトは図12を参照して下さい。
- 培養時間は、薬剤刺激を行う時間も含めた時間に合わせて下さい。
例) 薬剤刺激時間が24時間の場合、細胞播種後一晩培養し、さらに24時間培養する。
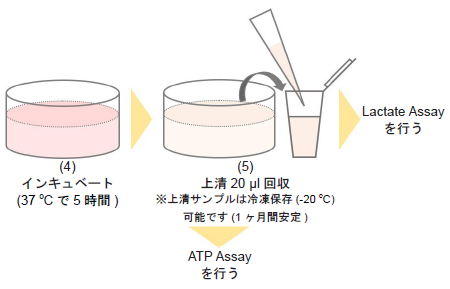
- 培地を吸引除去し、新しい培地のみを各ウェルに100 μlずつ加え、インキュベーター(37 °C、5% CO2存在下)で5時間培養する。
- ATP Assayを行う。
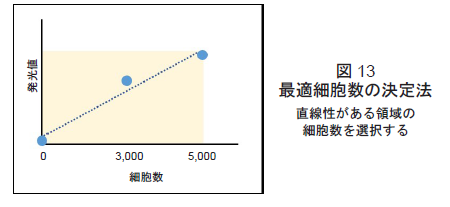
- 得られた発光値を比較し、最適細胞数を選択する(図13参照)。
-実験方法-
- 細胞(予備実験により選択した細胞数)を96穴白色マイクロプレートに播種し、インキュベーター(37 °C、5% CO2存在下)で一晩培養する。
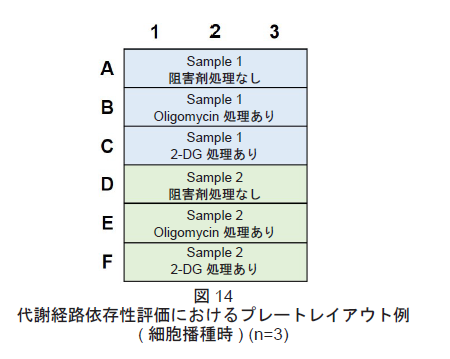
- プレートレイアウトは図14を参照して下さい。
- 培地を吸引除去し、必要に応じて薬剤刺激を行う。
- 培地を吸引除去し、Oligomycin含有培地、2-DG含有培地および阻害剤含有培地の調製に使用した培地のみを各ウェルに100 μlずつ加え、インキュベーター(37 °C、5% CO2存在下)で5時間培養する。
- 1.5 mlマイクロチューブに各ウェルから細胞培養上清20 μlを回収し、Lactate Assayを行う。
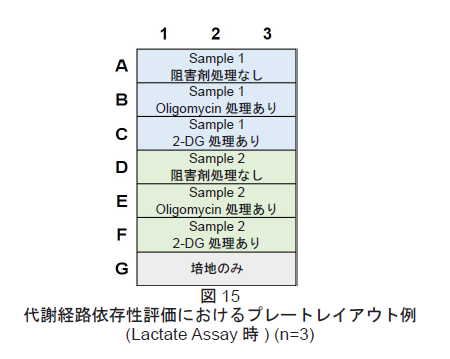
- Lactate Assayを行う際のプレートレイアウトは図15を参照して下さい。
- 96穴白色マイクロプレートに残った細胞をATP Assayに用いる。
- Lactate Assayにより得られた吸光度および、ATP Assayにより得られた発光値をそれぞれ比較する。
実験例:解糖系阻害剤により解糖系を阻害したHeLa細胞の代謝経路依存性評価
- HeLa細胞(3×103 cells/well、10% fetal bovine serum、1% penicillin-streptomycinを含むMEM培地)を96穴白色マイクロプレートに播種し、インキュベーター(37 °C、5% CO2存在下)で一晩培養した。
- 解糖系阻害剤処理用に9ウェル、コントロール用に9ウェル分を準備した。
- 培地を吸引除去し、9ウェル分にはMEM培地で希釈した解糖系阻害剤溶液100 μlを加え、残り9ウェル分にはコントロールとしてMEM培地のみを100 μl加えた。
- インキュベーター(37 °C、5% CO2存在下)で一晩培養した。
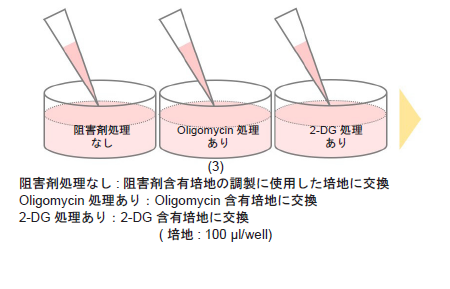
- 培地を吸引除去し、調製した1.25 μmol/l Oligomycin含有培地および22.5 mmol/l 2-DG含有培地をそれぞれ、Oligomycin処理ありおよび2-DG処理ありの各ウェルに100 μlずつ加えた。
- 阻害剤処理なしの各ウェルには、阻害剤含有培地の調製に使用した培地のみを100 μl加えた。
- インキュベーター(37 °C、5% CO2存在下)で5時間培養した。
- 1.5 mlマイクロチューブに各ウェルから細胞培養上清20 μlを回収し、超純水で10倍希釈したものを調製し、Lactate Assay用の測定試料とした。
- バックグラウンドコントロール用に、MEM培地のみを超純水で10倍希釈したものも調製した。
- 上清回収後の96穴白色マイクロプレートに、調製したATP working solution 100 μlを各ウェルに加えた。
- プレートをプレートリーダーで2分間振盪した。
- プレートを25 °Cに設定したプレートリーダーの中に入れ、10分間インキュベートした。
- 発光量(RLU)を測定し、得られた発光値を比較した。
- 操作(7)で調製した測定試料を20 μlずつ、新しい96穴マイクロプレートに入れた。
- 調製したLactate working solution 80 μlを各ウェルに加えた。
- 37 °Cで30分間インキュベートした。
- プレートリーダーを用いて450 nmの吸光度を測定し、得られた吸光度の値を比較した。
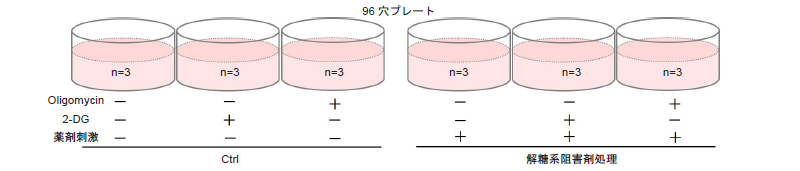
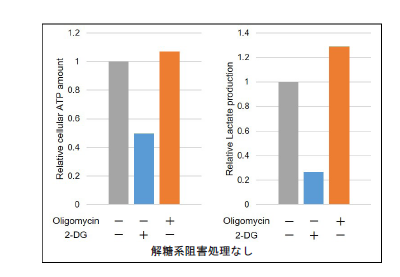
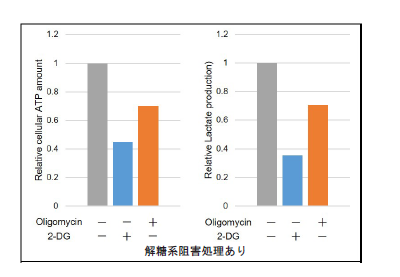
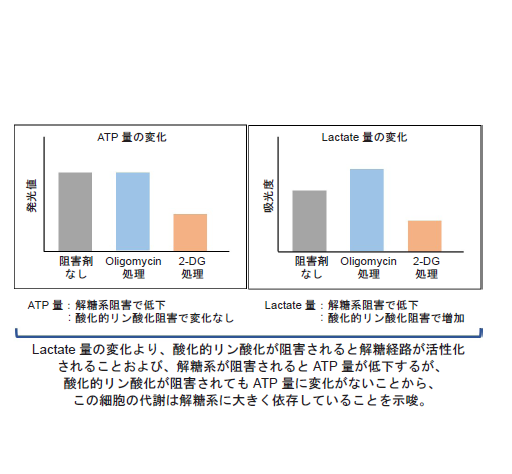
測定データはそれぞれ、Oligomycinおよび2-DG未処理の測定値でノーマライズした
図16 解糖系阻害剤処理によるHeLa細胞の代謝経路依存性の変化
解糖系阻害剤処理なしのHeLa細胞の代謝は解糖系に大きく依存しているが、
解糖系を阻害したHeLa細胞の代謝は酸化的リン酸化に依存するようになることを確認した。
参考文献
- R. Shiratori, et al., Sci. Rep., 2019, 9, 18699.
- J. Kim, et al., Cancer Cell, 2019, 35, 191-203.
- H. Kobayashi, et al., Nature. Chem. Bio., 2021, 17, 335-343.
よくある質問/参考文献
G270: Glycolysis/OXPHOS Assay Kit
Revised Apr., 04, 2024


 を押して省略できます。
を押して省略できます。