NAD/NADH Assay Kit-WST
NAD/NADH 測定キット
-
製品コードN509 NAD/NADH Assay Kit-WST
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 100 tests | ¥65,700 | 347-09321 |
| 100 tests | ・NAD/NADH Extraction Buffer ・NAD/NADH Control Buffer ・Standard Buffer ・Assay Buffer ・Dye Mixture ・Enzyme ・Standard ・Filtration Tube |
20 ml×1 20 ml×1 10 ml×1 5.5 ml×1 550 μl×1 x1 x1 x12 |
|---|
性質
NAD/NADH Assay Kit-WSTは、96ウェルプレートによる比色反応で細胞内の総NAD+/NADH量および、NAD+とNADHの比率を測定することができるキットです。本キットに含まれる抽出バッファーと除タンパク質用チューブを用いて簡便に培養細胞から測定サンプルを調整できます。
測定原理

マニュアル
技術情報
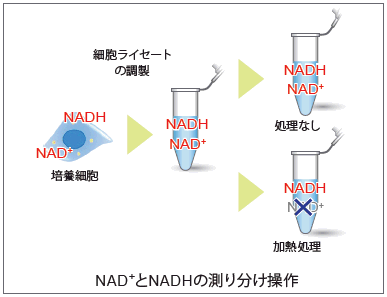
NAD+とNADHの測り分け操作
|
本キットに含まれる抽出バッファーと、除タンパク質用チューブを用いて簡便に培養細胞から細胞ライセートを調製できます。また細胞ライセートを加熱処理することで、細胞内 NADH量 のみを定量することができ、別途測定した総 NAD+/NADH 量からNADH 量を差し引くことで、細胞内 NAD+量を求めることができます。
本キットではn=3で12サンプルと標準サンプル8点の測定が可能です。12サンプル以上を使用する際には、別途フィルトレーションチューブをご準備頂く必要があります。 |
NAD+/NADH をマーカーとした研究
細胞内のNAD+とNADHの量は、薬剤投与や遺伝子組み換え等により影響を受けたガン細胞やミトコンドリア機能を理解する際の重要な代謝マーカーとして評価されています。最近では長寿に関わるサーチュインがNAD+量と深く関与していることが明らかとなっています。また肥満や糖尿病、細胞分化などの生物学的な状態を理解するためのマーカーとしても評価されるケースが増えています。

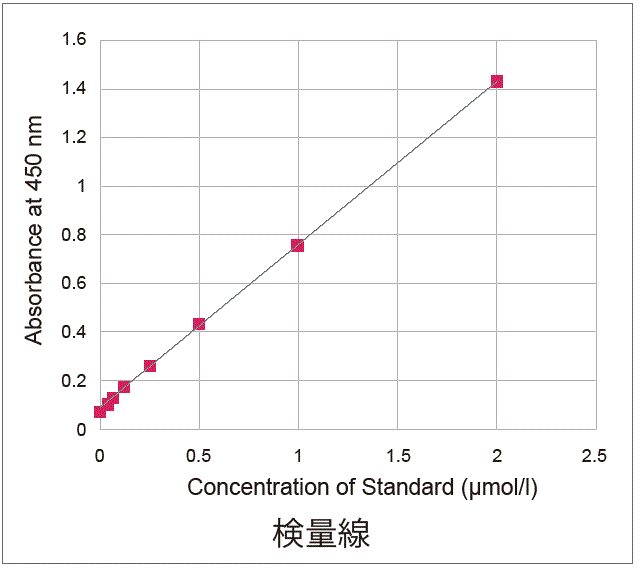
プレートアッセイで確かなデータ
本キット同梱の標準液を同時に測定することで、定量解析が行えます。サンプル中の総NAD+/NADH量が2 μmol/l より濃い濃度の場合は、サンプルを希釈することで評価できます。下記の実験では、細胞数が2倍異なるHeLa細胞を用いて、NAD+とNADHの量と比を求めました。
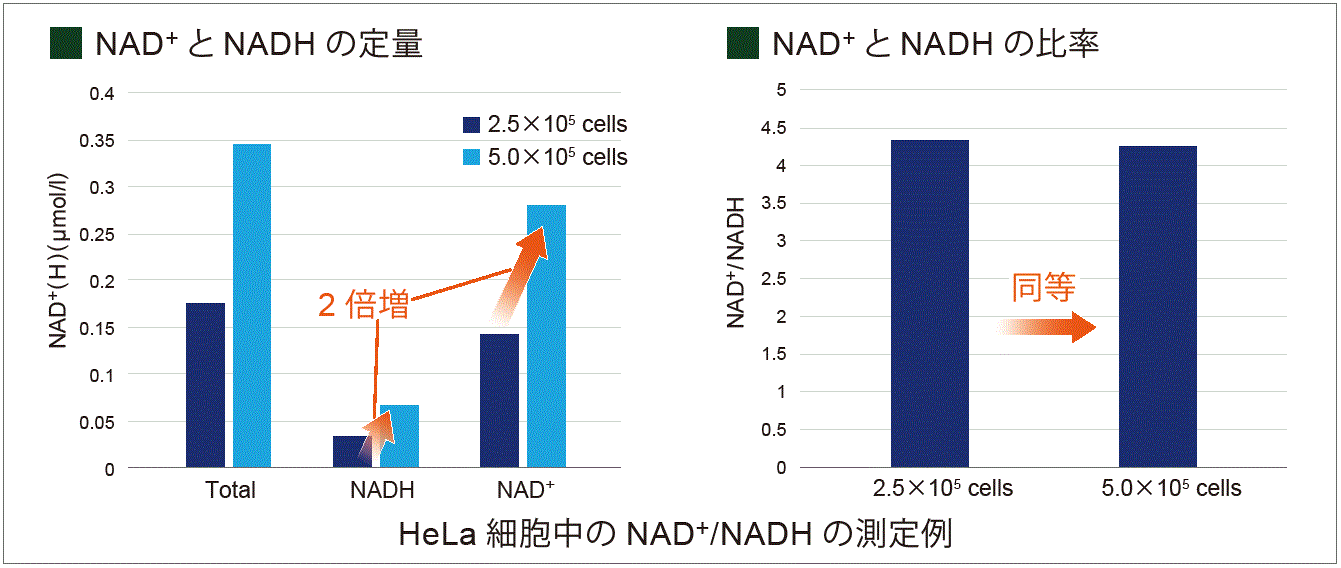
増殖培地にて培養したHeLa細胞(2.5×105、5.0×105 cells) を用い、細胞内のNAD+量とNADH量を検量線から求めました。結果、NAD+量とNADH量は細胞数に応じた変化がみられ、またNAD+とNADHの量比は細胞数に変化があっても同等結果となりました。
乳酸測定キットと組合せた測定例
解糖系の阻害剤である2-Deoxy-D-glucoseをHeLa 細胞に加えた際の代謝活性の変化を確認しました。
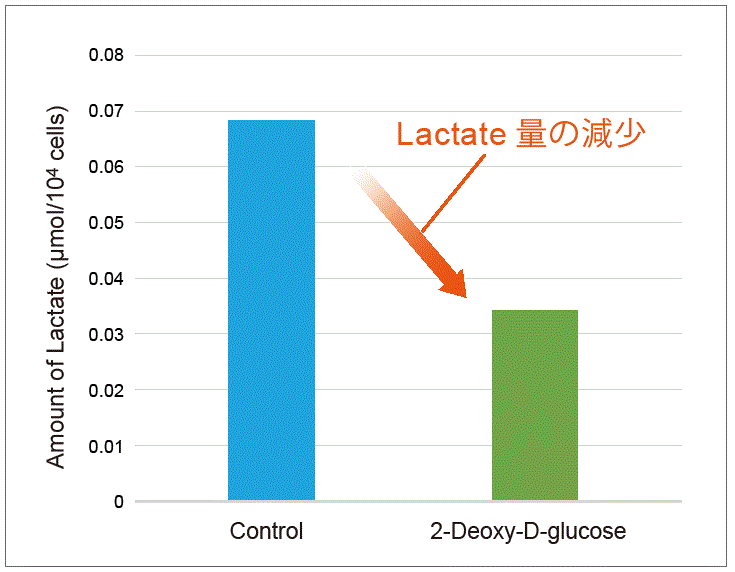
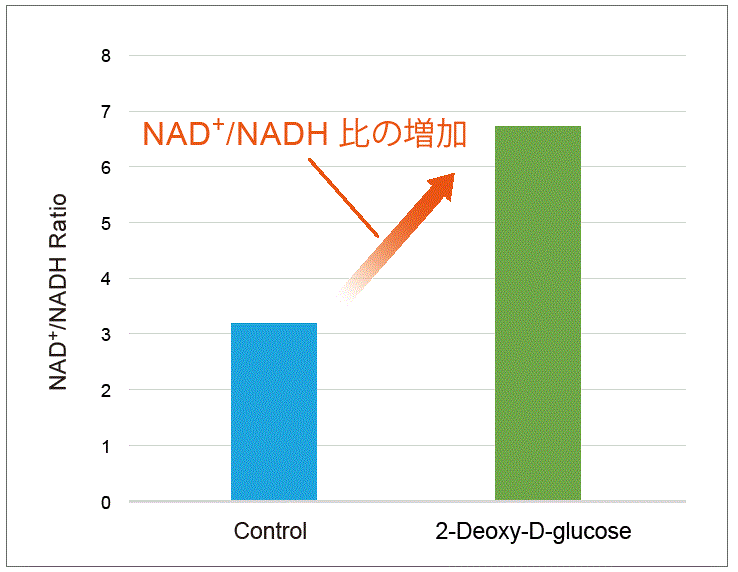
HeLa細胞(1×106 cells) に2-Deoxy-D-glucoseを最終濃度6 mmol/lになるよう添加し、24 時間培養後に乳酸量およびNAD+/NADH比を確認しました。乳酸測定は、培養上清を用いてLactate Assay Kit-WST(製品コード:L256)にて評価し、培養上清除去後の細胞を用いて本キットにてNAD+/NADH 比を評価しました。
結果、 2-Deoxy-D-glucose 添加により細胞内の解糖系が阻害されたことでLactate 量は減少し、NAD+/NADH 比は増加する結果が得られました。
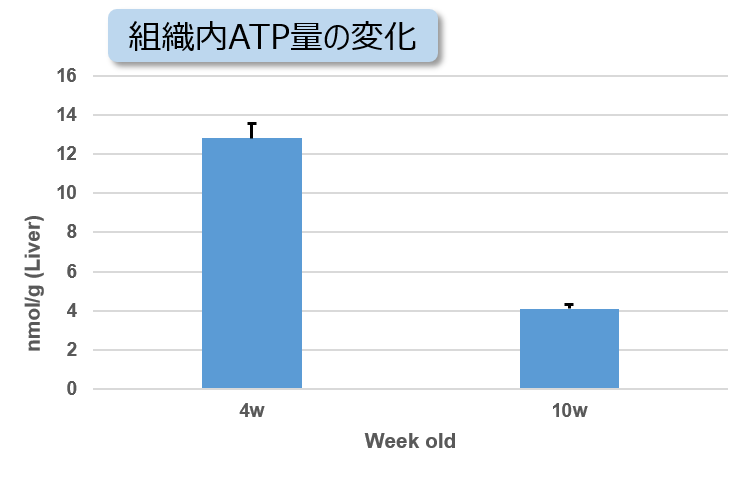
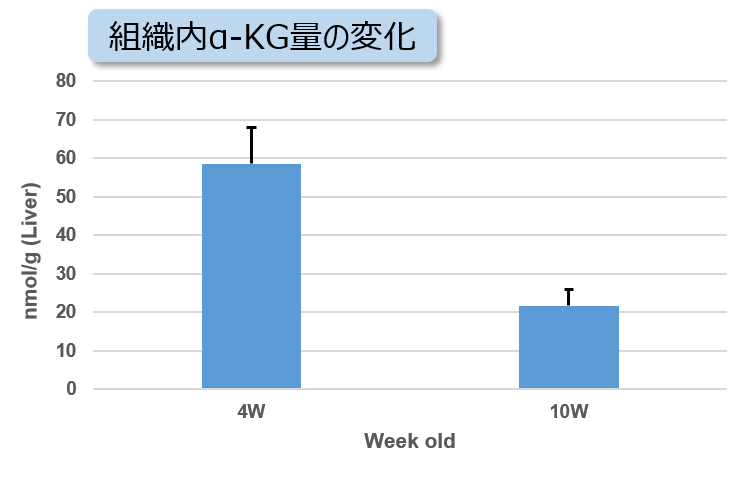
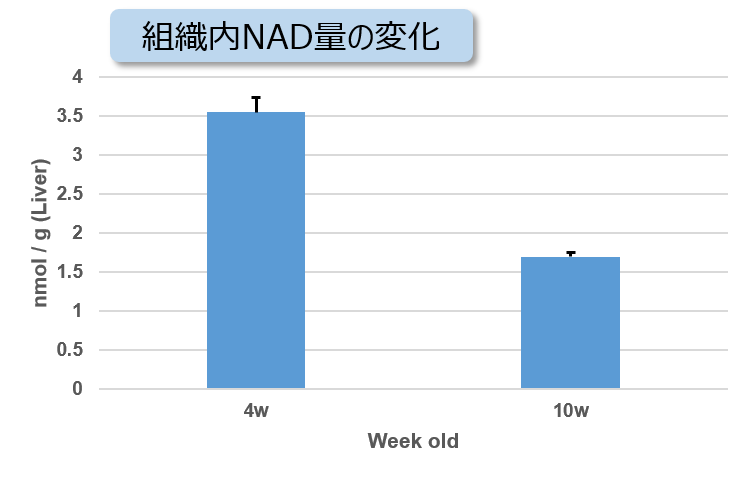
実験例:NASH誘導マウスの肝臓組織における代謝の変化
非アルコール性脂肪肝炎(NASH)の病変により組織中のATP、α-ケトグルタル酸(α-KG)、NAD量が減少することが知られています。4週齢から高脂肪食処理(NASH誘導)した1型糖尿病モデルマウス(STAMモデル)の肝臓組織を用い、組織内のATP、α-KG、NAD量を測定しました。
その結果、NASH誘導後10週齢のマウス組織ではATP、α-KG、NAD量が減少していることが確認されました。
※実験操作の詳細については「よくある質問:組織を用いた実験例はありますか?」をご参照ください。
<使用製品>
・組織内ATP :ATP Assay Kit-Luminescence (製品コード:A550)
・組織内α-KG:α-Ketoglutarate Assay Kit-Fluorometric (製品コード:K261)
・組織内NAD :NAD/NADH Assay Kit-WST (製品コード:N509)
<実験参考文献>
| ATP | Francesco Bellanti, et al., "Synergistic interaction of fatty acids and oxysterols impairs mitochondrial function and limits liver adaptation during nafld progression", Redox Biology, 2018, 15, 86-96. |
|---|---|
| α-KG | Jianjian Zhao, et al., "The mechanism and role of intracellular α-ketoglutarate reduction in hepatic stellate cell activation", Bioscience Reports, 2020, 40, (3). |
| Ali Canbay, et al., "L‑Ornithine L‑Aspartate (LOLA) as a Novel Approach for Therapy of Non‑alcoholic Fatty Liver Disease", Drugs, 2019, 79, 39-44. | |
| NAD | Jinhan He, et al., "Activation of the Aryl Hydrocarbon Receptor Sensitizes Mice to Nonalcoholic Steatohepatitis by Deactivating Mitochondrial Sirtuin Deacetylase Sirt3", Mol. and Cell. Biol., 2013, 33, (10), 2047-55. |
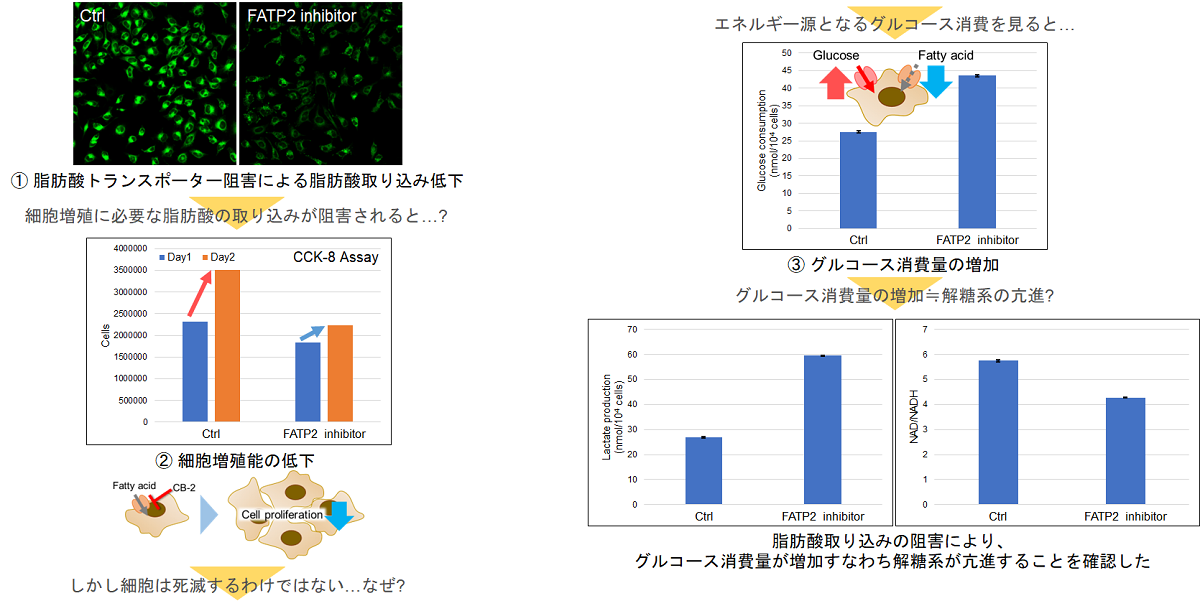
実験例:脂肪酸トランスポーター阻害剤によるHeLa細胞の細胞内代謝の変化
脂肪酸は膜の合成などに重要であり、細胞の増殖には欠かせません。そこで、HeLa細胞を脂肪酸トランスポーター阻害剤で処理し、脂肪酸取り込みを阻害した際の細胞増殖能および細胞内代謝(グルコース消費量、Lactate放出量、NAD/NADH比率)の変化を確認しました。
その結果、細胞増殖能の低下が認められましたが、グルコース消費量とLactate放出量が増加し、細胞内 NAD+/NADH 比率が低下したことから代謝経路が解糖系へシフトしたことが確認されました。
<使用製品>
脂肪酸取り込み:Fatty Acid Uptake Assay Kit (製品コード:UP07)
細胞増殖:Cell Counting Kit-8 (製品コード:CK04)
Glucose消費量:Glucose Assay Kit-WST (製品コード:G264)
Lactate放出量:Lactate Assay Kit-WST (製品コード:L256)
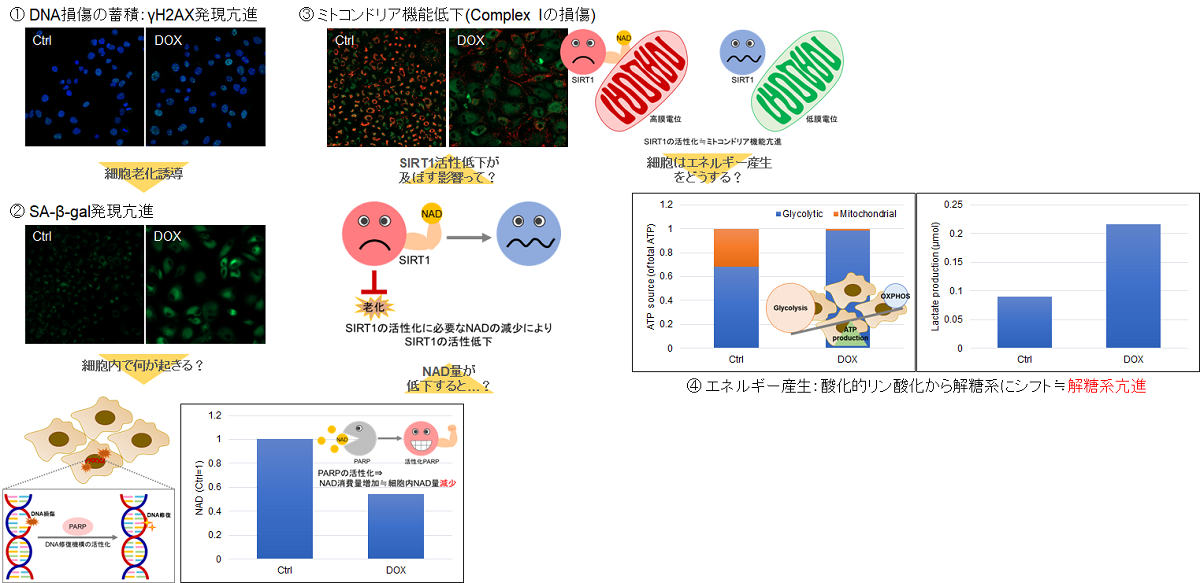
実験例:老化誘導によるA549細胞の代謝シフト
細胞老化が誘導されると、SA-β-galの発現亢進や不可逆的な細胞増殖停止といった現象が見られる他、DNAダメージが蓄積した老化細胞では、ミトコンドリア機能の低下によりエネルギー産生を解糖系にシフトします。そこで、A549細胞をDoxorubicinで処理し老化誘導した際のSA-β-gal発現亢進およびエネルギー産生経路(NAD量、ミトコンドリア膜電位、ATP量、Lactate放出量)のシフトを確認しました。
その結果、DNA損傷が認められましたが、SA-β-gal(Senescence Assosiated -β- Galactosidase)産生量が増加し、細胞内 NAD+ 量が低下したことからミトコンドリア膜電位が低下し、エネルギー生産経路が酸化的リン酸化から解糖系へシフトしたことが確認されました。
<使用製品>
DNAの損傷:DNA Damage Detection Kit - γH2AX (製品コード:G265)
SA-β-gal発現量:Cellular Senescence Detection Kit - SPiDER-βGal (製品コード:SG03)
NAD+量:NAD/NADH Assay Kit-WST (製品コード:N509)
ミトコンドリア膜電位:JC-1 MitoMP Detection Kit (製品コード:MT09)
代謝シフト(ATP量, Lactate放出量):Glycolysis/OXPHOS Assay Kit (製品コード:G270)
参考文献
| 文献No. | 対象サンプル | 引用(リンク) |
|---|---|---|
| 1) | オルガノイド (老齢マウス腸上皮オルガノイド) |
R. Uchida, Y. Saito, K. Nogami, Y. Kajiyama, Y. Suzuki, Y. Kawase, T. Nakaoka, T. Muramatsu, M. Kimura and H. Saito , "Epigenetic silencing of Lgr5 induces senescence of intestinal epithelial organoids during the process of aging", NPJ Aging Mech Dis., 2018,doi:10.1038/s41514-018-0031-5. |
| 2) | 細胞 (成人 T 細胞白血病細胞株) |
T. Kozako, A. Aikawa, T. Ohsugi, Y. Uchida, N. Kato, K. Sato, K. Ishitsuka, M. Yoshimitsu and S. Honda, "High expression of NAMPT in adult T-cell leukemia/lymphoma and anti-tumor activity of a NAMPT inhibitor', Eur. J. Pharmacol.., 2019, 865, 172738. |
| 3) | 細胞 (Sirt 7ノックアウト線維芽細胞) |
S. U. Sobuz, Y. Sato, T. Yoshizawa, F. Karim, K. Ono, T. Sawa, Y. Miyamoto, M. Oka and K. Yamagata, "SIRT7 regulates the nuclear export of NF-κB p65 by deacetylating Ran.', Biochim Biophys Acta Mol Cell Res.., 2019, 1866(9), 1355. |
| 4) | 細胞 (ヒトiPS由来神経細胞) |
K. Hayakawa, K. Nishitani and S. Tanaka, "Kynurenine, 3-OH-kynurenine, and anthranilate are nutrient metabolites that alter H3K4 trimethylation and H2AS40 O-GlcNAcylation at hypothalamus-related loci.", Sci Rep, 2019, 9(1), 19768. |
| 5) | 細胞 (HuH-7) |
M. Mikeli, M. Fujikawa, K. Nagahisa, S. Yasuda, N. Yamada and T. Tanabe, "Contribution of GPD2/mGPDH to an alternative respiratory chain of the mitochondrial energy metabolism and the stemness in CD133-positive HuH-7 cells.", Genes Cells, 2020, 25(2), 139. |
| 6) | 細胞 (HeLa) |
J.Thapaa, K. Hashimoto, S. Sugawara, R. Tsujikawa, T. Okubo, S. Nakamura and H.Yamaguchi, "Hypoxia promotes Chlamydia trachomatis L2/434/Bu growth in immortal human epithelial cells via activation of the PI3K-AKT pathway and maintenance of a balanced NAD+/NADH ratio", Microbes Infect., 2020, DOI:10.1016/j.micinf.2020.04.010. |
よくある質問
-
Q
1キットで測定可能なサンプル数は?
-
A
全てのサンプルをn:3で測定した際のサンプル数の目安は下記の通りです。
『NAD+とNADHの総量』
または『NADH量』の何れかを測定する場合『NAD+とNADHの総量』
および『NADH量』の両方を測定する場合サンプル数 24サンプル 12サンプル ※標準サンプルを2 μmol/Lから段階希釈し、計8点(n:3)で検量線を1回作成した際に測定可能な実サンプル数を記載。
測定を2回に分けて行う場合は、別途検量線を作成する必要があるため上記サンプル数よりも少なくなります。
-
Q
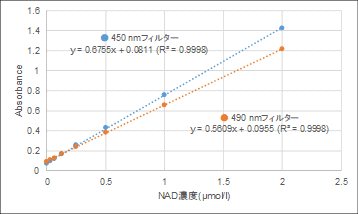
450 nm以外の吸収フィルターで測定できますか?
-
A
450 nm以外では、490 nmのフィルターでの使用が可能です。
ただし、吸光度値は450 nmで測定した場合と比較し低くなります。
それぞれの吸収フィルターで測定した時の検量線は下記の通りです。
-
Q
Filtration Tube(除タンパク質用)は別途購入できますか?
-
A
ご不便おかけしますが、Filtration Tubeのみの販売は行っておりません。
小社にて実績のある市販の除タンパク質用チューブをご紹介いたします。
製造メーカー:Pall Corporation
製品名:ナノセップ遠心ろ過デバイス (分画分子量:10K、色:ブルー)
-
Q
Working solutionはどのくらい安定ですか?
-
A
Working solutionは保存できません。用時調製して下さい。また、光に対して不安定なため
溶液調製後は遮光して下さい。遮光、室温で4時間安定です。
-
Q
サンプルが発色しない原因はありますか?
-
A
測定試料中に含まれているNAD量が、本キットで定量可能な濃度以下となっている可能性があります。
その場合は細胞数を増やして頂くか、測定試料を希釈している場合は、希釈倍率を下げて測定して下さい。
-
Q
組織を用いた実験例はありますか?
-
A
マウス肝臓組織を用いてNAD/NADHおよびATPを測定した事例がございます。
実験操作の詳細は下記をご参照ください。アルカリ抽出法による肝臓サンプルからの代謝指標の抽出
1. マウス肝臓100 mgあたり500 µlの冷えた0.5 mol/l KOH水溶液を入れる。
*使用する組織は必ず灌流操作等で十分に脱血してください。血液の残存は測定に影響を与えます。
2. ダウンス型ホモジナイザーで組織を破砕する。
*氷浴上で行ってください。
3. サンプルを回収し、サンプルチューブに移す。破砕に使用した容器を500 µlの冷えた0.5 mol/l KOH水溶液で共洗いし、チューブ内のサンプルと合わせる。(全量 1 ml)
4. 冷えた超純水 1 mlをサンプルチューブに加え、よく混合し氷上で5分間静置する。(全量 2 ml)
*溶液の粘性が高いと、次操作の遠心後の分離が困難になる場合があります。その際は、シリンジに25 G(針のゲージ数)程度の細い針を付け、サンプル溶液をシリンジでスムーズに出し入れができるまで(20-30回)混合してください。
5. 12,000 x g , 4℃で5分間遠心し、上清を900 µlずつ二つのサンプルチューブに回収する。
*1本をNAD/NADH測定、もう1本をATP測定に使用。NAD/NADHのみを測定する場合は900 μlx1本のみで構いません。
NAD/NADH測定用サンプルの調製
*取扱説明書の1. 測定用サンプルの調製の(5)から行う。
*希釈用溶液として0.5 mol/l KOH水溶液と1 mol/l KH2PO4水溶液を9:5の比率で混合したものを準備しておく。6. 上記5. で調製したサンプルのうち450 µlをMWCO 10Kフィルトレーションチューブに移し、 15,000 x gで20分間遠心する。
*遠心後の溶液が200 µl以上ない場合は遠心時間を延長してください。
7. 得られた濾液を、1.5 ml マイクロチューブ2 本に100 μl ずつ移し、総NAD+/NADH 量およびNADH 量測定試料とする。
8. NADH 量測定試料を60 ℃ で60 分間インキュベートし、測定サンプルを室温まで冷却する。
9. 調製後の総NAD+/NADH 量およびNADH 量測定試料が入ったチューブそれぞれに、22 µlの1 mol/l KH2PO4水溶液を入れて中和後、78 µlの希釈用溶液(KOHとKH2PO4の混合溶液)を加えてよく混合し、測定用サンプルとする(total 200 µl)。
<測定時の注意点>
*操作5、7で得たサンプルは保存できません。その日のうちに測定してください。
*スタンダード、サンプルの希釈には希釈用溶液として0.5 mol/l KOH水溶液と1 mol/l KH2PO4水溶液を9:5の比率で混合したものを使用してください。
<測定例>
NASH誘導マウス肝臓組織におけるNAD量の変化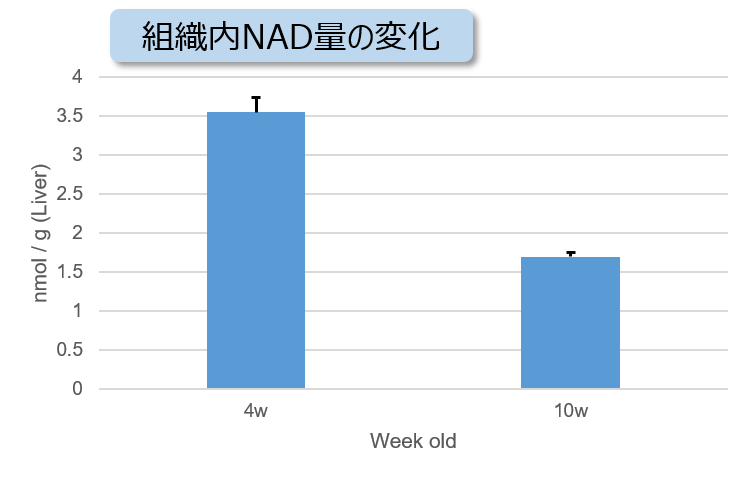
-
Q
測定試料は保存できますか?
-
A
保存できます。取扱説明書 [1.測定用サンプルの調製]の操作6)の溶液は、冷凍(-20℃)で3週間保存可能であることを確認しております。
-
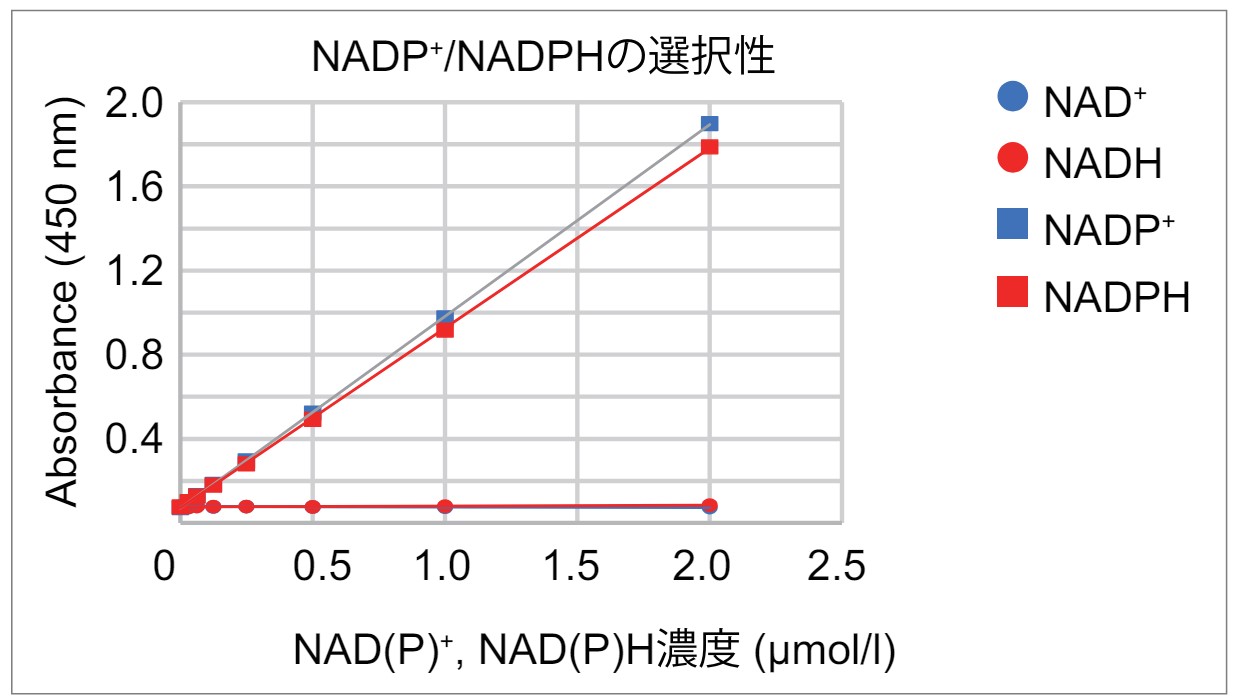
Q
NADP+, NADPHと反応しますか?
-
A
NAD/NADH Assay Kit-WSTとNADP+, NADPHは反応しないことを確認しております。
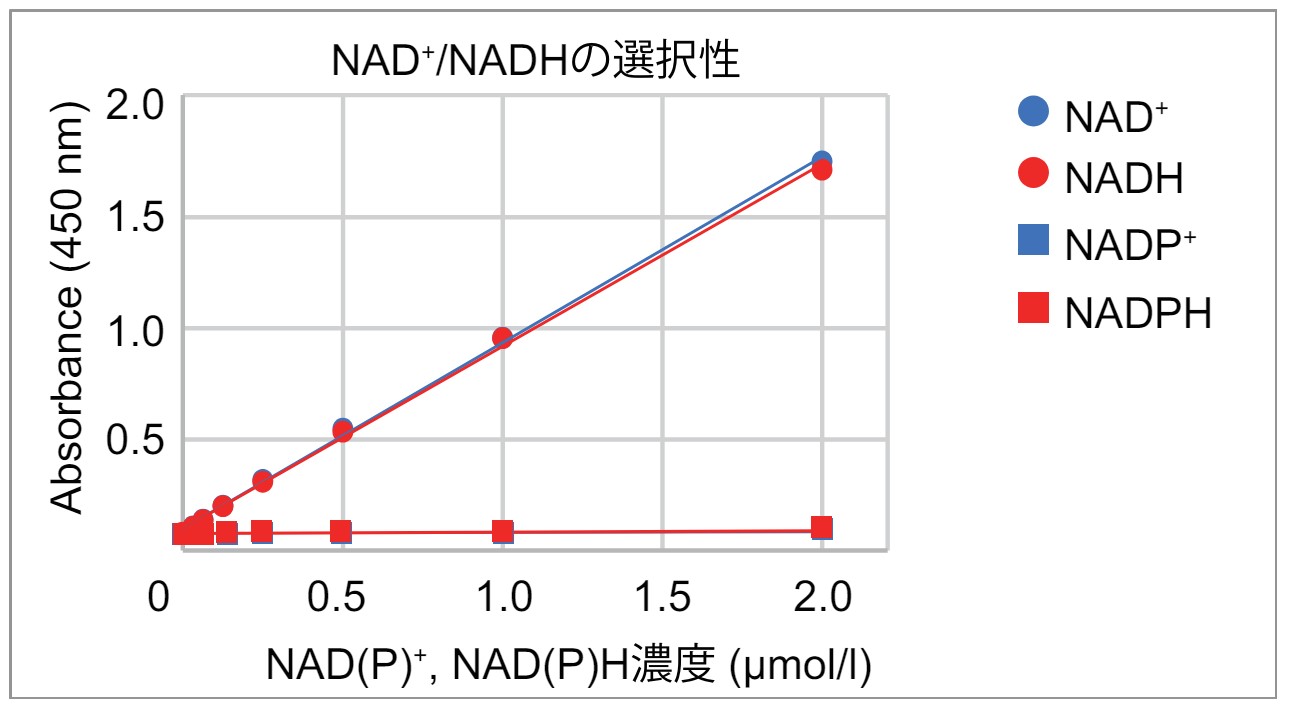
また、関連製品NADP/NADPH Assay Kit-WSTにおきましては、NAD+, NADHと反応しないことを確認しております。
取扱条件
| 保存条件: 冷蔵,遮光 , 取扱条件: 吸湿注意 | |
|
危険・有害 シンボルマーク |
 
|
|---|---|