Glucose Assay Kit-WST
グルコース測定キット
- 細胞培養上清のグルコースを測定可能
- マイクロプレートを使った多検体処理が可能
-
製品コードG264 Glucose Assay Kit-WST
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 50 tests | ¥21,300 | 342-09413 |
| 200 tests | ¥44,800 | 346-09411 |
| 50 tests | ・Dye Mixture ・Glucose Standard ・Enzyme ・Assay Buffer ・Reconstitution Buffer |
×1 150 μl×1 ×1 3.5 ml×1 350 μl×1 |
|---|---|---|
| 200 tests | ・Dye Mixture ・Glucose Standard ・Enzyme ・Assay Buffer ・Reconstitution Buffer |
×1 600 μl×1 ×1 14 ml×1 1.4 ml×1 |
性 質
Glucose Assay Kit-WST は、エネルギー代謝基質であるグルコースを測定(下限値: 0.02 mmol/l )することができます。 96 ウェルマイクロプレートに対応しているため多検体測定が可能です。
グルコースは、生体のエネルギー源として最も重要な物質であり、主要なエネルギー代謝指標の1つです。近年では糖尿病や肥満研究における糖代謝の指標としてだけでなく、がん研究においても、細胞内代謝の変化を確認するための指標として、乳酸と一緒によく測定されています。
マニュアル
技術情報
グルコースの検出原理
本キットは、グルコース量に応じ発色したWSTホルマザンを吸光度測定することで、細胞培養上清*のグルコースを検出することができます。またキットにはグルコース標準液が含まれており、標準曲線を作成しサンプル中のグルコース濃度を測定することができます。
.gif)
*細胞培養上清以外のサンプルについては、よくある質問 培養上清以外で実績のあるサンプルを教えてください。をご参照ください。
測定操作
細胞培養液をプレートに添加し、試薬を加えてインキュベートするだけの簡単操作です。


.gif)
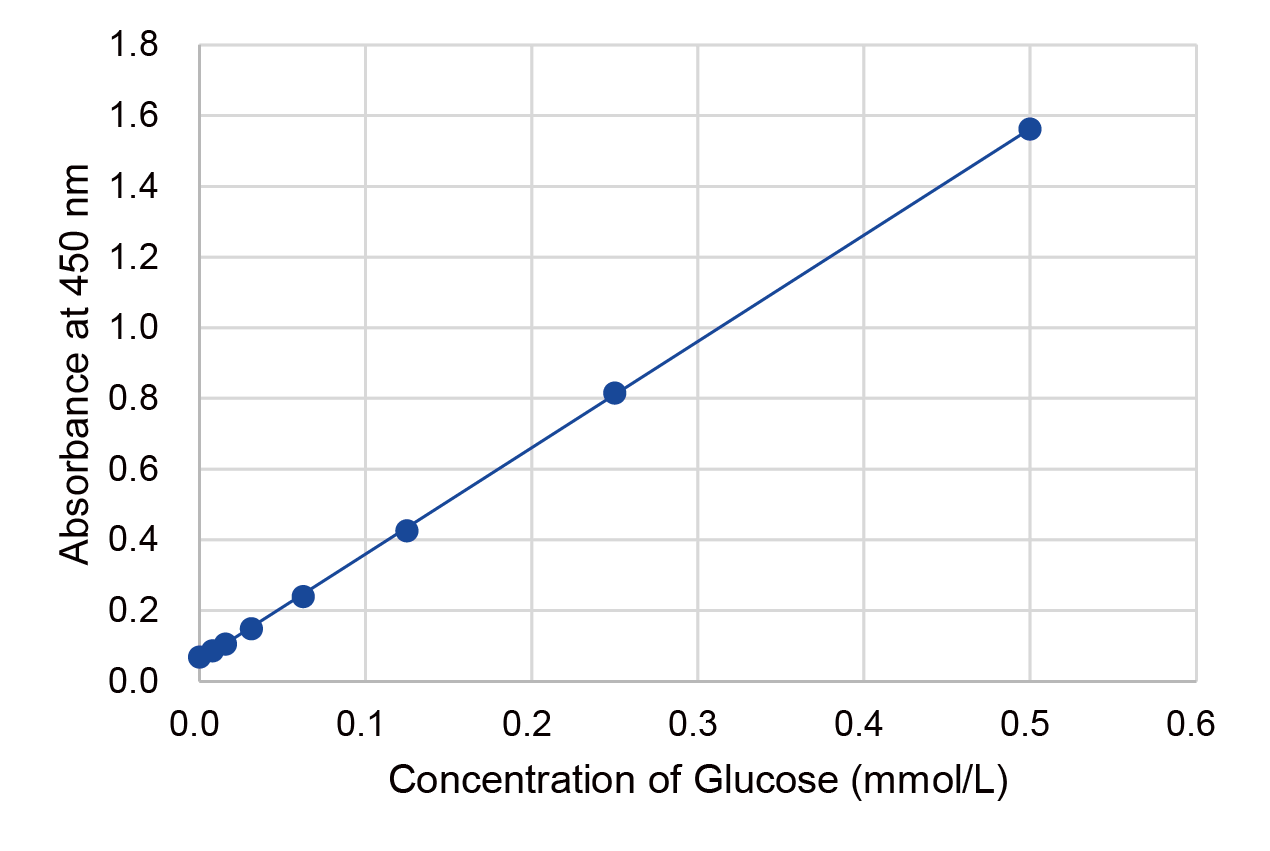
検量線の作成例
本キットのGlucose Standardを用い作成した検量線からサンプル中のグルコース濃度を求めることができます。グルコース濃度が0.5 mmol/l以上の場合は、サンプルを希釈することで評価いただけます。
グルコース及び乳酸の測定例
グルコーストランスポーター阻害剤である Phloretin をJurkat 細胞に加えた際の代謝活性の変化をGlucose Assay Kit-WST 及びLactate Assay Kit-WST にて確認しました。
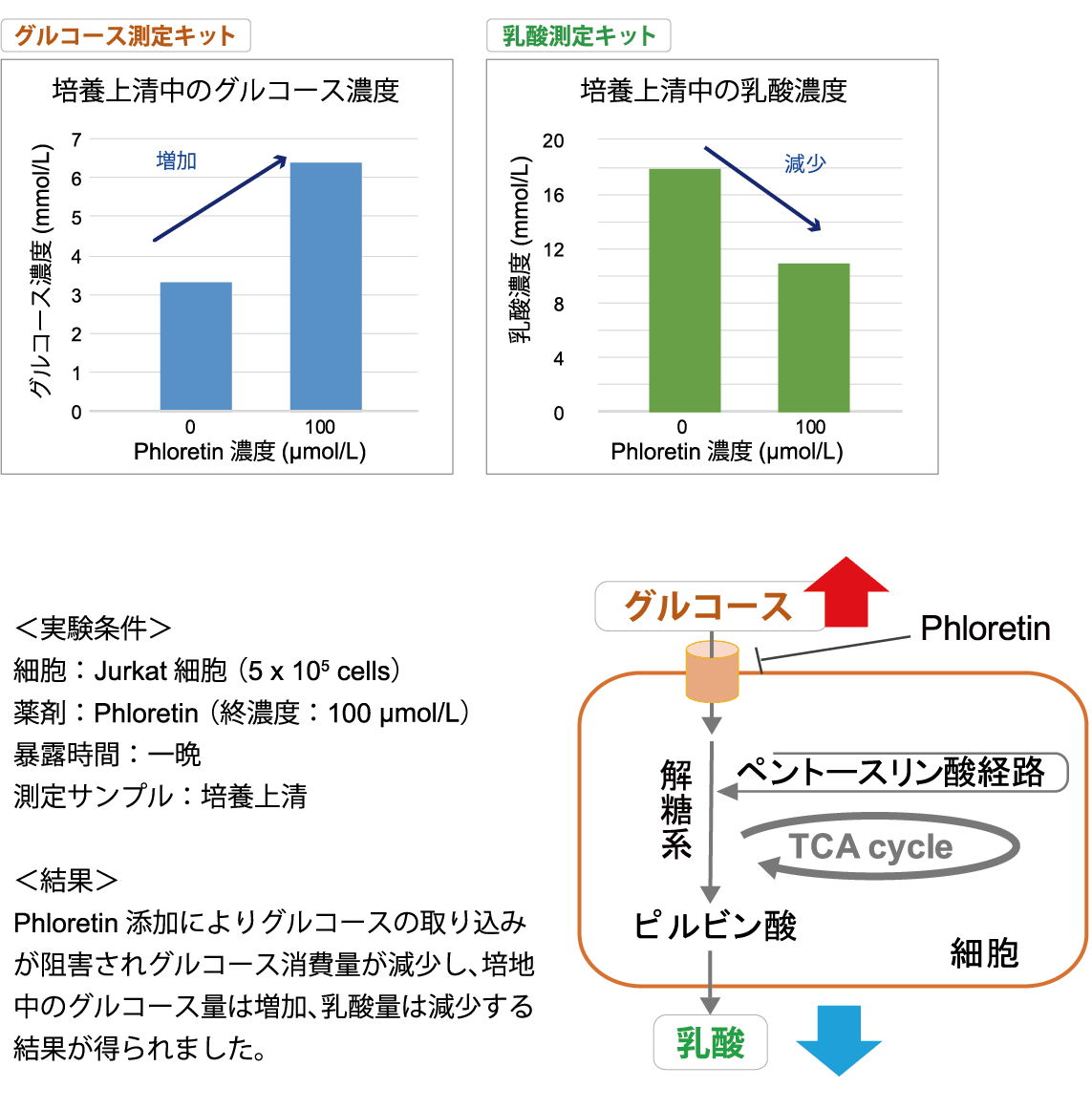
技術や使用製品に関する補足
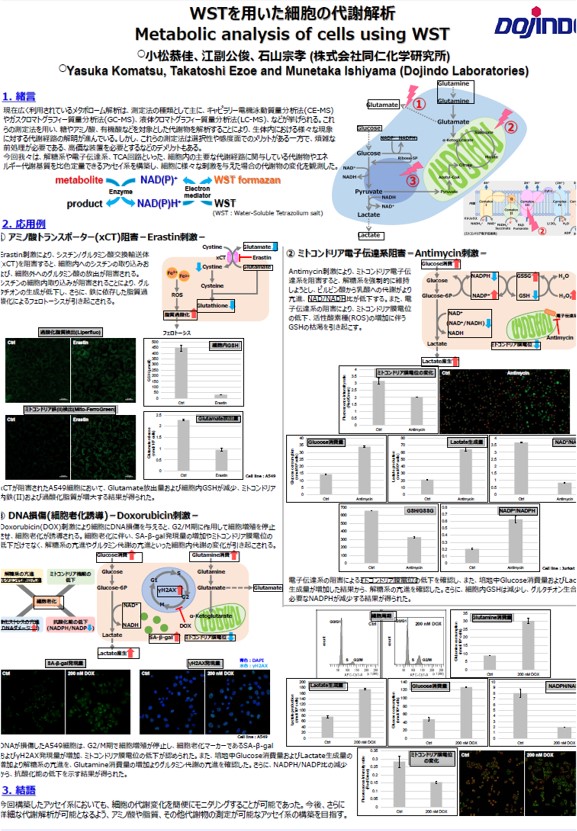
本キット使用時の注意点:細胞数の補正をお勧めします。
マイクロプレートを用いた細胞の解析では、得られる結果がウェル中の細胞数によって変化する場合があります。その際には、細胞数のカウントやトータルタンパク質量の確認により、得られた測定値の補正(ノーマライゼーション)が必要となります。本キットでは、試薬を細胞培養液に添加するだけで、細胞内の核を染色し得られる蛍光強度から、細胞数を簡便に評価することができます。
細胞数ノーマライゼーションキットはこちらから
実験例:脂肪酸トランスポーター阻害剤によるHeLa細胞の細胞内代謝の変化
脂肪酸は膜の合成などに重要であり、細胞の増殖には欠かせません。そこで、HeLa細胞を脂肪酸トランスポーター阻害剤で処理し、脂肪酸取り込みを阻害した際の細胞増殖能および細胞内代謝(グルコース消費量、Lactate放出量、NAD/NADH比率)の変化を確認しました。
その結果、細胞増殖能の低下が認められましたが、グルコース消費量とLactate放出量が増加し、細胞内 NAD+/NADH 比率が低下したことから代謝経路が解糖系へシフトしたことが確認されました。
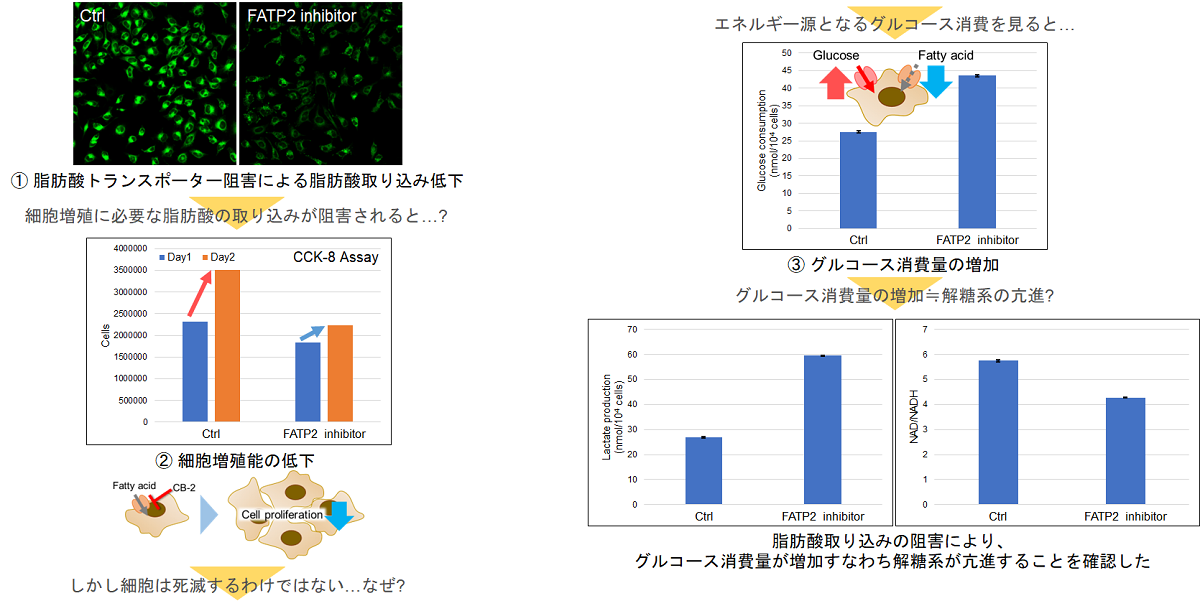
<使用製品>
脂肪酸取り込み:Fatty Acid Uptake Assay Kit (製品コード:UP07)
細胞増殖:Cell Counting Kit-8 (製品コード:CK04)
Lactate放出量:Lactate Assay Kit-WST (製品コード:L256)
細胞内NAD/NADH比率:NAD/NADH Assay Kit-WST (製品コード:N509)
参考文献
| 文献No. | 対象サンプル | 引用(リンク) |
|---|---|---|
| 1) | 血清 (マウス) |
M. Shinohara, Y. Tashiro, M. Shinohara, J. Hirokawa, K. Suzuki, M. O. Takeya, M. Mukouzono, S. Takeda, T. Saito, A. Fukumori, T. C. Saido, R. Morishita and N. Sato, "Increased levels of Aβ42 decrease the lifespan of ob/ob mice with dysregulation of microglia and astrocytes”, FASEB J., 2019,DOI: 10.1096/fj.201901028RR |
| 2) | 微生物 (Streptomyces albulus ) |
K. Yamanaka, Y. Hamano and T. Oikawa, "Enhancement of metabolic flux toward ε-poly-l-lysine biosynthesis by targeted inactivation of concomitant polyene macrolide biosynthesis in Streptomyces albulus.”, J. Biosci. Bioeng., 2020,DOI: 10.1016/j.jbiosc.2019.12.002 |
| 3) | 細胞 (HCT116) |
K. Ohshima, S. Nojima, S. Tahara, M. Kurashige, K. Kawasaki, Y. Hori, M. Taniguchi, Y. Umakoshi, D. Okuzaki, N. Wada, J. Ikeda, E. Fukusaki and E. Morii, "Serine racemase enhances growth of colorectal cancer by producing pyruvate from serine”, Nat Metab, 2020, 2(1), 81 |
| 4) | 細胞 (P388白血病) |
T. Matsuo, Y. Konya, E. Hirayama and Y. Sadzuka , "2-Deoxy-D-glucose enhances the anti-cancer effects of idarubicin on idarubicin-resistant P388 leukemia cells”, Oncol Lett , 2020, 20(1), 962-966 |
| 5) | 細胞 (マウス:精子) |
M. Hashimoto, S. Kimura, C. Kanno, Y. Yanagawa, T. Watanabe, J. Okabe, E. Takahashi, M. Nagano and H. Kitamura, "Macrophage ubiquitin‑specific protease 2 contributes to motility, hyperactivation, capacitation, and in vitro fertilization activity of mouse sperm”, Cellular and Molecular Life Sciences, 2020, doi: 10.1007/s00018-020-03683-9 |
| 6) | 細胞 (マクロファージ) |
N. Saeki and Y. Imai, "Reprogramming of synovial macrophage metabolism by synovial fbroblasts under infammatory conditions ”, Cell Commun Signal, 2020, 18, 188 |
*細胞培養上清以外のサンプルについては、よくある質問 細胞培養上清以外で実績のあるサンプルを教えてください。をご確認ください。
よくある質問
-
Q
測定可能なサンプル数を教えて下さい。
-
A
検量線の作成およびサンプルの測定をそれぞれn=3で行った場合、下記表に記載のサンプル数を測定頂けます。
※検量線作成:8点(0, 0.00785, 0.0157, 0.0313, 0.0625, 0.125, 0.25, 0.5 mmol/l)をn=3で評価。
Glucose standard solutionとサンプルのレイアウト例(n=3)
-
Q
450 nm以外の吸収フィルターで測定できますか?
-
A
490 nmのフィルターでも使用できます。
ただし、吸光度の値は450 nmで測定した場合よりも低くなります。
-
Q
細胞培養上清以外で実績のあるサンプルを教えてください。
-
A
細胞内のグルコースを測定した実績がございます。
操作の詳細は、よくある質問「細胞内グルコース測定はできますか?」をご参照ください。
その他のサンプルについては実績がございません。
-
Q
細胞内のグルコース測定はできますか?
-
A
細胞内グルコース測定は可能です。
「0.1% Triton X-100 水溶液」と「限外ろ過膜フィルター(分画分子量:10K)」が必要です。
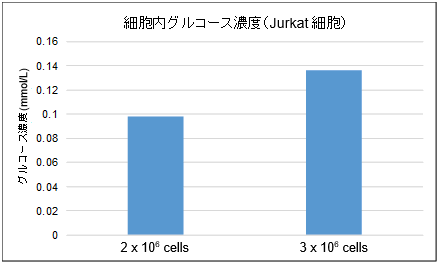
下記のサンプル調製手順を参照ください。(1) 細胞*1を1.5 mlマイクロチューブに回収する。
※測定に必要な細胞数は、細胞種により検討が必要です。HepG2細胞およびJurkat細胞での
測定実績を下記図に示しておりますので参照ください。(2) 300 x gで5分間遠心し、上澄みを除去する。 (3) 冷PBS 300 µlを加え、ピペッティングにより懸濁後、300 x gで5分間遠心し、上澄みを除去する。 (4) 細胞溶解液*2(0.1% Triton X-100 水溶液)を250 µlを加え、ピペッティングにより細胞を溶解した後、
12,000 x gで5分間遠心する。(5) 操作(4)の上清200 µlを限外ろ過膜フィルター(分画分子量:10K)に移し、12,000x gで10分間遠心する。
※測定用サンプルはn=3で測定する場合、合計150 µl以上は必要です(1ウェルあたり50 µl×3ウェル分)。
※遠心後の濾液が150 µl以上ない場合は、遠心時間を延長して下さい。(6) 操作(5)で得られた濾液を測定サンプルとする。
その後、キット付属の取扱説明書に従い、グルコース濃度を測定する。
※測定試料は、検量線範囲内(0-0.5 mmol/l)に入るように適宜細胞溶解液で希釈し、測定に用いて下さい。*10.02 mmol/l以上のグルコースを検出するためにはHepG2細胞の場合、1×105 cells以上、
Jurkat細胞の場合、2×106 cells以上必要。
*2細胞溶解液にSDSを含むと発色を阻害するため、SDSを含むバッファーの使用はできません。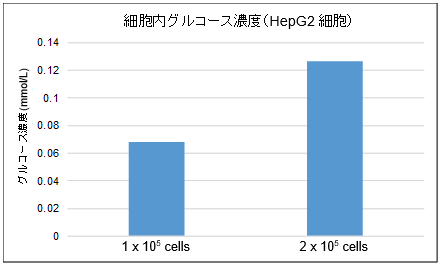
-
Q
2-Deoxy-D-glucoseも検出されますか?
-
A
本キットでは、2-Deoxy-D-glucoseもグルコースとして検出されます。
-
Q
L-Glucoseの測定はできますか?
-
A
本製品はβ-D-Glucose測定用となりますので、L-Glucoseの測定はできません。
-
Q
Working solutionはどのくらい安定ですか?
-
A
Working solutionは保存できないので、用時調製して下さい。
Working solutionは光に不安定なため、調製後は遮光して下さい。遮光下室温にて4時間安定です。
(Working solutionを光に暴露させると溶液の色が赤色から橙色に変化し、バックグラウンドが上昇します)
-
Q
還元物質を含むサンプルは測定できますか?
-
A
サンプル中に還元性の物質が含まれると、色素(WST)が誤発色して正確なグルコース濃度を測定できません。
還元性を持つ薬剤を培地に添加して実験を行う場合は、バックグラウンドコントロールとして「細胞を含まない培地」+「薬剤のみ」を同時に評価し、検量線およびサンプルの吸光度から試薬ブランクとして差し引いてください。
-
Q
発色反応が進まない場合の原因を教えて下さい。
-
A
測定試料に含まれるグルコース濃度が、0.02 mmol/lより低い可能性があります。
グルコース濃度が0.02 mmol/l以下の測定試料は本キットでは定量できませんので、LC-MSなど他の方法をご検討下さい。
なお、測定試料を希釈している場合は、希釈倍率を下げ、グルコース濃度を定量可能範囲以上に調整してください。
-
Q
測定試料は保存できますか?
-
A
保存できます。
細胞培養上清サンプルの場合、冷凍(-20℃)で3週間、細胞ライセートサンプルの場合は、冷凍(-20℃)で1ヶ月保存可能であることを確認しております。
ただし、細胞ライセートサンプルの場合は、除タンパク処理 *を行って下さい。
( *よくある質問「細胞内のグルコース測定はできますか?」操作5)の溶液を保存してください。)
取扱条件
| 保存条件: 冷蔵,遮光 , 取扱条件: 吸湿注意 |