はじめに
シスチンは、抗酸化物質であるグルタチオンの原料であり、細胞内のレドックスバランスの制御に重要な役割を果たしています。シスチン・グルタミン酸トランスポーター(xCT)は、主に細胞外液のシスチンと細胞内のグルタミン酸を1対1で交換輸送するアミノ酸トランスポーターであり、近年、がん、神経変性疾患、免疫との関連に注目が集まっています。
xCT活性を測定する方法として、古くから放射性同位体標識シスチンの取り込みアッセイ法が用いられています。しかし、放射性同位体を使用するため取り扱いが面倒であり、汎用的とは言えません。Cystine Uptake Assay Kitは、xCT活性を蛍光法によって簡便に測定するためのキットです。キットに含まれるCystine Analog (CA) は、シスチンと同様にxCTを経由して細胞内に取り込まれるため、細胞内に取り込まれたCAを蛍光検出することでxCT活性を測定することが可能です。
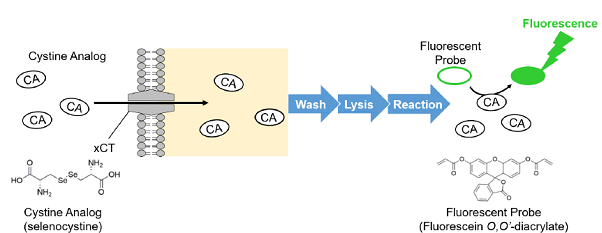
図1 Cystine Uptake Assay Kitの原理
(特許出願中)
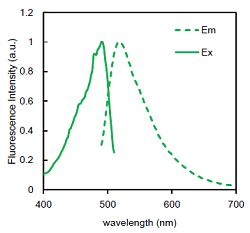
図2 Fluorescent Probeの蛍光特性
キット内容
| 20 tests | 100 tests | |
| Cystine Analog Solution | 45 μl x 1 | 225 μl x 1 |
| Fluorescent Probe | x 1 | x 1 |
| Reducing Agent | x 1 | x 2 |
| Assay Buffer | 5 ml x 1 | 25 ml x 1 |
保存条件
-20℃にて保存してください
必要なもの (キット以外)
-
- 蛍光プレートリーダー (Ex/Em = 490/535 nm)
- CO2インキュベーター(37℃)
- 200, 1000 μl マイクロピペット
- プレートシール
- メタノール
-
- 96 well マイクロプレート
- 20–200 μl のマルチチャンネルピペット
- シスチン不含無血清培地
- Phosphate-buffered saline (PBS)
- Dimethylsulfoxide (DMSO)
使用上のご注意
- ・輸送中の振動等により、内容物がチューブ壁面やキャップ裏面に付着している場合がありますので、遠心してからご使用ください。
- ・正確な測定値を得るために、1つの測定試料につき複数 (n = 3以上) のウェルを使用ください。
- ・測定値 (蛍光強度) を細胞数やタンパク質濃度で補正する場合、接着細胞と浮遊細胞で補正方法やタイミングが異なります。
詳細はよくある質問 測定値 (蛍光強度) を細胞数やタンパク質濃度で補正する方法を教えてください。をご参照ください。
溶液調製
1. CA uptake solutionの調製
Cystine Analog Solutionをシスチン不含無血清培地で100倍希釈し、37℃でインキュベートする。
| 20 tests (4 ml) |
50 tests (10 ml) |
100 tests (20 ml) |
|
| Cystine Analog Solution | 40 μl | 100 μl | 200 μl |
| シスチン不含無血清培地 | 4 ml | 10 ml | 20 ml |
- 細胞のシスチン取り込み能力は溶液の温度により影響を与える場合がございます。あらかじめインキュベーター(37℃)内で加温して下さい。
- 調製後の CA uptake solution は保存できません。その日のうちにお使い下さい。
2. Probe solutionの調製
Fluorescent Probe にDMSOを加え溶解する。
| DMSO量 | |
| 100 tests | 50 μl |
| 20 tests | 10 μl |
- 内容物がチューブ底面からはずれ、チューブ壁面やキャップ裏面に付着している場合があります。
内容物を底面に落とした後に開封して下さい。 - 溶解後は冷凍保存して下さい。調製後は2か月間安定です。
3. Reducing agent (RA) solutionの調製
Reducing Agentに超純水を加え、ピペッティングにより溶解する。
| 超純水量 | |
| 100 tests | 250 μl |
| 20 tests | 100 μl |
- 内容物がチューブ底面からはずれ、チューブ壁面やキャップ裏面に付着している場合があります。
内容物を底面に落とした後に開封して下さい。 - 溶解後は冷凍保存して下さい。調製後は2か月間安定です。
操作
接着細胞の場合
- ウェル間の時間差を少なくするためにマルチチャンネルピペットをご使用下さい。
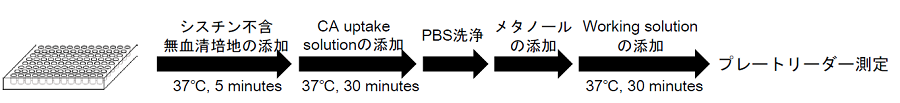
図3 接着細胞 測定の手順
- 細胞を96 well マイクロプレートに播種し、5% CO2 インキュベーター(37°C)内で一晩培養する。
- 上清を除去した後、37℃に加温したシスチン不含無血清培地※1200 μl にて3 回洗浄する。
- 37℃に加温したシスチン不含無血清培地※1200 μl を添加し、5% CO2 インキュベーター(37°C)内で5 分間静置する。
- 上清を除去した後、CA uptake solution※1 あるいはシスチン不含無血清培地※1(ブランク)200 μl を添加し、5% CO2 インキュベーター(37°C)内で30 分間静置する。
- 上清を除去した後、冷却したPBS 200 μl で3 回洗浄する。
- 上清を除去した後、メタノールを50 μl を添加する。
- Working solution を調製する。※2
20 tests
(4 ml)50 tests
(10 ml)100 tests
(20 ml)Probe solution 8 μl 20 μl 40 μl RA solution 80 μl 200 μl 400 μl Assay Buffer 4 ml 10 ml 20 ml - Working solution 200 μl を添加した後、ピペッティングを行い30 分間静置する (37℃ )。※3
- 蛍光プレートリーダーで蛍光を測定する(λex = 490 nm, λem = 535 nm)。※4
- 各サンプルの測定値からブランクの測定値を差し引く。
(Option: 蛍光強度の補正)
サンプル間またはブランクとの蛍光強度差が得られない場合には、核染色法による補正を行ってください。
具体的な方法については製品HPのよくある質問をご参照ください。
- 細胞のシスチン取り込み能力は溶液の温度により影響を与える場合がございます。あらかじめインキュベーター(37℃)内で加温して下さい。
- Working solution は使用直前に調製して下さい。
- インキュベート中は、蒸発を防ぐためプレートシールをご使用ください。
- 必要に応じて、得られた蛍光強度を細胞数(核染色)で補正して下さい。
浮遊細胞の場合
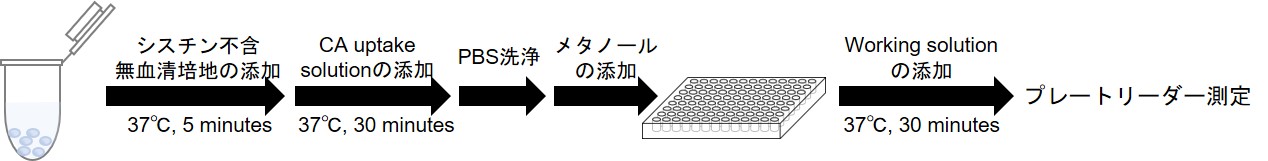
図4 浮遊細胞 測定の手順
- 細胞をマイクロチューブに分注する。 ※例:2種類のサンプルをn=3で測る場合は9本準備する(サンプル1,2,ブランク:n=3)。
- 300 x g, 3分間遠心する。
- 上清を除去した後、37℃に加温したシスチン不含無血清培地※1 500 μlを添加し、細胞を再懸濁後、300 x gで3分間遠心する。この操作を2回繰り返す。
- 上清を除去した後、37℃に加温したシスチン不含無血清培地※1 500 μlを添加し、細胞を再懸濁後、5% CO2インキュベーター(37℃)内で5分間静置し、300 x gで3分間遠心する。
- 上清を除去した後、37℃に加温したCA uptake solution※1 あるいはシスチン不含無血清培地※1 500 μl を添加し、再懸濁後5% CO2インキュベーター(37℃)内で30分間静置し、300 x gで3分間遠心する。
- 上清を除去した後、冷却したPBS 500 μl加え、細胞を再懸濁後、300 x gで3分間遠心する。この操作を2回繰り返す。
- 上清を除去した後、メタノールを100 μlを添加し、ピペッティングを行う。
- 測定値をタンパク質量で補正する場合:操作7)の溶液の50 μlを本製品の測定に使用し、残りの一部をタンパク質濃度の測定に使用します。
- Working solution を調製する。※2
20 tests
(4 ml)50 tests
(10 ml)100 tests
(20 ml)Probe solution 8 μl 20 μl 40 μl RA solution 80 μl 200 μl 400 μl Assay Buffer 4 ml 10 ml 20 ml - 操作7の溶液50 μlを96 well ブラックマイクロプレートに移し、Working solution 200 μlを添加した後、ピペッティングを行い、30分間静置する(37℃)※3。
- 操作7の溶液を十分に懸濁してからマイクロプレートに移してください。
- 蛍光プレートリーダーで蛍光強度を測定する(Ex/Em = 490/535 nm)。
- 各サンプルの測定値からブランクの測定値を差し引き、取り込まれたCystine Analog由来の蛍光強度を算出する。
(Option: 蛍光強度の補正)
サンプル間またはブランクとの蛍光強度差が得られない場合には、タンパク質濃度による補正を行ってください。
具体的な方法については製品HPのよくある質問をご参照ください。
- 細胞のシスチン取り込み能力は溶液の温度により影響を与える場合がございます。あらかじめインキュベータ(37℃)内で加温して下さい。
- Working solution は使用直前に調製して下さい。
- インキュベート中は、蒸発を防ぐためプレートシールをご使用ください。
- 必要に応じて、得られた蛍光強度をタンパク質濃度で補正して下さい。
実験例:接着細胞
xCT 阻害剤エラスチンによるシスチントランスポーター活性阻害(接着細胞:HeLa)
- 96 well ブラックマイクロプレート(655090:Greiner 社)の各ウェルにHeLa 細胞(1.5 x 104 cells/well) を播種し、5% CO2 インキュベーター(37℃)内で一晩培養した。
- 培地を除去した後、37℃に加温したシスチン不含無血清培地DMEM (cystine-free、serum-free、 2 mmol/l glutamine 添加、21013024: Thermofisher 社) 200 μl にて3 回洗浄する。
- 37℃に加温した0 μmol/l ( サンプル1, ブランク) または100 μmol/l Erastin ( サンプル2) を含むDMEM を200 μl を添加し、5% CO2 インキュベーター(37℃)内で5 分間静置した。
- 上清を除去した後、37℃に加温した0 μmol/l または100 μmol/l Erastin を含むCA uptake solution(サンプル1,2)あるいはDMEM 200 μl を添加し、5% CO2 インキュベーター(37℃)内で30 分間静置した。
- 上清を除去した後、冷却したPBS 200 μl で3 回洗浄した。
- 上清を除去した後、メタノールを50 μl を添加した。
- Working solution 200 μl を添加した後、ピペッティングを行い、マイクロプレート用シールで封をして30 分間インキュベートした(37℃)。
- 蛍光プレートリーダー(機種:Infinite m200 PRO:TECAN 社)で蛍光を測定した(Ex/Em = 490/535 nm)。
- 各サンプルの測定値からブランクの測定値を差し引き、取り込まれたCystine Analog 由来の蛍光強度を算出した。
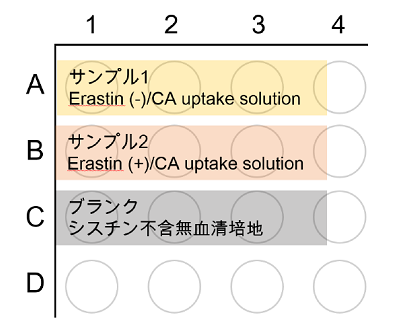
図5 プレートレイアウト
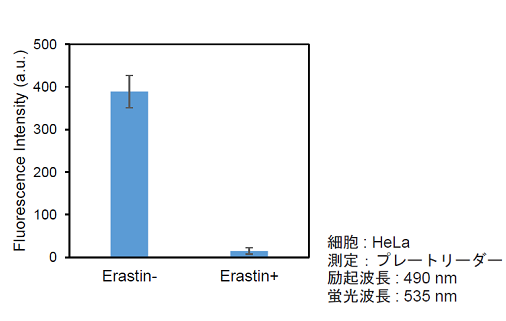
図6 エラスチンによるシスチントランスポーター活性阻害
実験例:浮遊細胞
xCT阻害剤エラスチンによるシスチントランスポーター活性阻害(浮遊細胞: HL60)
- マイクロチューブ 9本に1.0 x 106 cells/tubeとなるようにHL60細胞を分注した(サンプル1, 2, ブランク:n = 3)。
- 300 x g, 3分間遠心した。
- 上清を除去した後、37℃に加温したシスチン不含無血清培地DMEM 500 μl加え、細胞を再懸濁し、 300 x gで3分間遠心した。この操作を2回繰り返した。
- 37℃に加温した0 μmol/l (サンプル1, ブランク)または100 μmol/l Erastin (サンプル2)を含むDMEMを 500 μlを添加し、再懸濁後、5% CO2インキュベーター(37℃)内で5分間静置し、300 x gで3分間遠心した。
- 上清を除去した後、37℃に加温した0 μmol/lまたは100 μmol/l Erastinを含むCA uptake solution (サンプル1, 2)あるいはDMEM (ブランク) 500 μl を添加し、再懸濁した。
- 5% CO2インキュベーター(37℃)内で30分間静置し、300 x gで3分間遠心した。
- 上清を除去した後、冷却したPBS 500 μl加え、細胞を再懸濁後、300 x gで3分間遠心した。この操作を2回繰り返した。
- 上清を除去した後、メタノールを100 μlを添加し、ピペッティングを行った。
- 操作8の溶液50 μlを本製品の測定に使用し、残りの一部を蛍光強度の補正に用いた。
- 操作8の溶液50 μlを96 well ブラックマイクロプレートに移し、Working solution 200 μlを添加した後、ピペッティングを行い、マイクロプレート用シールで封をして30分間インキュベートした (37℃)。
- 操作8の溶液を十分に懸濁してからマイクロプレートに移した。
- 蛍光プレートリーダー (機種 : Infinite m200 PRO : TECAN社) で蛍光強度を測定した (Ex/Em = 490/535 nm)。
- 各サンプルの測定値からブランクの測定値を差し引き、取り込まれたCystine Analog由来の蛍光強度を算出した。
(蛍光強度の補正) - 操作8の残りにRIPA Buffer (16488-34: nacalai tesque社) 50 μl加えてボルテックスミキサーで撹拌混合し、室温で30分間静置した。
- 操作12の溶液15 μlを用いてタンパク質定量 (BCA Assay) を行い、操作11で得た蛍光強度を補正した。
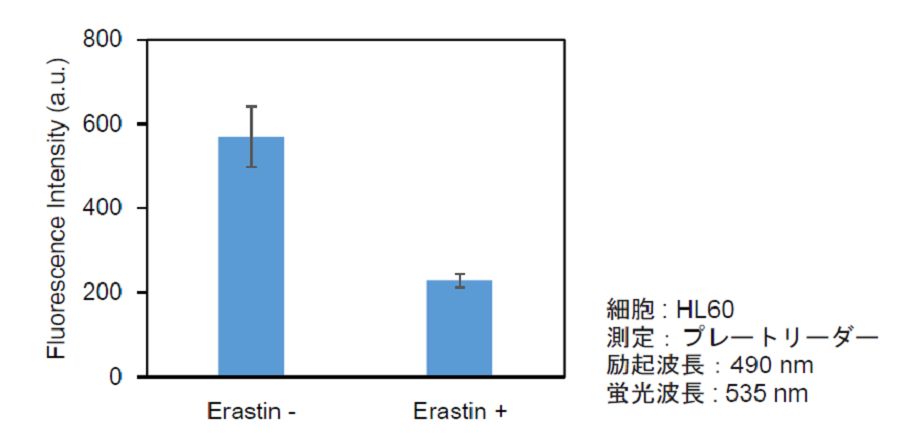
図7 エラスチンによるシスチントランスポーター活性阻害
よくある質問/参考文献
UP05: Cystine Uptake Assay Kit
Revised Aug., 01, 2023


 を押して省略できます。
を押して省略できます。

