GSSG/GSH Quantification Kit
グルタチオン定量キット
-
製品コードG257 GSSG/GSH Quantification Kit
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 200 tests | ¥70,100 | 342-09011 |
| 200 tests | ・ Enzyme Solution ・ Coenzyme ・ Buffer Solution ・ Substrate (DTNB) ・ Standard GSH ・ Standard GSSG ・ Masking Reagent |
50 μl x1 x2 60 ml x1 x4 x1 x1 20 μl x1 |
|---|
性質
グルタチオン(γ-L-glutamyl-L-cysteinylglycine)は生体内に存在するトリペプチドで、glutathione peroxidase、glutathione S-transferaseおよびthiol transferase等の酵素基質として抗酸化や薬物代謝などに関与している。グルタチオンは通常、生体内で還元型(GSH)として存在しているが、酸化ストレスなどの刺激によって還元型(GSH)から酸化型(GSSG)に変換されるため、GSHとGSSGの比率が酸化ストレスの指標として注目されている。
本キットには、GSHを隠蔽するためのマスキング剤が含まれており、マスキング剤をサンプルに添加することでサンプル内のGSHのみを隠蔽することができる。その後、酵素リサイクリング法を用いたDTNB[5,5'-dithiobis (2-nitrobenzoic acid)]発色(λmax=412 nm)を測定することで、GSSGのみを定量でき、別途、測定した総グルタチオン量からGSSG量を差し引くことでGSH量を求めることが可能となる。なお、本キットでの総グルタチオンの測定範囲は0.5~50 μmol/l、GSSGの測定範囲は0.5~25 μmol/lである。
| 開発元 | Dojindo Molecular Technologies, Inc. |
|---|
マニュアル
技術情報
特長
1)酸化型グルタチオン(GSSG)、還元型グルタチオン(GSH)の分別定量が可能である。
2)短時間で簡便に多検体の測定が可能である。
測定原理図
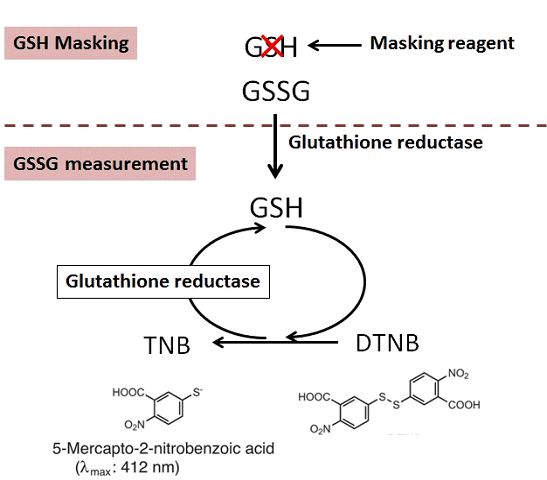
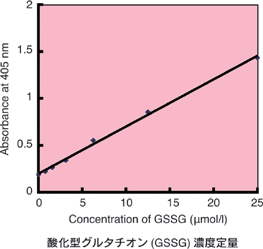
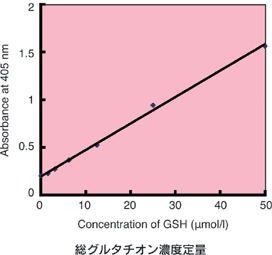
還元型グルタチオン(GSH)濃度算出 : GSH濃度=総グルタチオン濃度―(GSSG濃度×2)
操作方法


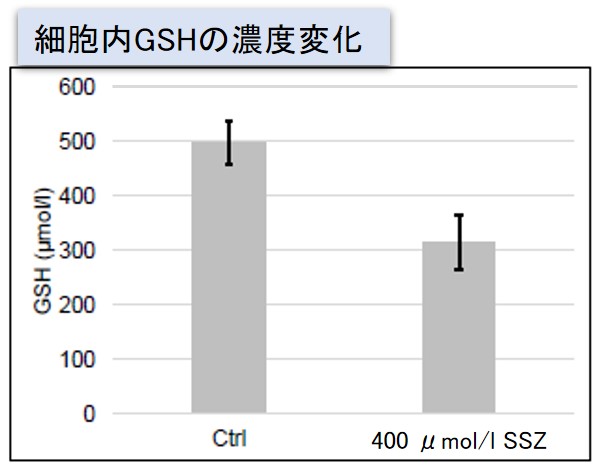
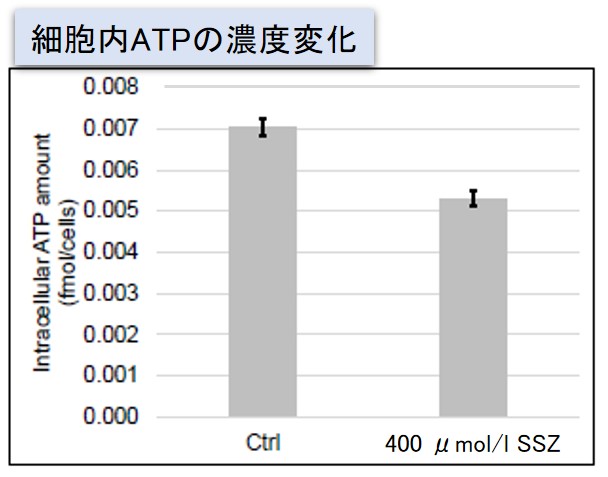
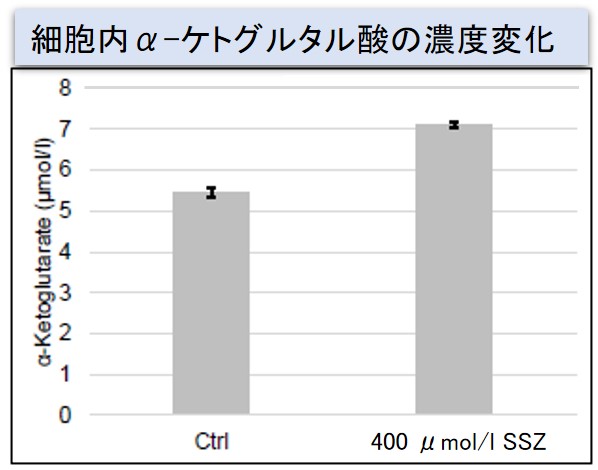
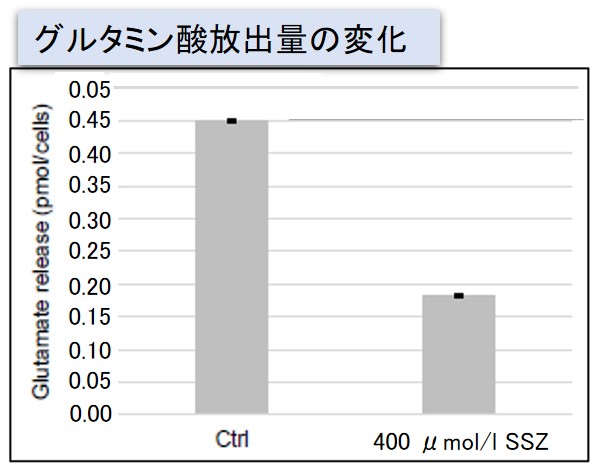
実験例:Sulfasalazine (SSZ) による細胞内代謝の変化
シスチン / グルタミン酸トランスポーター (xCT) を阻害することが知られている Sulfasalazine (SSZ) を A549細胞へ添加後、細胞内のグルタチオン (GSH)、ATP、α-ケトグルタル酸(α-KG)、 ROSの変化と、グルタミン酸放出量の変化を確認しました。
その結果、SSZ 添加により細胞内のATP、グルタチオン(GSH)ならびにグルタミン酸放出量は減少し、細胞内のα-ケトグルタル酸とROSは増加しました。
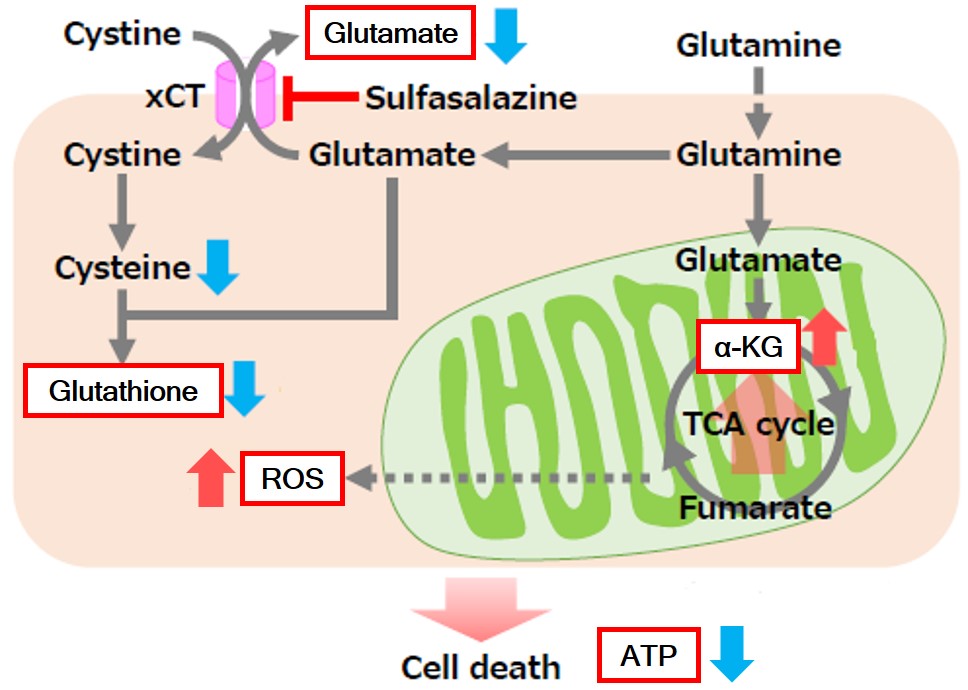
<使用製品>
・細胞内ATP :ATP Assay Kit-Luminescence (製品コード:A550)
・細胞内α-KG:α-Ketoglutarate Assay Kit-Fluorometric (製品コード:K261)
・細胞内ROS:ROS Assay Kit -Highly Sensitive DCFH-DA- (製品コード:R252)
・グルタミン酸放出量:Glutamate Assay Kit-WST (製品コード:G269)
<実験条件>
細胞:A549細胞 (1 x 106 cells) 暴露時間:48時間
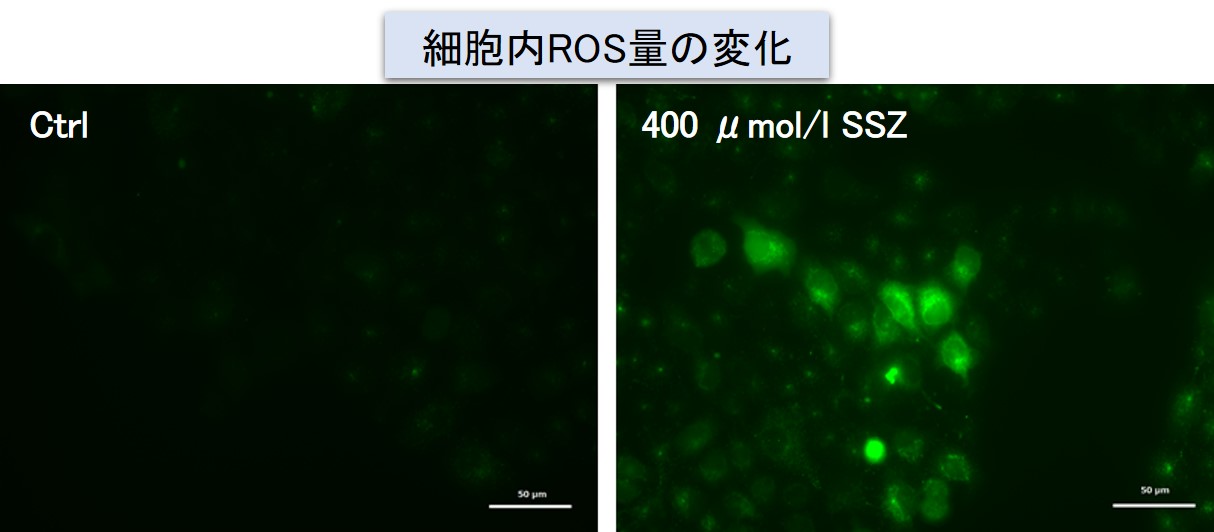 (スケールバー:50 µm) |
参考文献) Shogo Okazaki et al., "Glutaminolysis-related genes determine sensitivity to xCT-targeted therapy in head and neck squamous cell carcinoma". Cancer Sci., 2019, doi:10.1111/cas.14182.
参考文献
1) M. E. Anderson, "Determination of Glutathione and Glutathione Disulfide in Biological Samples", Methods in Enzymol., 1985, 113, 548.
2) M. A. Baker, G. J. Cerniglia and A. Zaman, "Microtiter Plate Assay for the Measurement of Glutathione and Glutathione Disulfide in Large Numbers of Biological Samples", Anal. Biochem., 1990, 190, 360.
3) C. Vandeputte, I. Guizon, I. Genestie-Denis, B. Vannier and G. Lorenzon, "A Micrototer Plate Assay for Total Glutathione and Glutathione Disulfide Contents in Cultured/isolated Cells: Performance Study of a New Miniaturized Protocol", Cell Biol. Toxicol., 1994, 10, 415.
4) S. A. McGrath-Morrow and J. Stahl, "Inhibition of Glutamine Synthetase in A549 Cells During Hyperoxia", Am. J. Respir. Cell Mol. Biol., 2002, 27, 99.
5) T. Sato, K. Seyama, Y. Sato, H. Mori, S. Souma, T. Akiyoshi, Y. Kodama, T. Mori, S. Goto, K. Takahashi, Y. Fukuchi, N. Maruyama and A. Ishigami, "Senescence Marker Protein-30 Protects Mice Lungs from Oxidative Stress, Aging, and Smoking", Am. J. Respir. Crit. Care Med., 2006, 174, 530.
6) M. L. Mulhern, C. J. Madson, A. Danford, K. Ikesugi, P. F. Kador and T. Shinohara, "The Unfolded Protein Response in Lens Epithelial Cells from Galactosemic Rat Lenses", Invest. Ophthalmol. Vis. Sci., 2006, 47(9), 3951.
7) N. Miura, Y. Yanagiba, K. Ohtani, M. Mita, and M. Togawa, "Diurnal Variation of Cadmium-induced Mortality in Mice", J. Toxicol. Sci., 2012, 37(1), 191.
8) K. Okabayashi, T. Narita, Y. Takahashi and H. Sugiya, "Effrct of Oxidative Stress on Secretory Function in Salivary Gland Cells", Oxidative Stress-Environmental Induction and Dietary Antioxidants, V. Lushchak, InTech, 2012, 189.
9) G. Tian, J. Sawashita, H. Kubo, S. Nishio, S. Hashimoto, N. Suzuki, H. Yoshimura, M. Tsuruoka, Y. Wang, Y. Liu, H. Luo, Z. Xu, M. Mori, M. Kitano, K. Hosoe, T. Takeda, S. Usami and K. Higuchi, "Ubiquinol-10 Supplementation Activates Mitochondria Functions to Decelerate Senescence in Senescence-Accelerated Mice", Antioxid. Redox Signal., 2014, 20(16), 2606.
10) H. Nakagawa, A. Umemura, K. Taniguchi, J. Font-Burgada, D. Dhar, H. Ogata, Z. Zhong, M. A. Valasek, E. Seki, J. Hidalgo, K. Koike, R. J. Kaufman and M. Karin, "ER Stress Cooperates with Hypernutrition to Trigger TNF-Dependent Spontaneous HCC Development", Cancer cell, 2014, 26(3), 331.
11) M. Sueyoshi, M. Fukunaga, M. Mei, A. Nakajima, G. Tanaka, T. Murase, Y. Narita, S. Hirata, and D. Kadowaki, "Effects of lactulose on renal function and gut microbiota in adenine-induced chronic kidney disease rats", Clinical and Experimental Nephrology., 2019,doi: 10.1007/s10157-019-01727-4.
12) S. Shiromizu, T. Yamauchi, N. Kusunose, N. Matsunaga, S. Koyanagi and S. Ohdo, Dosing Time-Dependent Changes in the Anti-tumor Effect of xCT Inhibitor Erastin in Human Breast Cancer Xenograft Mice', Biol. Pharm. Bull.., 2019, 42, (11), 1921-1925.
13) K. Ogawa, A. Noda, J. Ueda, T. Ogata, R. Matsuyama, Y. Nishizawa, S. Qiao, S. Iwata, M. Ito, Y. Fujihara, M. Ichihara, K. Adachi, Y. Takaoka and T. Iwamoto, "Forced expression of miR-143 and -145 in cardiomyocytes induces cardiomyopathy with a reductive redox shift", Cell. Mol. Biol. Lett., 2020, doi:10.1186/s11658-020-00232-x.
よくある質問
-
Q
どのようなサンプルが測れますか?
-
A
組織、血漿、赤血球、細胞のサンプルが測れます。
但し、血漿の場合はグルタチオン量が少ないため、検体によっては測り分けが困難な場合があります。
-
Q
このKitで何サンプル測定できますか?
-
A
本キットは200testsです(96wellプレート2枚分)。
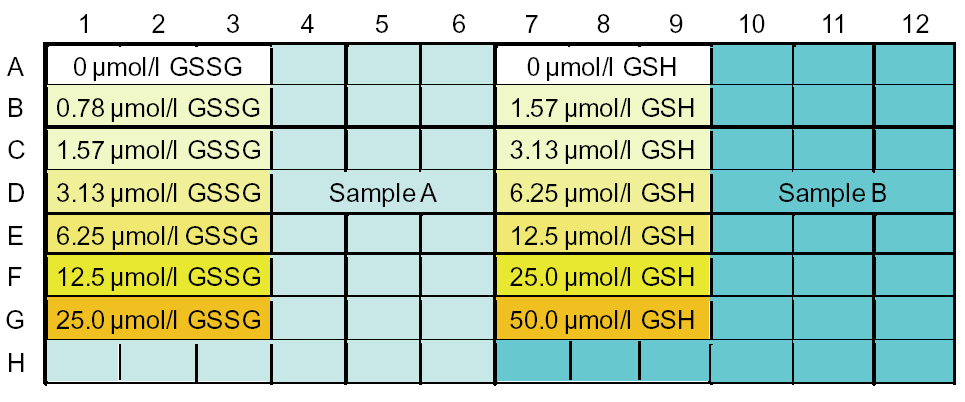
n=3とした場合、18サンプルの測り分けが可能です〈サンプルに着色がない場合)。
測り分けない場合(総グルタチオン量のみを測定する場合)は、50サンプル測定できます。
※サンプルに着色がある場合は、サンプルブランクの測定が必要です。
サンプルブランクの測定方法は、FAQ 「サンプルに着色がある場合の測定方法」をご参照下さい。
※サンプルのレイアウト例:レーン1~6はGSSG濃度測定、レーン7~12は総グルタチオン濃度測定
-
Q
サンプルに着色がある場合は、どうすればいいですか?
-
A
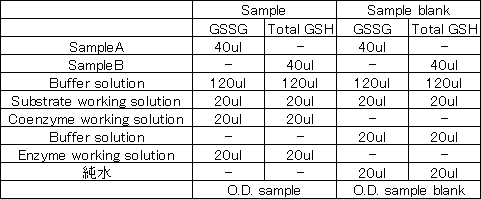
サンプルに着色がある場合、以下の2つの方法のどちらかでサンプルブランクを差し引くことが可能です。
①Kinetic methodで測定を行う。※検量線の傾きで検量線を作成する為、サンプルブランクの影響を受けない。
②グルタチオン濃度算出の際、O.D.blankを引く代わりに、別途、測定したO.D. sample blankを引く。
グルタチオン(GSH, GSGG) = (O.D. sample - O.D. sample blank) / 検量線の傾き
<O.D. sample blankの測定方法>
取扱説明書 「4. 測定」に従い、吸光度を測定する。
その際、Coenzyme working solution, Enzyme working solutionを添加せず、
Buffer solutionと純水を添加する。
-
Q
GSSGとGSHの比率を測定することで、何が分かるのですか?
-
A
グルタチオンは通常、生体内で還元型(GSH)として存在していますが、
酸化ストレスなどの刺激によって酸化型(GSSG)に変換される為、GSHとGSSGの比率が酸化ストレスの指標となります。
-
Q
GSH濃度はどのように求めるのですか?
-
A
検量線を基に求めた総グルタチオン(GSH+GSSG)濃度とGSSG濃度より、
下式を用いてGSH濃度を算出します。
GSH濃度=総グルタチオン濃度-[GSSG濃度]×2
※GSSG(酸化型グルタチオン)はGSH(還元型グルタチオン)2分子に相当します。
そのため、GSSG濃度を2倍にすることでGSH濃度に換算しています。
-
Q
推奨する5-スルホサリチル酸のメーカーやグレードはありますか?
-
A
特にメーカーの推奨はしておりません。試薬グレードの製品をご利用ください。
-
Q
Masking reagentは、GSSG由来のGSHもマスキングしないのでしょうか?
-
A
酵素・補酵素添加後に、GSSGから生じたGSHは、マスキング剤と反応するより先にDTNBと反応してGSSGに戻るため、
GSSGから生じたGSHまでマスキングされることはありません。
-
Q
マスキングの時間(37℃、1時間)が長くなってしまっても問題ありませんか?
-
A
多少長くなっても構いません。2時間まで測定実績がございます。
※マスキングの時間とは、Technical Manual 「測定方法」4.測定 3)にある 「37℃で1時間インキュベートする。」の操作を指します。
-
Q
Total Glutathione Quantification Kit (同仁品コード:T419) と何が違うのでしょうか?
-
A
今回のGSSG/GSH Quantification Kit(G257)はTotal Glutathione Quantification Kit(T419)では出来なかったGSSGとGSHの測り分けができます。
酸化ストレスの指標として、GSHとGSSGの比率は注目されています。
-
Q
サンプル中のグルタチオン量が多いです。 サンプルの希釈はできますか?
-
A
0.5%スルホサリチル酸(SSA)水溶液で希釈してください。
測定時のサンプル中SSA濃度は.0.5~1%にする必要があります。SSA濃度が高いと反応時のpHが低くなり、吸光度に影響することが懸念されます。
-
Q
総グルタチオン量のみ測定する場合、マスキングの時間(37℃、1時間)は省略してよいですか?
-
A
省略可能です。
尚、本キットはGSSGとGSHの測り分けが可能な設計となっております。
測り分けが必要ない場合は、Total Glutathione Quantification Kit (同仁品コード:T419) もご利用いただけます。
※マスキングの時間とは、Technical Manual 「測定方法」4.測定 3)にある 「37℃で1時間インキュベートする。」の操作を指します。
-
Q
発色が弱い場合は、どうすればいいですか?
-
A
以下の3つが要因として考えられます。
1. 本キットでの測定範囲は 0.5 μmol/l 以上です。測定試料に含まれるグルタチオン量が、それよりも少ない可能性があります。
測定範囲外の測定試料は、本キットでは測定できませんので、HPLC法など他の方法をご検討下さい。
可能であれば、前処理の希釈倍率を下げる、サンプル量を増やすなど、測定試料の濃度を測定範囲以上にして下さい。
※発色を強める為に、発色の時間を長くすると検量線の直線性が得られなくなりますので、ご注意下さい。2. 発色を阻害する物質が含まれている可能性があります。例えば、SH基と反応する化合物(マレイミド類)などは測定に影響を及ぼします。
これらの化合物は前処理等で除くことができませんので、測定試料中に混在させない系で再度測定して下さい。3.反応時のpHが低く、発色阻害が起こっている可能性があります。
測定時にSSA濃度が1%以下になってるか、ご確認下さい。SSA濃度が1%以上の場合、発色阻害が起こります。
他の酸を用いた場合にはトリエタノールアミン等でpH7程度に中和するか、酸濃度が1%程度以下になるように希釈してから測定して下さい。
-
Q
測定値がマイナスになります。どのような要因がありますか。
-
A
以下の3つが要因として考えられます。
1.サンプル中のグルタチオン量が少ない可能性があります。
サンプルの量を増やして、ご検討ください。
なお、血漿はグルタチオン量が少なく、測定が困難な場合がございます。2. サンプルの前処理中にGSHがアミノ基と副反応を起こして減少した可能性があります。
GSHは、中性条件で以下のような副反応により減少することが報告されています
(Methods in Enzymology, 1985, 113, 548)。
そのため、サンプルの前処理(5%SSA処理)を素早く行ってください。GSH + amino acid ⇔ γ-Glu-amino acid +CysH-Gly (アミノ基転移)
GSH + H2O → Glu +CysH-Gly (加水分解)
GSH + GSH ⇔ γ-Glu-GSH +CysH-Gly (アミノ基転移)3. サンプルの前処理中にGSHが酸化してGSSGとなった可能性があります。
2と同様、サンプルの前処理(5%SSA処理)を素早く行ってください。
-
Q
酸化ストレスの指標としてグルタチオンが測定されますが、 他の酸化ストレスマーカーはありますか?
-
A
酸化ストレスマーカーに関する資料をご参考ください。
カスタマーサポートの視点から、各酸化ストレスマーカーの特徴・測定サンプルの前処理方法などを記載しております。下記URLよりダウンロード可能です。
「はじめての酸化ストレスマーカー測定プロトコル~カスタマーサポートの視点から~」
取扱条件
| 保存条件: 冷蔵 | |
|
危険・有害 シンボルマーク |
  
|
|---|---|