Glucose Uptake Assay Kit-Green
グルコース取り込み検出キットGreen
- グルコース取り込み能力を高感度かつ簡便に測定できる
- プレートリーダーを用いて測定が可能
- 取り込まれた色素の漏れ出しを抑制し、再現性の高いデータを取得できる
-
製品コードUP02 Glucose Uptake Assay Kit-Green
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 1 set | ¥45,700 | 347-09821 |
使用回数の目安
1 set あたり、35 mm dish 12 枚、96-well plate 1 枚
| 1 set | Glucose Uptake Probe-Green WI Solution (50×) |
×1 5 ml ×1 |
|---|
性質
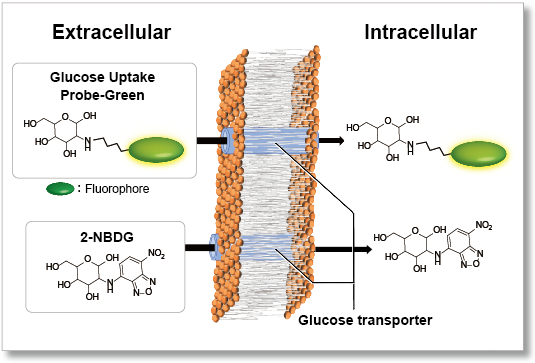
細胞はさまざまな栄養素を取り込み、細胞内代謝を介してエネルギーを産生しています。このような栄養代謝は細胞外環境や細胞の状態、細胞の種類などによって異なっており、近年このような栄養代謝が単なるエネルギー産生だけでなく、遺伝子発現を含むさまざまな細胞機能制御にも関与していることが明らかとなっています。グルコースは、主要な栄養素の一つであり、グルコースの取り込みや代謝を理解することは細胞機能を解明する上で非常に重要となります。
蛍光標識グルコース誘導体 Glucose Uptake Probe-Green は、2-NBDG に比べて高感度に細胞のグルコース取り込み能力を測定することができます。さらに、本キットに含まれる Washing and Imaging (WI) Solution を用いることで細胞からのプローブの漏出を抑制し、再現性の高いデータを取得することが可能です。
マニュアル
技術情報
既存法よりココが良い!4つの特徴
高輝度の色素を採用したことにより、既存法(2-NBDG)よりも高感度かつ短時間での測定が可能となりました。
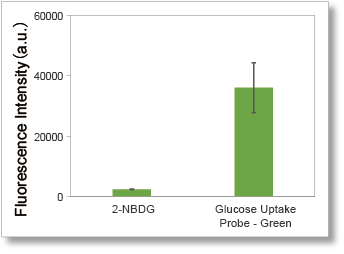
①グルコース取り込み能力を高感度に測定が可能
水中で蛍光強度が低下する2-NBDGと異なる高輝度の蛍光色素を採用したことにより、グルコース取り込み能力を高輝度にて測定することができます。
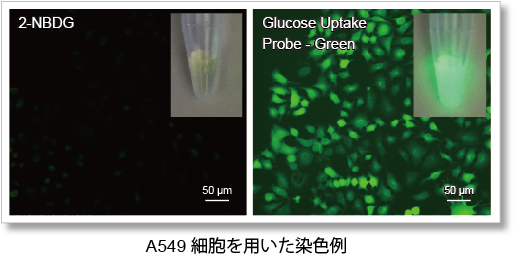
<観察条件>
細胞:A549細胞
測定装置:蛍光顕微鏡
フィルターセット:GFP (Ex: 470 / 40 nm, Em: 525 / 50 nm)
②迅速な操作性を実現
高輝度のGlucose Uptake Probe-Greenにより、2-NBDGと同じ操作にも関わらず、 操作時間を大幅に短縮できます。
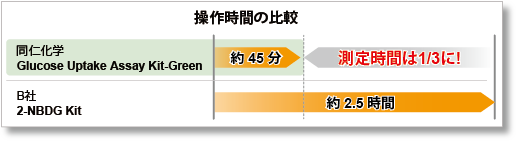
操作は前処理、染色(取り込み)、洗浄の3stepのみであり非常に簡便です。
③プレートリーダーを用いて測定可能
2-NBDGでは測定が困難なプレートリーダー測定に対応しています。
スクリーニング用途への活用が期待できます。
検出条件
Ex:488 nm, Em: 520 nm
細胞:A549細胞
④染色後の色素漏洩を低減
付属のWI Solutionを用いて細胞を洗浄することで色素の漏洩を抑制し、再現性の高いデータを取得することが可能です。
HBSSを用いて細胞を洗浄した場合
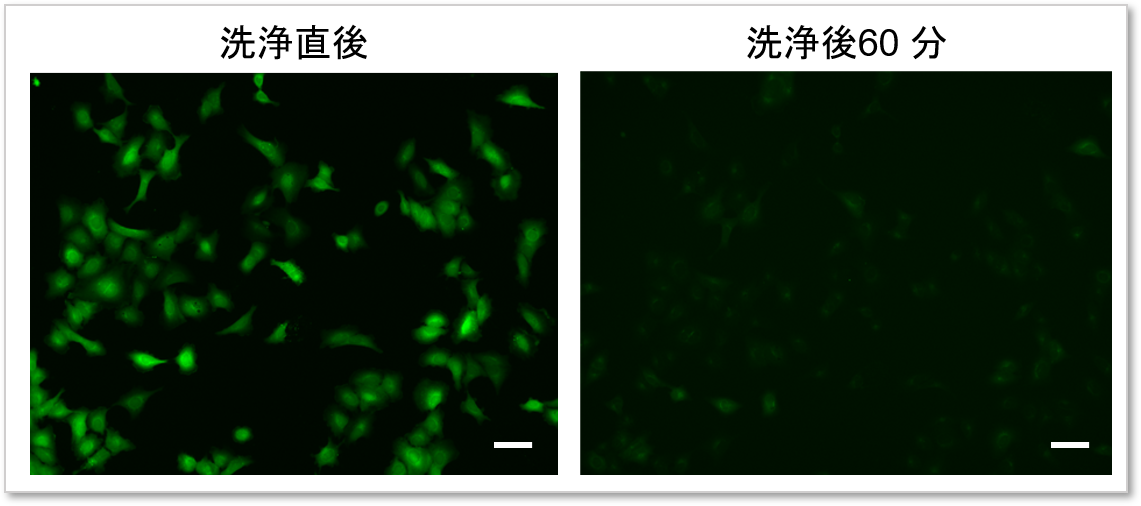
WI Solutionを用いて細胞を洗浄した場合
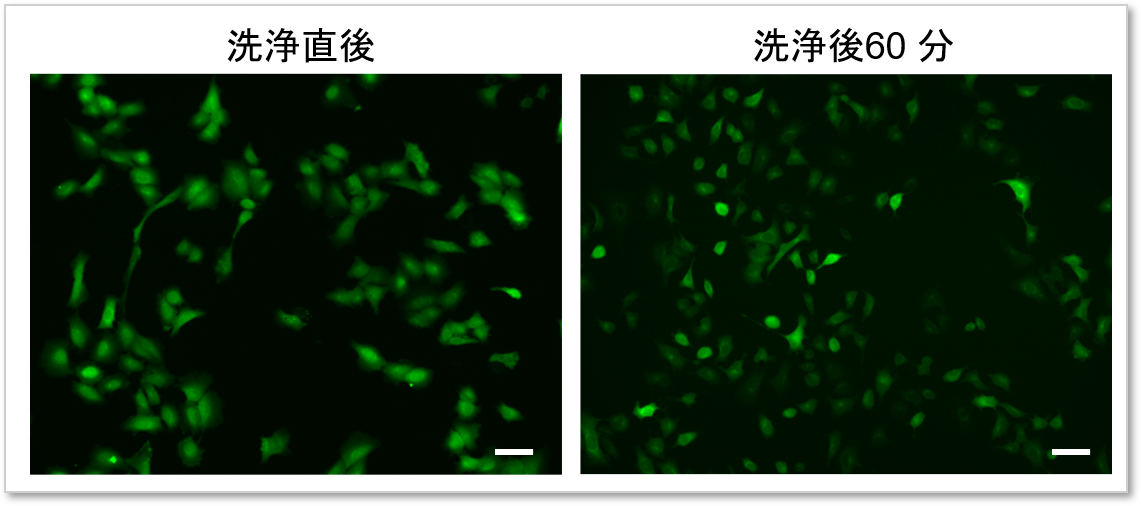
(スケールバー: 50 µm)
<観察条件>
細胞:A549細胞
測定装置:蛍光顕微鏡
フィルターセット:GFP (Ex: 470 / 40 nm, Em: 525 / 50 nm)
既存法との比較
Glucose Uptake Probe-Greenは、2-NBDGと同様に蛍光顕微鏡およびフローサイトメーターにも対応しています。
また、励起波長は2-NBDGと比べて、488 nm励起レーザーやGFP, FITCのフィルターセットに適しています。
Glucose Uptake Probeシリーズと既存品(2-NBDG)の特性の違いは以下の通りです。
| 製品名 | 蛍光顕微鏡 | プレートリーダー検出 | FCM 検出 | 色素の滞留性 | 蛍光特性 |
|---|---|---|---|---|---|
| Glucose Uptake Assay Kit-Blue | 〇 | × | 〇 | 1 時間 ※ | λex:386 nm, λem:474 nm |
| Glucose Uptake Assay Kit-Green | 〇 | 〇 | 〇 | 1 時間 ※ | λex:507 nm, λem:518 nm |
| Glucose Uptake Assay Kit-Red | 〇 | 〇 | 〇 | 1 時間 ※ | λex:560 nm, λem:572 nm |
| 2-NBDG | 〇 | × | 〇 | 30 分以下 ※ | λex:465 nm, λem:540 nm |
※ A549細胞を用いた際の検討結果であり、細胞腫によって漏れ出しの時間は異なります。
Glucose Assay Kitとの違い
Glucose Uptake Assay Kit-GreenとGlucose Assay Kit-WST (製品コード: G264)の違い
1. Glucose Assay Kit-WSTは細胞上清のグルコース消費量を定量することができます。
Glucose Uptake Assay Kit-Greenはグルコースの定量はできません。
2. Glucose Uptake Assay Kit-Greenは短時間のグルコース取り込み能力の差を測定することができます。
Glucose Assay Kit-WSTは短時間のグルコース量の変化は測定することができません。
Glucose Assay Kit-WSTと本キットの違いを下記実験例を用いて説明します。
実験例:グルコース取り込み阻害剤(Cytochalasin B)にて処理したHepG2のグルコース消費量と取り込み能力の測定
実験のフローチャートと実験結果
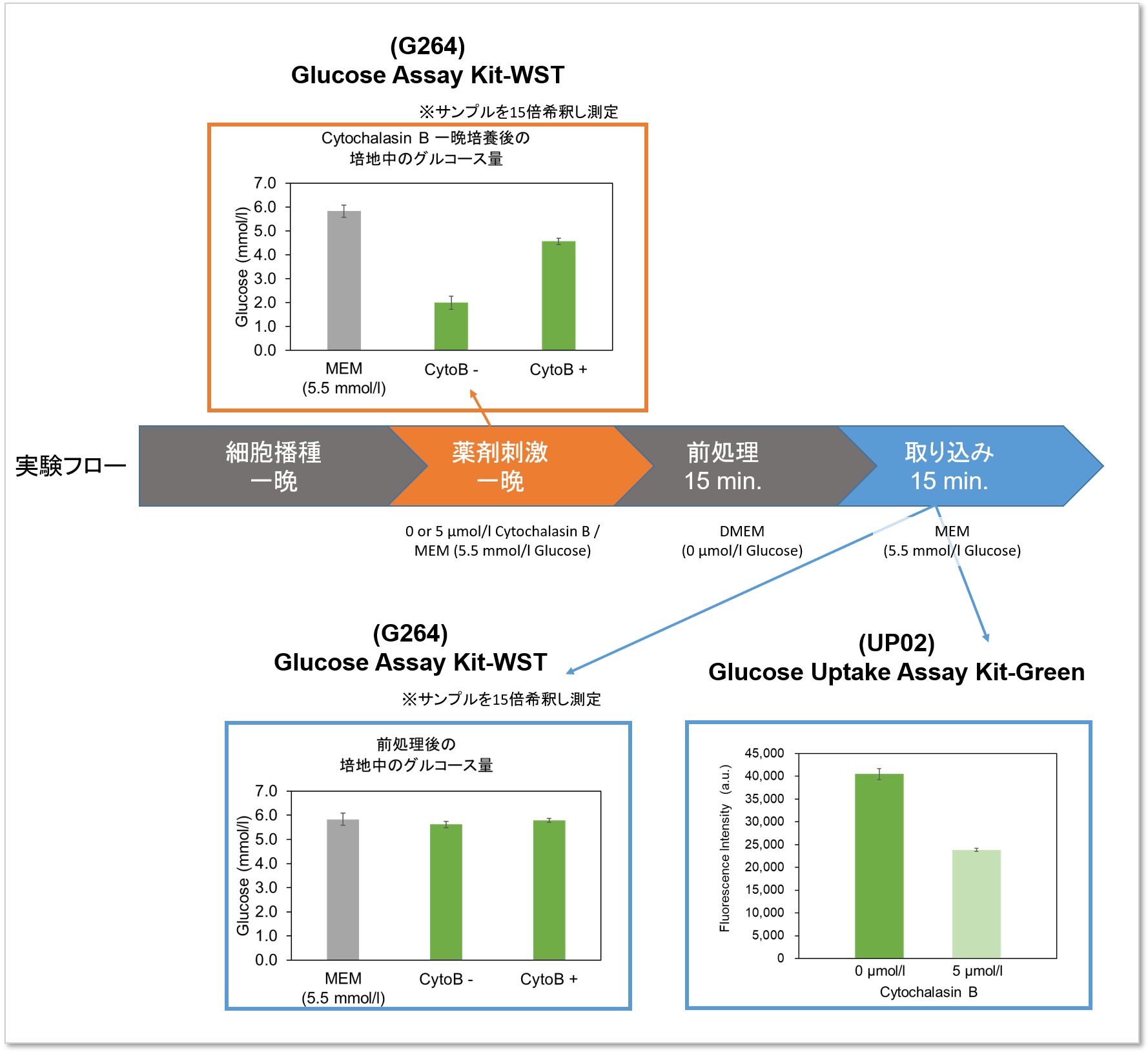
実験例:Cytochalasin Bによるグルコース取り込み阻害
本キットを用いてグルコーストランスポーター阻害剤 Cytochalasin BによるHepG2 細胞のグルコース取り込み阻害を高感度に観察かつ数値化することができました。
蛍光顕微鏡観察
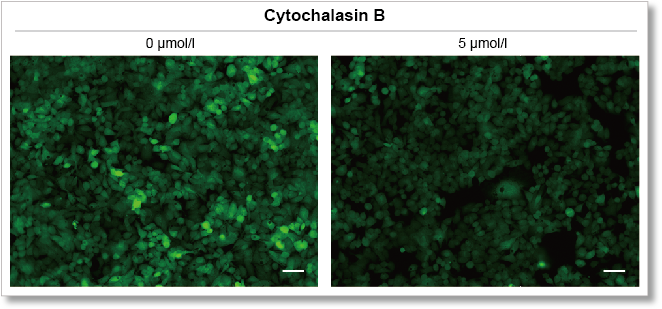
(スケールバー:50 μm)
<測定条件>
細胞:HepG2
使用培地:MEM (5.5 mmol/l Glucose)
培養条件:5 µmol/l Cytochalasin B / MEM (5.5 mmol/l Glucose, 10% FBS), 37℃, 24 hr
染色条件:Glucose Uptake Probe (500倍希釈)/DMEM (0 mol/l Glucose), 37℃, 15 min
検出装置:蛍光顕微鏡 フィルターセット:GFP (Ex: 470 / 40 nm, Em: 525 / 50 nm)
プレートリーダー検出
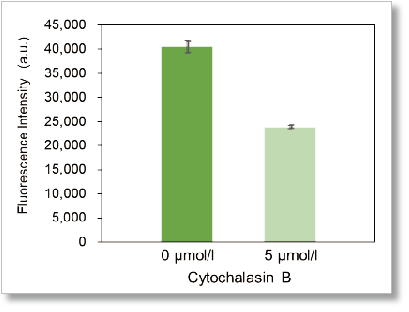
<検出条件>
Ex:488 nm, Em: 520 nm
実験例:インスリンによるグルコース取り込み促進
本キットを用いてインスリンによる脂肪細胞(adipocyte)のグルコース取り込み測定を高感度に観察することができました。
蛍光顕微鏡観察
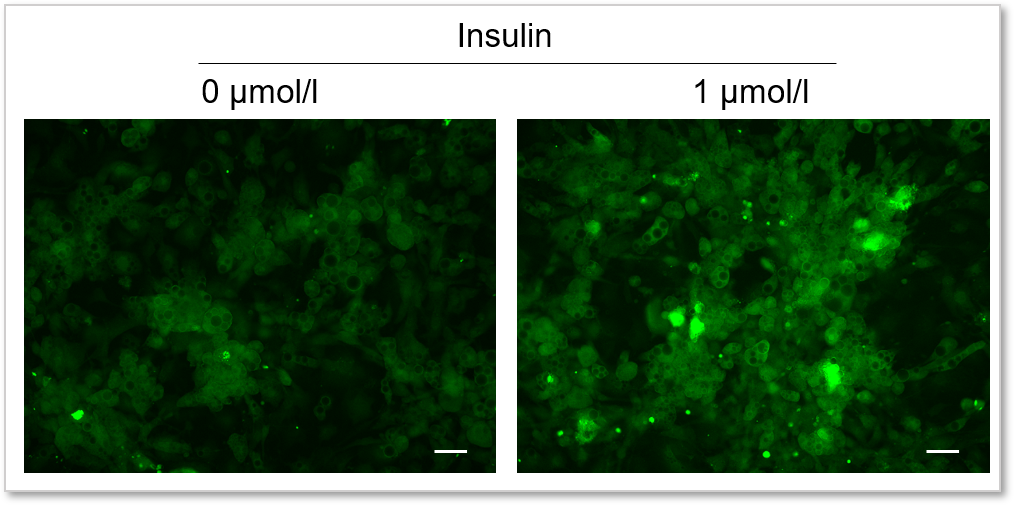
(スケールバー:50 µm)
<測定条件>
細胞: mouse adipocyte
使用培地:DMEM (5.5 mmol/l Glucose, 10% FBS)
刺激条件:0 or 1 µmol/l Insulin / DMEM (0 mmol/l Glucose , serum free), 37℃, 15 min
染色条件:Glucose Uptake Probe-Green (500倍希釈) /DMEM (0 mmol/l Glucose, serum free), 37℃, 15 min
検出装置:蛍光顕微鏡
フィルターセット:GFP (Ex: 470 / 40 nm, Em: 525 / 50 nm)
プレートリーダー検出
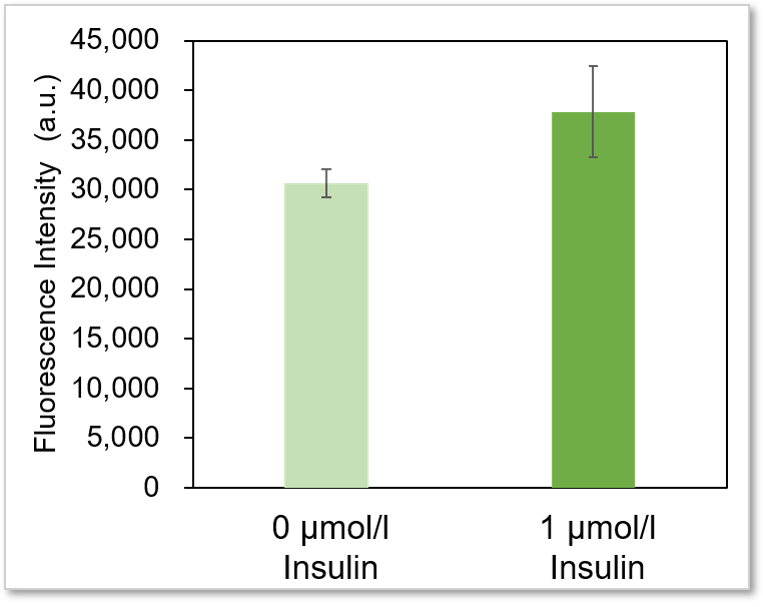
<検出条件>
Ex:488 nm, Em: 520 nm
※adipocyteはウェル上に均一に作成することが困難であるため、データにバラつきが出る場合がございます。
<実験操作>
1. 脂肪細胞をそれぞれibidi 96-well plateに播種し一晩培養した。
2. グルコース不含培地DMEMを用いて細胞を2回洗浄し、グルコース不含培地(0 or 1 µmol/l Insulin)を添加した。
3. 37℃で15分間インキュベートした。
4. グルコース不含培地で500倍希釈したProbe solutionを添加し、37℃で15分間インキュベートした。
5. 4℃に冷やしたWI Solution (1x)を用いて細胞を3回洗浄し、WI Solution (4℃)を添加した。
6. 蛍光顕微鏡とプレートリーダーを用いて、細胞を観察した。
実験例:前駆脂肪細胞と脂肪細胞のグルコース取り込み能力の比較
本キットを用いて前駆脂肪細胞(preadipocyte)と脂肪細胞(adipocyte)のグルコース取り込み能力の差を高感度に観察し数値化することができました。
蛍光顕微鏡観察
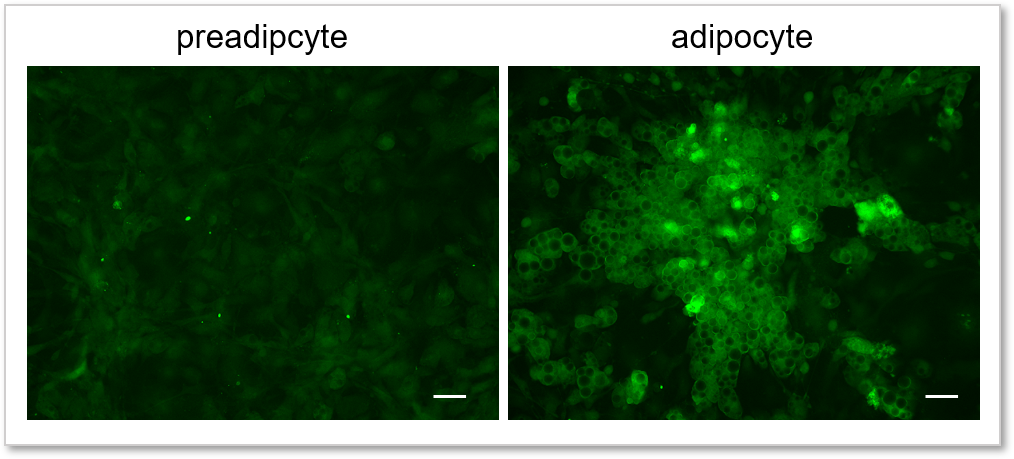
(スケールバー:50 µm)
<測定条件>
細胞: preadipocyte, adipocyte
使用培地:DMEM (5.5 mmol/l Glucose, 10% FBS)
染色条件:Glucose Uptake Probe-Green(500倍希釈) /DMEM (0 mmol/l Glucose, serum free), 37℃, 15 min
検出装置:蛍光顕微鏡
フィルターセット:GFP (Ex: 470 / 40 nm, Em: 525 / 50 nm)
プレートリーダー検出
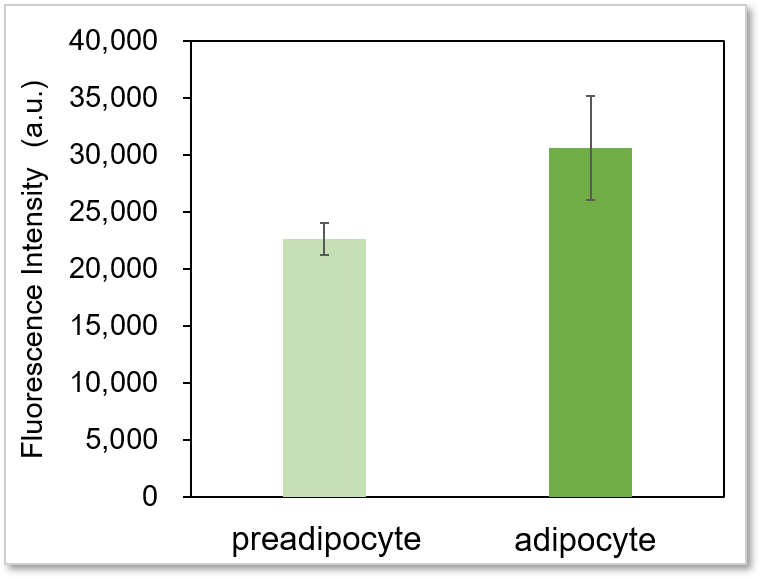
<検出条件>
Ex:488 nm, Em: 520 nm
※adipocyteはウェル上に均一に作成することが困難であるため、データに多少バラつきが出る場合がございます。
<実験操作>
1. 前駆脂肪細胞と脂肪細胞をそれぞれibi 96-well plateに播種し一晩培養した。
2. グルコース不含培地DMEMを用いて細胞を2回洗浄し、グルコース不含培地を添加した。
3. 37℃で15分間インキュベートした。
4. グルコース不含培地で500倍希釈したProbe solutionを添加し、37℃で15分間インキュベートした。
5. 4℃に冷やしたWI Solution (1x)を用いて細胞を3回洗浄し、WI Solution (4℃)を添加した。
6. 蛍光顕微鏡とプレートリーダーを用いて、細胞を観察した。
参考文献
| No. | Sample | Publication |
|---|---|---|
| 1) | 細胞 (HeLa) |
W. Islam, Y. Matsumoto, J. Fang, A. Harada, T. Niidome, K. Ono, H. Tsutsuki, T. Sawa, T. Imamura, K. Sakurai, N. Fukumitsu, H. Yamamoto, H. Maeda., "Polymer-conjugated glucosamine complexed with boric acid shows tumor-selective accumulation and simultaneous inhibition of glycolysis ", Biomaterials., 2021, 269, (-), 120631. |
| 2) | 菌 (B. licheniformis; P. stutzeri) |
M. Jiang, Q. Li, S. Hu, P. He, Y. Chen, D. Cai, Y. Wu, S. Chen, "Enhanced aerobic denitrification performance with Bacillus licheniformis via secreting lipopeptide biosurfactant lichenysin", 2022, doi:10.1016/j.cej.2022.134686. |
| 3) | 細胞 (分化した3T3-L1脂肪細胞) |
Y. Liu, Y. Le, M. Xu, W. Wang, H. Chen, Q. Zhang, C. Wang, " Remodeling on adipocytic physiology of organophosphorus esters in mature adipocytes", Environ. Pollut., 2022, doi:10.1016/j.envpol.2022.119287. |
よくある質問
-
Q
Glucose Uptake Probe-Greenはどのグルコーストランスポーターを介して取り込まれるのでしょうか?
-
A
複数のトランスポーターを介して細胞内へ取り込まれていると推測されますが、各グルコーストランスポーターに対する特異性や親和性に関する詳細なデータはございません。
-
Q
使用実績のある細胞種を教えてください。
-
A
下記の細胞においてプローブの使用実績があります。
細胞 ヒト肺胞基底上皮腺癌細胞 A549 ヒト肝癌由来細胞 HepG2 前駆脂肪細胞 preadipocyte(3T3-L1) 脂肪細胞 adipocyte(3T3-L1) 悪性黒色腫 MO5 マウス筋芽細胞(未分化) C2C12 マウス筋管 C2C12 アストロサイト―マ U-251 MG ヒト子宮頸癌由来細胞 HeLa ルイス肺がん由来細胞 3LL T細胞 CD4+ T cell マウスマクロファージ様株化細胞 J774.1 線虫 N2
-
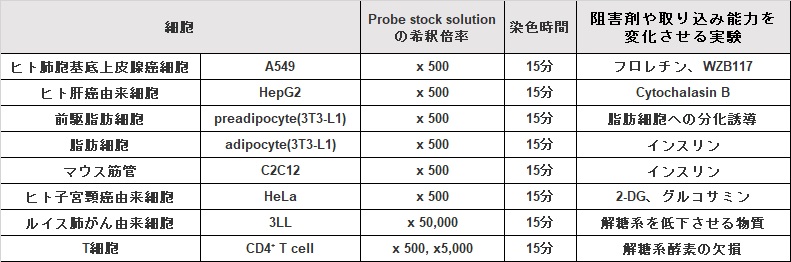
Q
阻害剤や取り込み能力を変化させる実験の実績を教えて下さい。
-
A
下記の細胞において阻害剤や取り込み能力を変化させる実験の実績があります。
-
Q
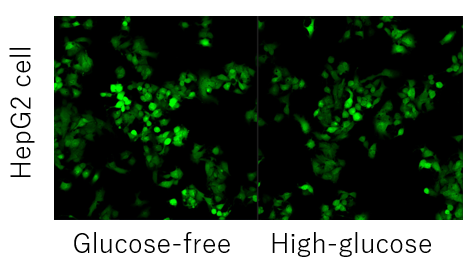
グルコースでの競合阻害ができない場合の対処法はありますか?
-
A
細胞ごとのグルコーストランスポーターの発現量や種類により、競合阻害がかからない場合があります。(例:HepG2細胞)
その場合には、2-deoxyglucose(2-DG)による前処理(Pretreatment)を行うことでglucose競合阻害の差が得られる
可能性があります。下記例を参考にご検討ください。
2-DG前処理とグルコースによる競合阻害を組み合わせた Glucose Uptake Probe の取り込み阻害(HepG2 細胞)1. 細胞をディッシュまたはマイクロプレートに播種し、5% CO2 インキュベーター(37℃)内で一晩培養した。
2. Medium [DMEM (10% FBS, High-glucose) ]を除去した後、50 mmol/l 2-DG/Mediumを添加し、
5% CO2 インキュベーター(37℃)内で二時間培養した。
3. 加温したDMEM (Glucose-free, serum-free)で2 回洗浄した。
4. 加温したDMEM (Glucose-free, serum-free)を添加し、5% CO2 インキュベーター(37℃)内で15 分間静置した。
5. 上清を除去した後、加温したProbe solutionを添加し、5% CO2 インキュベーター(37℃)内で15 分間静置した。
6. 上清を除去した後、冷却したWI Solution (1x) で2 回洗浄した。
7. 上清を除去した後、冷却したWI Solution (1x) を添加し、室温で5 分間静置した。
8. 上清を除去した後、冷却したWI Solution (1x) を添加した。
9. 蛍光顕微鏡で観察した。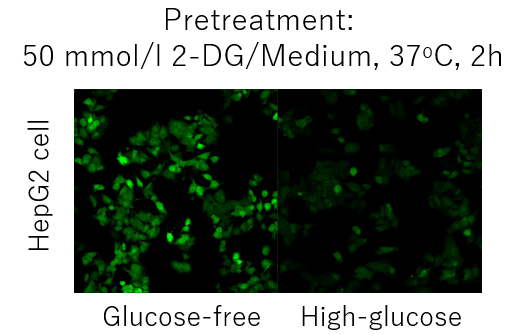
-
Q
Glucose Uptake Probe-Greenは細胞内に取り込まれた後、分解・代謝されるのでしょうか?
-
A
蛍光色素部位は安定な構造を有しているため、実験操作内において分解されることはございません。グルコース部位は、構造上ヘキソキナーゼによるリン酸化を受けることが考えられますが、それ以降の代謝は行われないと考えられます。
-
Q
Glucose Uptake Probe-Greenを生細胞へ取り込ませた後、固定することは可能でしょうか?
-
A
プローブが細胞内から漏出するため、染色後の細胞を固定することはできません。
-
Q
プレートリーダーで測定する場合、どのプレートを使用すればよいでしょうか?
-
A
蛍光検出のため細胞培養用のブラックマイクロプレートをご使用ください。
-
Q
Probe working solutionは保存可能でしょうか?
-
A
Probe working solutionは保存できません。Probe stock solutionは冷凍保存が一か月間可能です。
-
Q
蛍光シグナルの変化が観察されない場合、どうすればいいですか?
-
A
初期検討としてプローブ濃度(x250~x1,000)や染色時間(15分~1時間程度)をご検討下さい。
-
Q
バックグラウンドが高い場合、どうすればいいですか?
-
A
細胞に取り込まれなかったプローブが残存している可能性があります。マニュアルの洗浄操作6-7を繰り返してください。
-
Q
Glucose Uptake Probe-Greenに細胞毒性はありますか?
-
A
弊社製品のCell Counting Kit-8 (CK04)を用いてA549細胞におけるプローブの細胞毒性を調査した結果、細胞毒性は確認されませんでした。
-
Q
WI solutionを用いて洗浄した後、プローブはどのくらいの時間細胞内に保持されますか?
-
A
室温で約1時間程度は細胞内に保持されます。ただし、細胞の種類によって異なることが考えられます。
-
Q
グルコースの定量はできますか?
-
A
本製品を用いてグルコースを定量することはできません。
培地中のグルコース消費量や細胞内のグルコース量を定量したい場合は、弊社 グルコース代謝測定キット Glucose Assay Kit-WST (G264) をご使用下さい。
-
Q
取り込まれた色素の定量はできますか?
-
A
取り込まれた色素の定量を行う事はできません。本色素は、グルコース取り込み能力の増減を確認するための色素となります。
取扱条件
| 保存条件: 冷蔵 |