製品をご使用前にご確認ください
はじめに
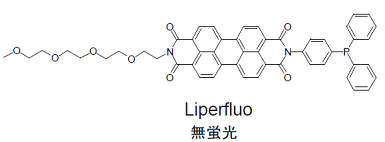
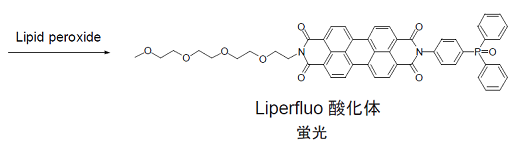
Liperfluoは過酸化脂質検出用の試薬であり、過酸化脂質で特異的に酸化されエタノール等の有機溶媒中で強い蛍光を発します。Liperfluo酸化体の励起波長および蛍光波長はそれぞれ524 nm、535 nmで、測定試料への光によるダメージや試料由来の自家蛍光の影響を軽減できます。本試薬は、ジイソキノリン環の片方にテトラエチレングリコール基が導入されたもので、Spy-LHPよりも水系バッファー中での分散性が向上しています。Liperfluo酸化体は水中ではほとんど蛍光を発しませんが、細胞膜等の脂溶性の高い部位では蛍光性となることから、容易に蛍光顕微鏡による生細胞の過酸化脂質のイメージングやフローサイトメトリーによる細胞の過酸化脂質の分析に使用することができます。
内容
| Liperfluo | 50 μg × 5 |
保存条件
遮光、0-5°Cで保存して下さい。
溶液調製
1 mmol/l Liperfluo DMSO solutionの調製
- Liperfluo 50 μgを含むマイクロチューブに60 μlのDMSOを加え30回程度ピペッティングを1分以内で行う*1,*2。
- マイクロチューブをアルミホイル等で包んで遮光し、約5分間ボルテックスをする※3。
調製後は遮光して、その日のうちにご使用ください。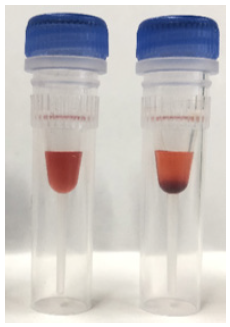
左:溶解できている状態
右:溶け残りがある状態
- Liperfluoは光で分解しやすいため、1分以内を目安にピペッティングをしてください。
- Liperfluoの固体物が底面にある場合、ピペッティングの際にピペットの先端で大きな固体を分散させておくと、ボルテックスで固体が溶解しやすくなります。
- 完全に溶解しない場合、遮光しながら超音波を照射もしくは40℃の水浴で3分間加温して溶解してください。超音波処理の際は、下図のようにチューブ底に空気が入っていない状態で処理を行ってください。

Liperfluo Working solutionの調製
Liperfluoの最適な染色濃度は実験条件によって異なるため、以下の手順に従って調製する。
蛍光顕微鏡観察
1 mmol/l Liperfluo DMSO溶液を無血清培地等で希釈したWorking solutionを使用する。
フローサイトメトリー
1 mmol/l Liperfluo DMSO溶液を測定試料の細胞懸濁液に直接加える。
操作
- 細胞をディッシュ等に播種し培養する。
- 培地を除去後、無血清培地で1回洗浄する。
- 適当な濃度に調製したLiperfluo溶液を添加し、37°C、30分間インキュベートする。
- 実験条件等によりLiperfluoの最適濃度が異なります。最適条件をご検討ください。
- 上澄みを除去後、無血清培地で2回洗浄する。
- 蛍光顕微鏡またはフローサイトメトリーにて測定する。
実験例1
HeLa細胞を用いた共焦点蛍光顕微鏡による観察
- HeLa細胞(3.0×104 cells/well 、血清入りMEM培地)をμ-スライド8ウェル(ibidi社製)に播種し、37°C、5%CO2インキュベーター内で一晩培養した。
- 培地を取り除き、細胞を無血清MEM培地で1回洗浄した。
- 無血清MEM培地で希釈した1 μmol/lのLiperfluo溶液200 μlをウェルに加え、37°C、5%CO2インキュベーター内で30分間静置した。
- 溶液を取り除き、HBSS 200 μlで2回洗浄した。
- HBSSで希釈した500 μmol/lのt-BHP -(tert-buthyl hydroperoxide)溶液をウェルに200 μl添加し、37°C、5%CO2インキュベーター内で60分間静置した。
- 共焦点蛍光顕微鏡で観察した(励起波長:488 nm、蛍光波長:500-550 nm)
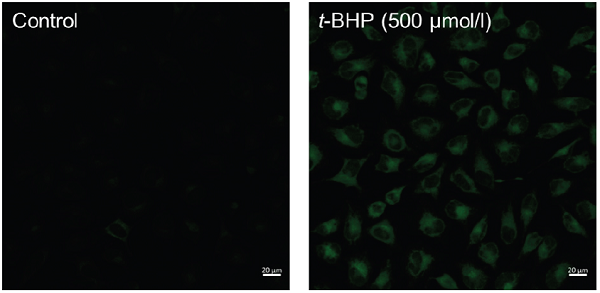
Hela細胞における過酸化脂質のイメージング
実験例2
HeLa細胞を用いたフローサイトメーターによる測定
- HeLa細胞(1.0×105 cells/well 、血清入りMEM培地を6ウェルプレート(Thermo社製)に播種し、37°C、5%CO2インキュベーター内で一晩培養した。
- 培地を取り除き、細胞を無血清MEM培地で1回洗浄した。
- 無血清MEM培地で希釈した1 μmol/lのLiperfluo溶液2 mlをウェルに加え、37°C、5%CO2インキュベーター内で30分間静置した。
- 溶液を取り除き、HBSS 2 mlで2回洗浄した。
- HBSSで希釈した500 μmol/lのt-BHP -(tert-buthyl hydroperoxide)溶液をウェルに2 ml添加し、37°C、5%CO2インキュベーター内で60分間静置した。
- トリプシン処理により細胞をはがした後、血清入りMEM培地でマイクロチューブに回収しHBSSに置換した。
- フローサイトメーターで測定した。 ( 励起波長:488 nm、蛍光波長:515-545 nm)
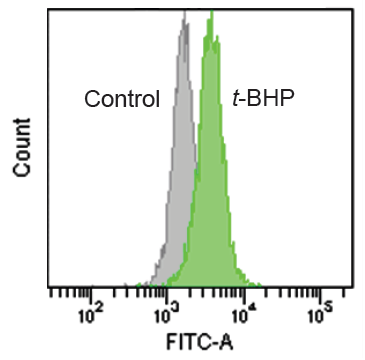
Liperfluo を用いた過酸化脂質の定量
実験例3
Erastinを用いてフェロトーシスを誘導した細胞での蛍光イメージング
- A549細胞(1.0×105 cells/well 、血清入DMEM培地)をμ-スライド8ウェル(ibidi社製)に播種し、37°C、5%CO2インキュベーター内で一晩培養した。
- 培地を取り除き、無血清DMEM培地で希釈した50 μmol/lのErastin溶液200 μlをウェルに加え、37°C、5% CO2インキュベーター内で一晩静置した。
- 培地を取り除き、HBSS 200 μlで2回洗浄した。
- HBSSを取り除き、HBSSで希釈した5 μmol/lのLiperfluoL溶液200 μlをウェルに加え、37°C、5%CO2インキュベーター内で30分間静置した。
- 溶液を取り除き、HBSS 200 μlで2回洗浄した。
- 共焦点蛍光顕微鏡で観察した(励起波長:488 nm、蛍光波長:500-550 nm) 。
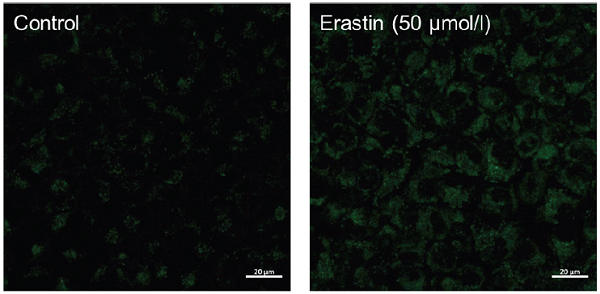
A549 細胞における Erastin刺激による過酸化脂質のイメージング
シスチントランスポーター阻害剤である Erastin で処理することによりフェロトーシスを誘導した細胞内の過酸化脂質が増加することを確認した。
蛍光特性
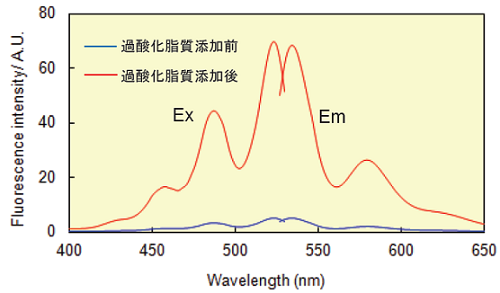
過酸化脂質による Liperfluo の励起および蛍光スペクトル変化 (エタノール溶媒中)
L248_2: Liperfluo
Revised Mar., 01, 2024


 を押して省略できます。
を押して省略できます。