SOD Assay Kit - WST
抗酸化能測定キット
-
製品コードS311 SOD Assay Kit - WST
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 100 tests | ¥10,800 | 341-90193 |
| 500 tests | ¥27,800 | 345-90191 |
| 100 tests | ・WST Solution ・Enzyme Solution ・Buffer Solution ・Dilution Buffer |
1 ml x 1 20 μl x 1 11 ml x 2 10 ml x 1 |
|---|---|---|
| 500 tests | ・WST Solution ・Enzyme Solution ・Buffer Solution ・Dilution Buffer |
5 ml x 1 100 μl x 1 100 ml x 1 50 ml x 1 |
-

食品機能評価 微生物検出 食品機能評価、微生物検出関連の製品を一冊に集約。
〇食品機能評価・抗酸化能測定・ACE阻害性活性・脂肪滴染色蛍光試薬・老化細胞検出
〇微生物検出・微生物染色試薬・微生物増殖アッセイキット
性質
活性酸素種(ROS:Reactive Oxygen Species)は、DNAやタンパク質と反応し、化学修飾するため、老化や発癌との関わりがあると考えられ、活発な研究が行われている。中でも活性酸素の一つであるスーパーオキシドを消去する、superoxide dismutase (SOD)およびSOD様物質が注目されている。SODは以下のスーパーオキシドの不均化反応を触媒する酵素であり、スーパーオキシドに由来する酸化ストレスを減少させる役割がある。
2O2- + 2H+ → H2O2 + O2
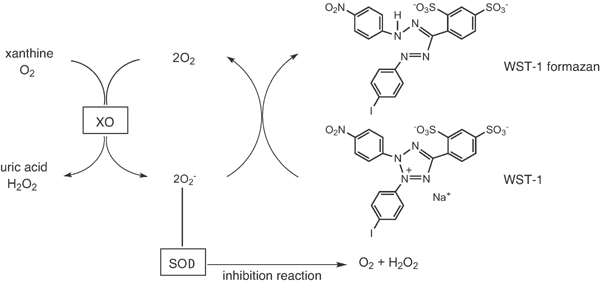
SOD Assay Kit-WSTは、高水溶性ホルマザンを生成するテトラゾリウム塩WST-1を使用しているため、NBT法の様なホルマザンの溶解操作は不必要である。また、WST-1はxanthine oxidase(XO)と直接反応しないため、100% SOD阻害率を測定することができる。また96穴マイクロプレート対応なので、一度に多検体の測定が可能である。
測定波長:450 nm
特 長
1) 100% SOD阻害率を測定することができる。
2) ホルマザンの溶解操作が不要で、操作が簡単である。
3) 一度に多検体の測定が可能である。
4) 高感度であり、サンプルの希釈倍率を高くすることができるため、妨害物質の影響を抑えることができる。
詳しい使用法は、プロトコル「SOD様活性を測定したい」を参照。
| 開発元 | Dojindo Molecular Technologies, Inc. |
|---|
技術情報
測定方法
96wellプレートを用い、サンプル調製から測定まで約1時間で完了します。
キット以外に必要なもの
・2~20 μlと20~200 μlのマルチチャンネルピペット ・インキュベーター(37℃)
・プレートリーダー(450 nmフィルター) ・96穴マイクロプレート
食品の抗酸化能の測定
呼吸や様々な外的要因より発生した活性酸素の多くは、生体機能を低下させ、各種疾病の発症や老化を促進させることが分かっています。
これらのストレスに対する防御作用(抗酸化能)を持つ物質は多数報告されており、食品の持つ抗酸化能を利用した健康維持、疾病の予防に関する研究が注目を集めています。

測定例
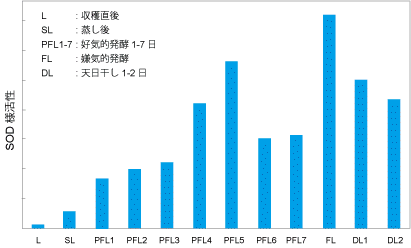
高知大学の島村らは碁石茶(ゴイシチャ)の製造工程毎にSOD様活性をキットで測定しています。
製造工程中で微生物が関与する好気的発酵、および嫌気的発酵でSOD様活性が大きく増加し、発酵工程中の茶抽出成分の変化による抗酸化能の変化を報告されています。
島村, “碁石茶製造工程におけるカテキン含量とスーパーオキシドアニオン消去活性の変化”, 日本食品科学工学会誌, 55(12), 640
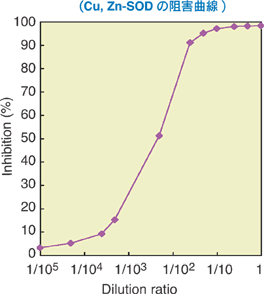
阻害曲線例
Wavelength:450 nm
参考文献
1) H. Ukeda, A. K. Sarker, D. Kawana and M. Sawamura, "Flow-Injection Assay of Superoxide Dismutase Based on the Reduction of Highly Water-Soluble Tetrazolium", Anal. Sci., 1999, 15, 353.
2) H. Ukeda, D. Kawana, S. Maeda and M. Sawamura, "Spectrophotometric Assay for Superoxide Dismutase Based on the Reduction of Highly Water-soluble Tetrazolium Salts by Xanthine-Xanthine Oxidase", Biosci. Biotechnol. Biochem., 1999, 63, 485.
3) <受田浩之, 森山洋憲, 川名大介, 片山泰幸, 中林錦一, 沢村正義, 「スーパーオキシドアニオン消去活性新規測定法の食品への応用」, 日本食品科学工学会誌, 2002,49, 25.
4) <森山洋憲, 片山泰幸, 中林錦一, 受田浩之, 沢村正義, 「高知県産茶および青果物の有するスーパーオキシドアニオン消去能の測定」, 日本食品科学工学会誌, 2002,49, 679.
5) H. Ukeda, T. Shimamura, M. Tsubouchi,Y. Harada, Y. Nakai and M. Sawamura, "Spectrophotometric Assay of Superoxide Anion Formed in Maillard Reaction Based on Highly Water-soluble Tetrazolium Salt", Anal. Sci., 2002, 18, 1151.
6) N. Tsuji, N. Hirayanagi, M. Okada, H. Miyasaka, K. Hirata, M. H. Zenk and K. Miyamoto, "Enhancement of Tolerance to Heavy Metals and Oxidative Stress in Dunaliella Tertiolecta by Zn-induced Phytochelatin Synthesis", Biochem. Biophys. Res. Commun., 2002, 293, 653.
7) A. Sakudo, D. C. Lee, K. Saeki, Y. Nakamura, K. Inoue, Y. Matsumoto, S. Itohara and T. Onodera, "Impairment of Superoxide Dismutase Activation by N-Terminally Truncated Prion Protein (PrP) in PrP-deficient Neuronal Cell Line", Biochem. Biophys. Res. Commun., 2003, 308, 660.
8) J.-H. Zhu, X. Zhang, J. P. Mcclung and X. G. Lei, "Impact of Cu,Zn-Superoxide Dismutase and Se-Dependent Glutathione Peroxidase-1 Knockouts on Acetaminophen-Induced Cell Death and Related Signaling in Murine Liver", Exp. Biol. Med., 2006, 231, 1726.
9) H. R. Rezvani, S. Dedieu, S. North, F. Belloc, R. Rossignol, T. Letellier, H. de Verneuil1, A. Taieb1, F.Mazurier, "HIF-1α: a Key Ffactor in the Keratinocyte Response to UVB Exposure", J. Biol. Chem., 2007, 10, 1074.
10) S. Goldstein and G. Czapski, "Comparison Between Different Assays for Superoxide Dismutase-like Activity", Free Rad. Res. Comms., 1991, 12, 5.
11) R. H. Burdon, V. Gill and C. Rice-Evans, "Reduction of a Tetrazolium Salt and Superoxide Generation in Human Tumor Cells (HeLa)", Free Rad. Res. Commun., 1993,18, 369.
12) Y. Sakurai, I. Anzai and Y. Furukawa, "A Primary Role for Disulfide Formation in the Productive Folding of Prokaryotic Cu,Zn-superoxide Dismutase", J. Biol. Chem., 2014, 289(29), 20139.
13) A. Weichert, A. S. Besemer, M. Liebl, N. Hellmann, I. Koziollek-Drechsler, P. Ip, H. Decker, J. Robertson, A. Chakrabartty, C. Behl and A. M. Clement, "Wild-type Cu/Zn superoxide dismutase stabilizes mutant variants by heterodimerization", Neurobiol. Dis., 2014, 62, 479.
14) J. M. Hartney, T. Stidham, D. A. Goldstrohm, R. E. Oberley-Deegan, M. R. Weaver, Z. Valnickova-Hansen, C. Scavenius, R. K.P. Benninger, K. F. Leahy, R. Johnson, F. Gally, B. Kosmider, A. K. Zimmermann, J. J. Enghild, E. Nozik-Grayck and R. P. Bowler, "A common polymorphism in extracellular superoxide dismutase affects cardiopulmonary disease risk by altering protein distribution", Circ Cardiovasc Genet, 2014, 7(5), 659.
15) J. Wu, Y. Sun, Y. Zhao, J. Zhang, L. Luo, M. Li, J. Wang, H. Yu, G. Liu, L. Yang, G. Xiong, J. Zhou, J. Zuo, Y. Wang and J. Li, "Deficient plastidic fatty acid synthesis triggers cell death by modulating mitochondrial reactive oxygen species", Cell Res., 2015, 25(5), 621.
16) E. Harunari, C. Imada, Y. Igarashi, "Konamycins A and B and Rubromycins CA1 and CA2, Aromatic Polyketides from the Tunicate-Derived Streptomyces hyaluromycini MB-PO13T'", J. Nat. Prod., 2019, 82, (6), 1609-1615.
17) N. Kajihara, D. Kukidome, K. Sada, H. Motoshima, N. Furukawa, T. Matsumura, T. Nishikawa and E. Araki, "Low glucose induces mitochondrial reactive oxygen species via fatty acid oxidation in bovine aortic endothelial cells", J Diabetes Investig, 2017, 8, (6), 750.
18) H- J. Kim, H- J. Kim, J. Jeon, K- C. Nam, K- S. Shim, J- H. Jung, K. S. Kim, Y. Choi, S- H. Kim, A. Jang, Comparison of the quality characteristics of chicken breast meat from conventional and animal welfare farms under refrigerated storage', Poultry Science., 2020, 99, 1788-1796.
19) T. Shoji, S. Masumoto, N. Moriichi, Y. Ohtake, T. Kanda, Administration of Apple Polyphenol Supplements for Skin Conditions in Healthy Women: A Randomized, Double-Blind, Placebo-Controlled Clinical Trial', Nutrients., 2020, 12, (1071), .
20) Y. Hirata, Y. Ito, M. Takashima, K Yagy, K. Oh-Hashi, H. Suzuki, K. Ono, K. Furuta and M. Sawada, Novel Oxindole-Curcumin Hybrid Compound for Antioxidative Stress and Neuroprotection.', ACS Chem. Neurosci.., 2020, 11, (1), 76-85.
よくある質問
-
Q
SOD様活性と試薬の発色の関係について教えてください。
-
A
SOD様活性が強いと試薬の発色は弱くなります。また、SOD様活性が弱いと試薬の発色は強くなります。下記をご参照ください。
<キットの原理>
WST-1はスーパーオキサイド(以下、2O2-)によって還元されることで、WST-1 formazanに変化し発色します。SOD様活性を持つ物質がサンプル中に存在するとキサンチンオキシダーゼ(XO)を介して発生する2O2-を除去しますので、還元されるWST-1の量が少なくなります。2O2-がWST-1の還元に使われるか、SOD様活性により除去されるかの競争反応により発色の度合いが変化します(下図)。併せて製品ページの「技術情報:測定原理」もご参照ください。
・SOD様活性が弱い場合

・SOD様活性が強い場合

-
Q
Mn-SODとCu, Zn-SOD 及びEC(extracellular)-SODの測り分けはできますか?
-
A
サンプル溶液にKCN(potassium cyanide)またはDDC(Diethyldithiocarbamate)を添加することでCu, Zn-SOD 及びEC(extracellular)-SODの活性を阻害し、Mn-SOD の活性が測定できます。
【測定例】
・SODのサンプル溶液にKCNまたはDDCを終濃度が1-10 mmol/l となるように添加し、室温にて5分間インキュベートする。
・インキュベート後の溶液(20 μl)を用いて、SOD Assay Kit-WSTのマニュアルに従ってSOD様活性を測定する。*注意点*
・KCNやDDCの濃度およびインキュベーション時間は、サンプルによって検討が必要となります。下記の論文を参考してください。
・ユニット(U)算出の際は、KCN又はDDC添加により希釈されたサンプルの希釈倍率を考慮して計算して下さい。
1) Greenough MA, Volitakis I, Li QX, Laughton K, Evin G, Ho M, Dalziel AH, Camakaris J, Bush AI, “Presenilins promote the cellular uptake of copper and zinc and maintain copper chaperone of SOD1-dependent copper/zinc superoxide dismutase activity”, J Biol Chem., 2011, 286, 9776.2) Hajime Fujimoto, Jun-ichi Taguchi, “Manganese superoxide dismutase polymorphism affects the oxidized low-density lipoproteininduced apoptosis of macrophages and coronary artery disease.”, European Heart Journal. 2008. 29, 1267.
3) A. Dacanay, S. C. Johnson, R. Bjornsdottir, R. O. Ebanks, N. W. Ross, M. Reith, R. K. Singh, J. Hiu, and L. L. Brown, "Molecular Characterization and Quantitative Analysis of Superoxide Dismutases in Virulent and Avirulent Strains of Aeromonas salmonicida subsp. salmonicida"Journal of Bacteriology, 2003, 185 (15), 4336.
1) Heikkila RE, Cabbat FS, Cohen G. “In vivo inhibition of superoxide dismutase in mice by diethyldithiocarbamate”, J Biol Chem., 1976, 251, 2182.
-
Q
SODキットを使用して、測定した際の[unit]算出の方法はどのようにすればよいのでしょうか?
-
A
SOD活性の定義としましては、チトクロムc法の時も同様ですが、「IC50=1U:発色を50%阻害する時のSODの活性を示す濃度」になります。
このキットでの1Uの定義は、「WSTの発色を50%阻害する時のSODの活性」です。
従って、サンプルを希釈していき、IC50の時の希釈倍率のSODの活性が1Uです。「U」は「単位」ですので、これを「量」に換算します。
この時、タンパク量を容量で算出するのか、重量で算出するのかで、1U/mlもしくは1U/mg proteinと表示します。
カタログに記載している阻害曲線は、活性既知のSODを希釈し測定しています。
たまたまIC50値が1U/ml付近になっています。
<50%阻害するサンプル濃度を1Uとする方法:ユニットをWST法として表現>
例:サンプルのIC50値の希釈倍率を x10.75 とする。(このキットでは測定に使用するサンプル量が20μl、全量が240μl)
IC50を示す測定時のサンプル希釈率は「10.75倍」になります。
-->『10.75倍に希釈された液、「20 μl中」に存在する SOD 量が1単位である』
となります。単位で考えると、測定時のものが「1U」ですので、希釈前サンプルは「10.75U」 となります。
アッセイで添加したのは20 μ (0.02 ml)ですので、サンプル 1 mlあたりのunit数を計算する。
アッセイで添加する20 μl中に1単位含まれるので
10.75/0.02 = 537.5 U/mlSOD抽出過程(前処理)で希釈が生じていれば、元々の試料の活性は前処理での希釈を計算して
希釈率x537.5 = ○ U/ml of サンプルとなります。
*ここでは容量に換算しております。
例えば:血液であれば 「○ U/ml of blood」など
タンパク量や質量(mg)に換算したい場合は、さらに別途換算してください。
-
Q
酸化ストレスの指標としてSOD様活性はよく測定されますが、 SOD様活性の他に酸化ストレスマーカーとなるものはありますか?
-
A
酸化ストレスマーカーについてまとめた資料を作成しております。
カスタマーサポートの視点から、各酸化ストレスマーカーの特徴・測定サンプルの前処理方法などを記載しておりますので、ご参照ください。下記URLよりダウンロード可能です。
-
Q
SOD様活性を測定する方法としてはどのようなものがありますか?
-
A
一番一般的に知られている方法は
・チトクロムc法です。その他
・NBT法
・エピネフリン法
・亜硝酸法
・ESR法
などが知られております。
NBT法はxanthine/xanthine oxidaseをスーパーオキサイド産生系とし、テトラゾリウム塩の還元反応を利用しており、操作が簡便であることから汎用されております。
しかし、生成するホルマザンが不溶性の沈殿物であることやNBTがxanthine oxidaseと直接反応することから100%阻害率を測定できないなどの問題がありました。
弊社のWST法は、発色基質として「WST-1」を使用しこれらの問題を解決しております。
(測定原理はNBTと同様とお考え下さい)
-
Q
superoxideとWST-1の反応の阻害が0(発色が100%)となるところが全く発色しません。酵素(Xanthine oxidase)が失活しているのでしょうか?
-
A
酵素(Xanthine oxidase)は失活していなくても、働いていない場合があります。酵素溶液は懸濁液になっていますので静置して置くと酵素が沈んでしまいます。良く振ってからご使用ください。上澄みだけを取ってしまうとsuperoxideは全く発生しませんので発色もしません。
-
Q
脂溶性成分は測定できますか?
-
A
本キットは水溶性サンプルの測定を主な対象としており、水に溶解できないサンプルは測定出来ません。なお、脂溶性物質を低濃度域で溶解可能な場合は、DMSOやエタノールに一度溶解後、蒸留水やPBSで出来る限り希釈し、測定してください。
注意①サンプル中にDMSOは5%、エタノールは25%含まれますと測定に影響します。溶媒濃度を測定に影響しない濃度まで希釈しご使用ください。注意②検討の際は、必ずBlank2とBlank3を測定し、誤発色等の影響がないかご確認ください。
-
Q
SOD Assay Kit - WSTは食品等の測定も可能となっておりましたが、 必要な前処理の方法を教えて下さい。
-
A
下記のような方法により処理し、測定を行うことが出来ます。
<茶葉>
茶葉資料10 gに蒸留水400 mlを加えてホモジナイズ処理し、5 ℃で48時間静置して抽出し、ろ過(No.2:アドバンテック東洋(株))した後、さらにメンブレンフィルター(pore size 0.45μm:富士フィルム(株))で処理する。
<ワイン>
直接メンブランフィルターでろ過し、測定試料とする。
緑茶や赤ワイン等はそのもの自体に着色がありますが、100倍程度に希釈すると測定に対する色の影響は回避できます。
<植物・野菜類>
1)蒸留水(野菜の重量に対し5倍量程度)で4 ℃、1分間ホモジナイズする。
2)ホモジネートをろ紙でろ過し、ろ液(水での抽出物)を凍結乾燥する。
3)凍結乾燥したものを0.1 mol/lリン酸バッファー(pH7.4)に溶かし、これを測定試料とする。溶かしたものはなるべく早く使用する。
*上記試料により得られた活性値は、水による抽出物の凍結乾燥後の重量もしくはホモジナイズ前の野菜重量当りの活性値とする。【参考文献】
日本食品科学工学会誌,2002, 49(1),25~31.
日本食品科学工学会誌,2002, 49(10),679~682.-注-
食品中にはキットのに使用している色素を直接発色させてしまう還元物質が多く存在します。これまで得られている報告では20~100倍に希釈する事によりその影響を押さえることが出来ております。
-
Q
測定に影響を与える物質にはどのようなものがありますか?
-
A
アスコルビン酸、グルタチオン(還元型)など還元性物質は正誤差を与えます。
これらの物質が下記の濃度存在した場合10%程度の吸光度の上昇が認められますが、
吸光度の上昇は[blank2]として差し引くことにより影響は回避できます。
・ascorbic acid:0.1 mmol/l・glutathione,reduced form:5 mmol/l
・bovine serum albumin(BSA):5% w/v
(BSAは吸光度の上昇は見られませんが、SOD様活性を示しますのでこれよりも高濃度にならないようにして下さい)
-
Q
組織の前処理に使用するショ糖緩衝液はどのように調製すればよいですか?
-
A
下記の調製例をご参照ください。
<ショ糖緩衝液 1000mlを調製する場合>
試薬 使用量(モル濃度) ショ糖 85.57 g(0.25 mol/l) 2-Amino-2-hydroxymethyl-1,3-propanediol
(トリス緩衝剤)1.21 g(0 mmol/l) 2NA(EDTA・2Na) 372 mg(1 mmol/l) 上記3種類の試薬を800 ml程度の純水に加えて溶解させ、攪拌しながら塩酸を加えてpH 7.4に調整する。
その後、純水を加え全量1000 mlとする。
取扱条件
| 保存条件: 冷蔵 | |
|
危険・有害 シンボルマーク |

|
|---|---|