はじめに
過酸化脂質は活性酸素によって不飽和脂肪酸が酸化されたものです。発生した過酸化脂質は、さらに脂質を酸化させるため、連鎖的に過酸化脂質量は増加していきます。発生した過酸化脂質は、Acrolein, Malondialdehyde (MDA),4-hydroxy-2-nonenal (4-NHE) などの反応性の高いアルデヒドに分解し、細胞毒性や細胞死を引き起こすことが知られています。また、二価鉄が多く存在すると、活性酸素と二価鉄が反応することで脂質から過酸化脂質が発生し、鉄依存的な細胞死であるフェロトーシスを誘発します1)。このように、脂質の過酸化は生体に様々な影響を与え、動脈硬化などの疾病を引き起こします。
Lipid Peroxidation Probe -BDP 581/591 C11- は過酸化脂質の形成を検出することができる蛍光色素です。本蛍光色素は、過酸化脂質とは応答しませんが、脂質が過酸化される経路中に発生する脂質ラジカルなどと反応するため、結果的に過酸化脂質の発生を検出することができます。本蛍光色素は常時、赤色の蛍光を発していますが、過酸化脂質の発生に伴って赤色から緑色の蛍光に変化します。赤色と緑色の2 色で検出することが可能なため、高感度に過酸化脂質の形成を検出することが可能です。
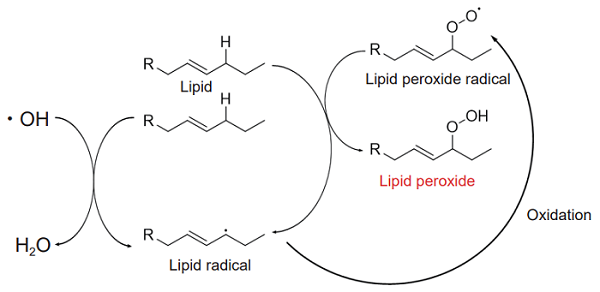
図1 過酸化脂質の発生メカニズム
内容
| Lipid Peroxidation Probe BDP 581/591 C11 | 200 tests x 1 本 |
保存条件
遮光、冷暗所にて保存して下さい。
必要なもの
- 蛍光検出器 ( 蛍光顕微鏡、蛍光プレートリーダーもしくはフローサイトメーター)
- インキュベーター(37℃ )
- コニカルチューブ
- Dimethyl sulfoxide (DMSO)
- マイクロピペット(100–1000 μl, 20–200 μl, 1–10 μl)
- Hanks' balanced salt solution (HBSS)
使用上のご注意
- 輸送中の振動等により、内容物がマイクロチューブ壁面やスクリューキャップ裏面に付着している場合がありますので、開封前に内容物を底面に落としてからご使用ください。
- 検出器毎の推奨測定波長は表1 を参照してください。
| 検出器 | 蛍光プレートリーダー | 蛍光顕微鏡 |
フローサイトメーター |
| 蛍光色:Green | Ex/Em:480-500/520-540 nm |
・共焦点レーザー顕微鏡 |
FITC フィルター |
| 蛍光色:Red | EX/Em:550-570/590-610 nm | ・共焦点レーザー顕微鏡 Ex/Em: 561/600-630 nm ・落射顕微鏡 Texas RedもしくはCy3フィルター |
Cy3 フィルター |
溶液調製
BDP 581/591 C11 DMSO stock solution の調製
Lipid Peroxidation Probe -BDP 581/591 C11- を含むチューブに20 μl のDMSO を加えピペッティングにより溶解する。ピペッティング操作により確実に溶解する。
- 調製後は遮光し、-20℃で保存してください ( 1ヶ月間安定)。
BDP 581/591 C11 working solution の調製
BDP 581/591 C11 DMSO stock solutionを無血清培地で2000倍希釈し、BDP 581/591 C11 working solutionを調製する。
- 無血清培地が細胞ダメージに影響する場合には、血清含有培地への変更も可能です。血清含有培地を使用する場合には1000倍希釈を推奨します。
- 使用する薬剤によって血清の有無が影響する場合がございます。詳細はFAQ「Working solutionの調整時に血清は影響しますか?」をご参照ください。
- 細胞種によって最適濃度が異なる場合がございます。濃度検討の詳細はFAQ「最適濃度の検討について教えてください。」をご参照ください。
- working solution は保存できません。調製したその日の内にご使用ください。容器ごとの必要量は表2 を参照してください。
| 容器 | 35-mm dish | ibidi 8-well plate | 96-well black plate (clear bottom) |
Sample tube (Flow cytometer ) |
| 必要量 | 2 ml/dish | 200 μl/well | 100 μl/well | 0.5 ml/sample |
操作
- 表3 を参考に細胞をディッシュまたはプレートに播種し、5% CO2 存在下、37℃設定のインキュベーター内で一晩培養する。
表3 検出器別 細胞播種容器 検出器 蛍光プレートリーダー 蛍光顕微鏡 フローサイトメーター 容器 96-well black plate (clear bottom) 96-well black plate (clear bottom)
ibidi 8-well plate
35 mm dish6-well plate - 培地を取り除き、培養培地を用いて細胞を2 回洗浄する。
- 上清を除去し、調製したworking solution を添加し、インキュベーター(37℃ , 5% CO2 存在下) で30 分間インキュベートする。
- working solution を除去し、HBSS を用いて細胞を2 回洗浄する。
- 上清除去後、薬剤等で処理する。
- 上清を吸引除去しHBSS を用いて細胞を2 回洗浄後、HBSS を加え検出器で測定する。
- 薬剤処理後に色素で染色することも可能です。その場合は操作3. と操作5. の順番を逆にしてください。
実験例1
t-BHP (tert-butyl hydroperoxide) 処理したHepG2 細胞の過酸化脂質形成の検出
- ibidi 8-well plate、96-well black plate (clear bottom) もしくは6-well plate にHepG2 細胞 (2×105 cells/ml,MEM, 10% fetal bovine serum, 1% penicillin-streptomycin) を播種し (ibidi 8-well plate: 200 μl/well, 96-well black plate (clear bottom): 100 μl/well, 6-well plate: 2 ml/well)、インキュベーター内 (37℃、 5% CO2 存在下) で一晩培養した。
- 培地を取り除き、MEM 培地で細胞を2 回洗浄した。
- 上清を取り除き、BDP 581/591 C11 working solution を加え(ibidi 8-well plate: 200 μl/well, 96-well black plate (clear bottom): 100 μl/well, 6-well plate: 2 ml/well)、インキュベーター内(37℃、5% CO2 存在下) で30 分間インキュベートした。
- 上清を取り除きHBSS で細胞を2 回洗浄後、200 μmol/l t-BHP/HBSS 溶液を添加し(ibidi 8-well plate: 200 μl/well, 96-well black plate (clear bottom): 100 μl/well, 6-well plate: 2 ml/well)、インキュベーター内(37℃、 5% CO2 存在下) で2 時間インキュベートした。
- 上清を除去し、HBSS を用いて細胞を2 回洗浄後HBSS を加え各検出器で蛍光強度を測定した。
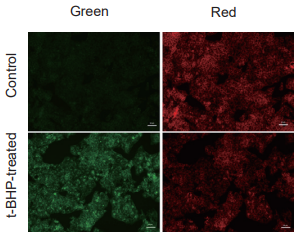
落射型顕微鏡でのイメージング
Green: GFP filter (Ex: 470/40 nm, Em: 525/50 nm)
Red: TexasRed filter (Ex: 560/40 nm, Em: 630/75 nm)
Scale bar: 50 μm
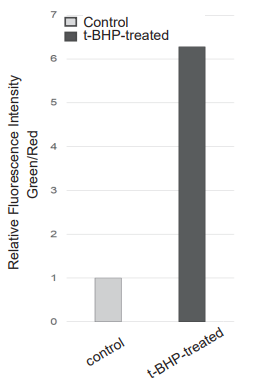
プレートリーダーでの測定
Green: Ex/Em: 490/530 nm
Red: Ex/Em: 570/610 nm
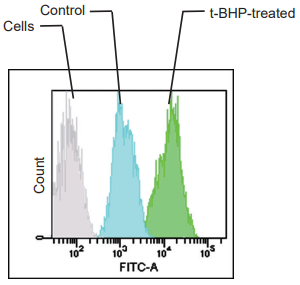
フローサイトメーターでの解析
Filter: FITC filter
(Ex: 488 nm, Em: 530/30 nm)
図2 各検出器におけるHepG2 細胞の過酸化脂質形成の検出
実験例2
cumene hydroperoxide 処理したHepG2 細胞の過酸化脂質形成の検出
- ibidi 8-well plate にHepG2 細胞 (2×105 cells/ml, MEM, 10% fetal bovine serum, 1% penicillin-streptomycin) を播種し、インキュベーター内 (37℃、 5% CO2 存在下) で一晩培養した。
- 培地を取り除き、MEM 培地で細胞を2 回洗浄した。
- 上清を取り除き、BDP 581/591 C11 working solution を加え、インキュベーター内(37℃、5% CO2 存在下) で30 分間インキュベートした。
- 上清を取り除きHBSS で細胞を2 回洗浄後、200 μmol/l cumene hydroperoxide/HBSS 溶液を添加し、インキュベーター内 (37℃、 5% CO2 存在下) で2 時間インキュベートした。
- 上清を除去し、HBSS を用いて細胞を2 回洗浄後HBSS を加え落射型蛍光顕微鏡で細胞を観察した。
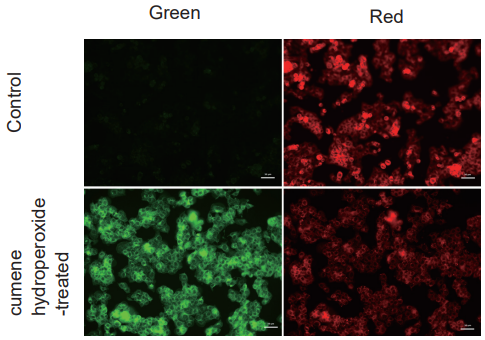 |
Green: GFP filter (Ex: 470/40 nm, Em: 525/50 nm) Red: TexasRed filter (Ex: 560/40 nm, Em: 630/75 nm) Scale bar: 50 μm |
図3 蛍光顕微鏡によるcumene hydroperoxide 処理したHepG2 細胞の観察
参考文献
- S. J. Dixon et al., Cell, 2012, 149, 1060
よくある質問/参考文献
L267: Lipid Peroxidation Probe -BDP 581/591 C11-
Revised Feb., 26, 2025


 を押して省略できます。
を押して省略できます。

