ExoSparkler Exosome Membrane Labeling Kit-Deep Red
エクソソーム 膜蛍光染色キット Deep Red
- 細胞外で凝集せず、より正確な動態を観察できる
- 本キットだけで蛍光標識から精製まで可能
-
製品コードEX03 ExoSparkler Exosome Membrane Labeling Kit-Deep Red
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 5 samples | ¥28,700 | 347-09681 |
精製済エクソソームを染色することができます。
| 5 samples | ・Mem Dye-Deep Red ・Filtration tube |
×1 ×5 |
|---|
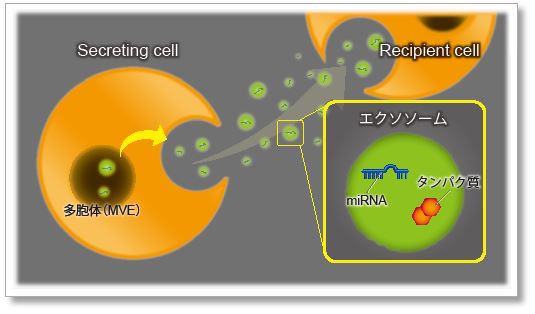
ラベル化エクソソームの利用
近年、細胞から分泌される細胞外小胞(Extracellular vesicle ;EV)の一種であるエクソソームが、がんの悪性化や転移に促進的に寄与することが明らかとなり注目を集めています。
エクソソームによる細胞間コミュニケーションを解析するためには、細胞への取り込みをモニタリングする技術が重要であり、細胞外小胞の脂質二重膜やタンパク質を蛍光色素で染色する技術が汎用されています。
ExoSparkler シリーズは、精製されたエクソソームの膜またはタンパク質を染色し、細胞に取り込まれるエクソソームをイメージングすることができます。
マニュアル
技術情報
より正確にエクソソームの動態を観察する
エクソソームの膜を染色するためによく用いられている膜染色色素(S 社 製品P)には、色素自体が凝集を起こし、エクソソームに由来しない蛍光起点が生じたり、エクソソームの性質変化やバックグラウンドの上昇などを招く課題が挙げられています1), 2)。
ExoSparkler シリーズで用いている色素(Mem Dye-Green, Red, Deep Red)は凝集を起こさず、エクソソームの性質にもほとんど影響を及ぼさないため、より正確にエクソソームの動態を観察することが可能です。
| 参考文献 | |
| 1) | Mehdi Dehghani et al., “Exosome labeling by lipophilic dye PKH26 results in significant increase in vesicle size”.bioRxiv., 2019, doi:10.1101/532028. |
| 2) | Pužar Dominkuš P et al., “PKH26 labeling of extracellular vesicles: Characterization and cellular internalization of contaminating PKH26 nanoparticles.” Biochim Biophys Acta Biomembr., 2018, doi: 10.1016/j.bbamem.2018.03.013. |
技術や使用製品に関する補足
|
技術情報のデータは京都大学大学院工学研究科高分子化学専攻 秋吉一成先生のご支援のもと取得いたしました。 |
-

細胞外小胞、エクソソームの特性と機能
小社季刊冊子「DojinNews vol.169」に執筆いただいた記事を掲載しています。
細胞外で凝集しない ExoSparkler シリーズ
Mem Dye-Deep Red または製品P(緑または赤)で染色したエクソソームをHeLa 細胞へ添加し、細胞内へ取り込まれるエクソソームを蛍光顕微鏡で確認しました。その結果、製品P(緑または赤)で染色したエクソソームにおいては、色素の凝集が疑われる細胞外の蛍光輝点が確認されました。

|
また、Mem Dye-Deep Red または製品P(緑または赤)の色素溶液をNTA(ナノ粒子トラッキング解析)で確認した結果、Mem Dye-Deep Red では色素の凝集物が確認できなかったのに対して、製品P(緑または赤)では色素の凝集が疑われる100-500 nmの粒子が観察されました。
※測定装置:LM10-HSBFT 14 (Nanosight社製)
Mem-Dye溶液ならびに製品P溶液の粒子径変化
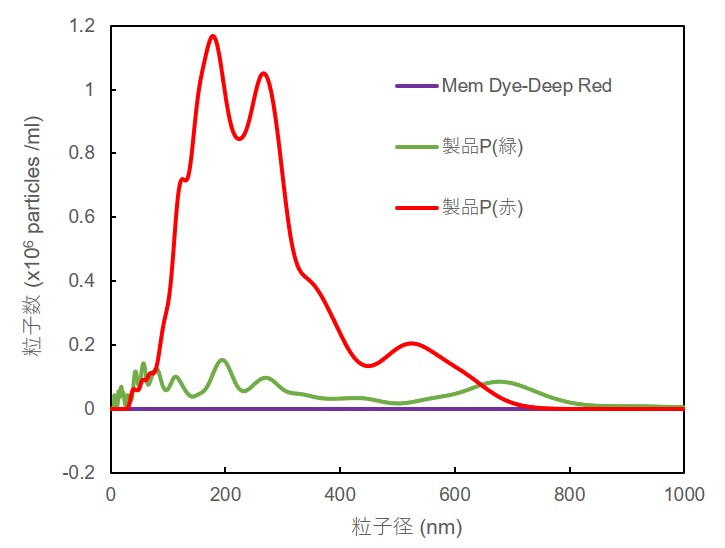
なお、Mem Dye-Green, Red においても、Mem Dye-Deep Red と同様に色素の凝集は確認されませんでした。
エクソソームの性質にほとんど影響しない
Mem Dye-Deep Red または製品P(緑または赤)で染色する前後のエクソソームについて、NTA(ナノ粒子トラッキング解析)とゼータ電位を測定することで、染色によるエクソソームの変化を確認しました。
その結果、Mem-Dyeシリーズ(Green、Red、Deep Red)は、エクソソームの性質にほとんど影響を及ぼさないことが確認されました。
エクソソームの粒子径に対する影響
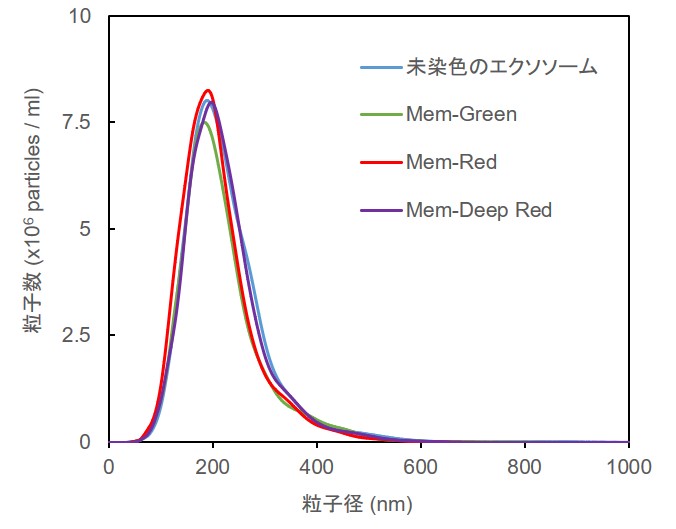
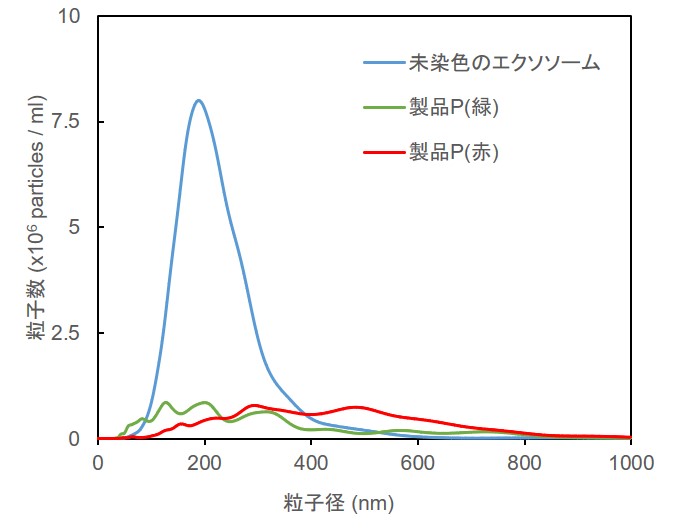
Mem-Dyeシリーズ(Green、Red、Deep Red)ならびに製品P(緑、赤)の各10 µmol/l DMSO溶液を調製し、10 ug(タンパク質量として) のエクソソームを染色後にNTA(ナノ粒子トラッキング解析)を行いました。
結果としてMem-Dyeシリーズで染色したエクソソームは未染色のエクソソームに対して、粒子数ならびに粒子径への影響がほとんど見られませんでしたが(下図左)、製品Pによる染色前後では粒子数と粒子径に顕著な変化がみられました(下図右)。
※測定装置:LM10-HSBFT 14 (Nanosight社製)
Mem-Dyeによる染色前後のNTA比較 製品Pによる染色前後のNTA比較
エクソソームの膜電位に対する影響
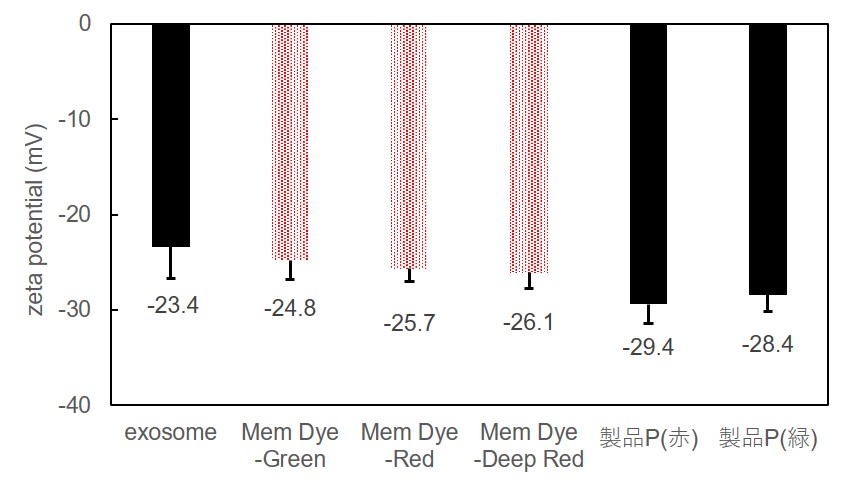
Mem-Dyeシリーズ(Green、Red、Deep Red)ならびに製品P(緑、赤)の各10 µmol/l DMSO溶液を調製し、10 ug(タンパク質量として) のエクソソームを染色後にゼータ電位を測定しました。
結果として、Mem-Dyeシリーズで染色したことによるゼータ電位の変化は、製品Pで染色した場合と比較して小さくなることを確認しました。
※測定装置:Zetasizer Nano ZSP (Malvern Panalytical社製)
Mem-Dyeシリーズならびに製品Pによる染色前後のゼータ電位比較
参考文献) T. Shimomura, R. Seino, K. Umezaki, A. Shimoda, T. Ezoe, M. Ishiyama, and K. Akiyoshi., "New Lipophilic Fluorescent Dyes for Labeling Extracellular Vesicles: Characterization and Monitoring of Cellular Uptake", BIOCONJUGATE CHEM., 2021, doi:10.1021/acs.bioconjchem.1c00068.
このキットだけで蛍光標識から精製まで
ExoSparkler シリーズは、エクソソームの標識に最適化したプロトコルに加え、蛍光標識後の未反応色素を除去できるフィルトレーションチューブを同梱しているため、簡単な操作で蛍光標識エクソソームを調製できます。
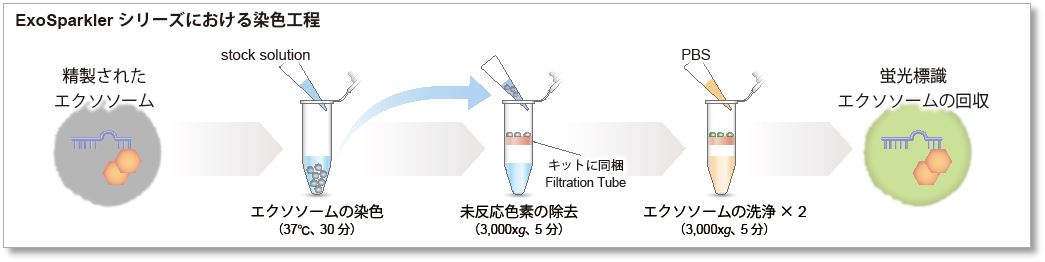 |
精製手法(未反応色素の除去)の比較
ExoSparklarシリーズで未反応色素の除去に使用しているフィルトレーションチューブは、同用途で従来から用いられているゲルろ過法と比較して、高い回収率でエクソソームを精製することが可能です。
| 回収率※ | |
| フィルトレーションチューブ(本キット) | 50% 程度 |
| ゲルろ過法 | 10% 程度 |
| ※ 小社での実施例:精製前後のエクソソーム粒子数をNTA(ナノ粒子トラッキング解析)で比較 | |
フィルトレーションチューブを用いた精製の有効性確認の蛍光画像をよくある質問:標識後の精製操作でフィルターは着色していますが、未反応の色素は分離できていますか?に掲載しています。
豊富なラインナップ
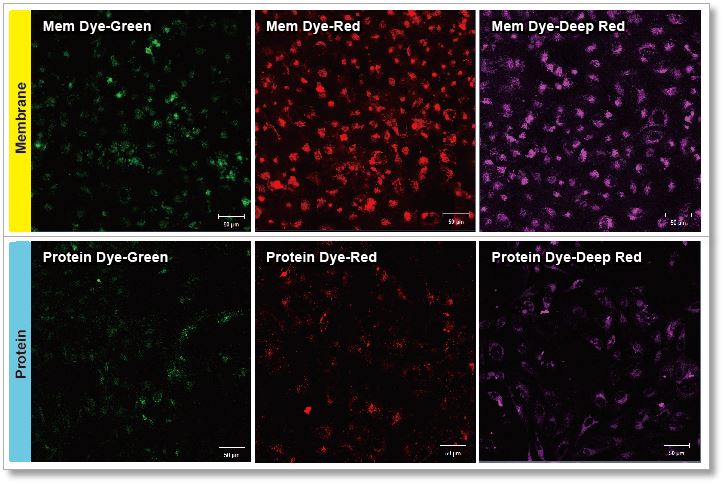
|
| 製品名 | 容量 | 製品コード |
| エクソソーム 膜蛍光染色キット | ||
| ExoSparkler Exosome Membrane Labeling Kit-Green | 5 samples※ | EX01 |
| ExoSparkler Exosome Membrane Labeling Kit-Red | 5 samples※ | EX02 |
| ExoSparkler Exosome Membrane Labeling Kit-Deep Red | 5 samples※ | EX03 |
| エクソソーム タンパク質蛍光染色キット | ||
| ExoSparkler Exosome Protein Labeling Kit-Green | 5 samples※ | EX04 |
| ExoSparkler Exosome Protein Labeling Kit-Red | 5 samples※ | EX05 |
| ExoSparkler Exosome Protein Labeling Kit-Deep Red | 5 samples※ | EX06 |
| ※ 精製済エクソソーム(超遠心法)として、タンパク質:1-10 μg/sample、粒子数:10-100×108 個/sample | ||
実験例:時間依存的なエクソソームの局在変化
■ 実験条件
超遠心法で精製したエクソソーム(タンパク質量として10 µg)をMem Dye-Deep Red(エクソソーム膜蛍光染色キット)で染色し、リソソーム染色試薬で染色したHeLa細胞(1.25×104 cells)に添加、1時間後ならびに4時間後の蛍光画像を観察した。
結果、時間の経過に伴いMem Dye-Deep Redの蛍光輝点(紫)はリソソームの局在(緑)と重なり(白)、時間依存的にエクソソームの局在が変化している様子が確認された。
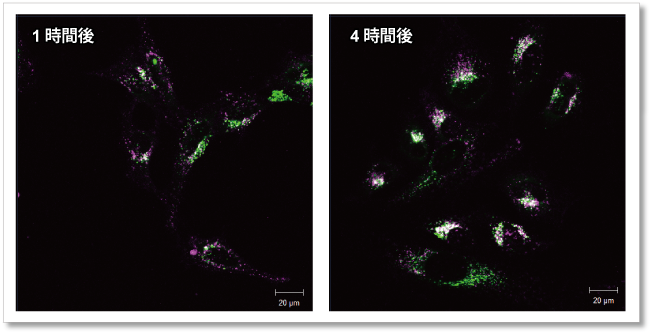
Mem Dye-Deep Red(紫)とリソソーム染色試薬(緑)の共染色
|
実験例:エンドサイトーシス経路を介したエクソソーム取り込みの可視化
時間依存的なエンドサイトーシスによるエクソソーム取り込みの様子を可視化しました。結果、ECGreen(製品コード:E296)とMem Dye-Deep Redで染色したエクソソームの時間依存的な集積による蛍光強度の増加が確認でき、共局在を示す白色輝点が増加していることが確認出来ました。この結果より、エクソソームはエンドサイトーシスを介して細胞内に取り込まれることが示唆され、エクソソーム本来の挙動を示していることが確認できました。
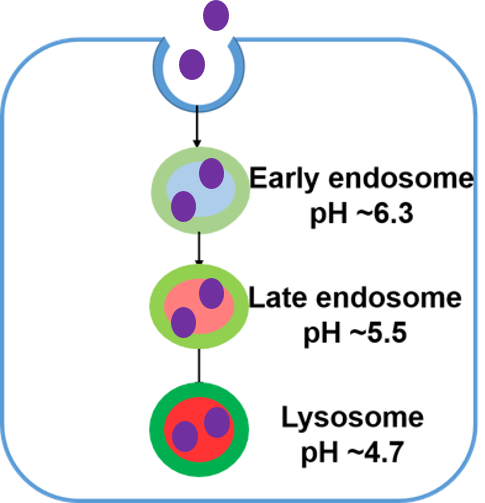
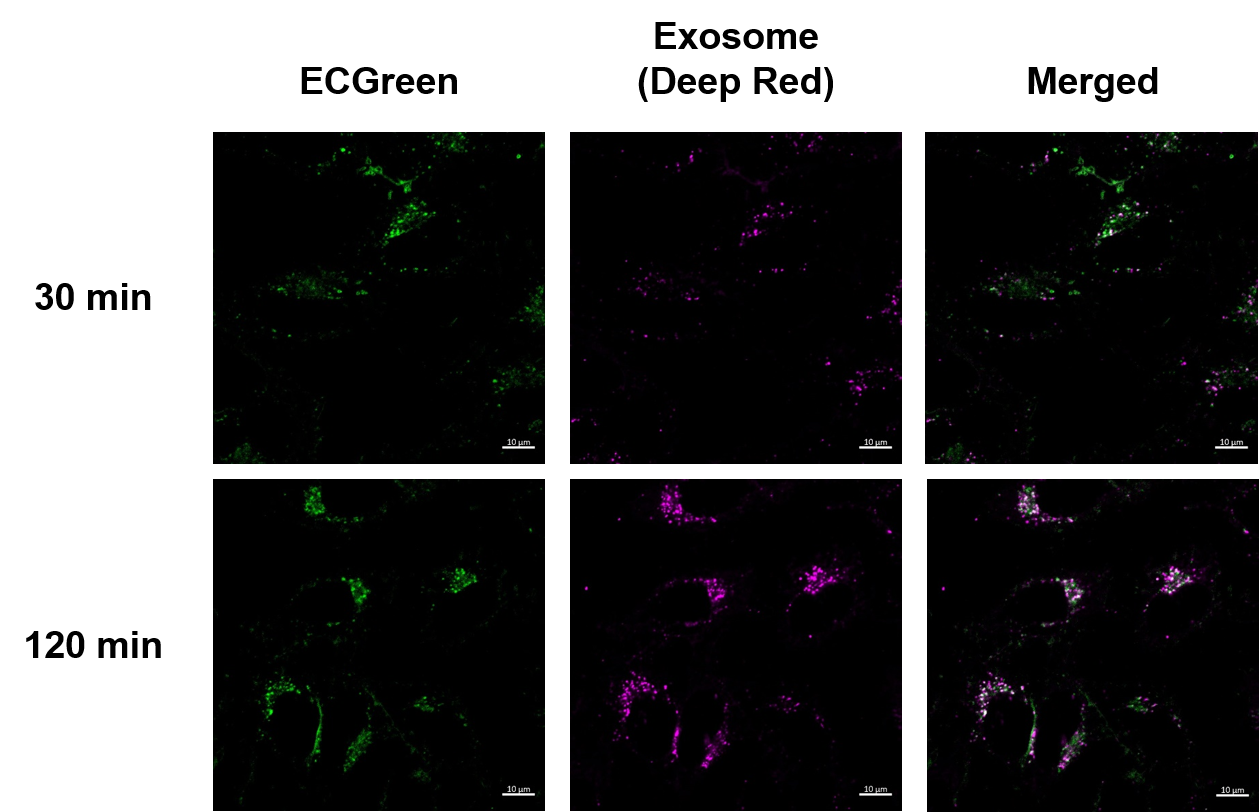
<観察条件>
エンドソーム(ECGreen、緑): Ex. 405 nm / Em. 500 - 560 nm
エクソソーム(Mem Dye-Deep Red、紫):Ex 640 nm / Em 640-760 nm
スケールバー:10 µm
<実験操作>
(1) HeLa細胞に10% FBS含有MEM培地で希釈した10 µmol/l ECGreenを加え30分インキュベーション
(2) 洗浄せずに、Mem Dye-Deep Redで染色したエクソソーム(10 µgタンパク質相当量)をHeLa細胞に添加
(3) 各サンプルをインキュベーション (30分、120分)
(4) 各時間毎サンプルを洗浄し、細胞を共焦点レーザー顕微鏡で観察
参考文献
1) R.Kawata, S.Oda, Y. Koya, H.Kajiyama, T. Yokoi, "Macrophage-derived extracellular vesicles regulate concanavalin A-induced hepatitis by suppressing macrophage cytokine production", Toxicology, 2020, https://doi.org/10.1016/j.tox.2020.152544.
よくある質問
-
Q
推奨されるエクソソームの精製法はありますか?
-
A
超遠心法での精製を推奨しておりますが、免疫沈降法や磁気ビーズで精製したエクソソームの染色実績もございます。
また、超遠心法と同等の回収実績のある、ExoIsolator Exosome Isolation Kit(EX10)もご利用いただけます。
なお、ポリマー沈殿法で精製したエクソソームは下記の理由により、残存するポリマーの影響を受けるため、本キットでの染色はできません。1)未反応色素の精製工程で使用するフィルトレーションチューブにポリマーがつまり、精製できなくなる可能性がございます。
2)ポリマーがエクソソームと相互作用し、エクソソームの膜電位が変わる可能性がございます。膜電位が変わると、細胞取り込みアッセイに標識エクソソームを使用する場合、細胞内動態が変化する恐れがございます。
-
Q
標識後の精製操作でフィルターは着色していますが、未反応の色素は分離できていますか?
-
A
未反応の色素はフィルターに保持されるために着色が見られますが、小社では以下の実験でフィルター上の回収物に未反応色素が含まれないことを確認しております。
<実験条件>
超遠心法で精製した ①エクソソーム(タンパク質量として10µg)のバッファー溶液 または ②バッファーのみ を各キットのプロトコルに従って染色操作したのち、得られた回収物をHeLa細胞(1.25×104 cells)に添加して、4時間後の蛍光画像を観察しました。結果として、バッファーのみで得られた回収物は細胞へ添加しても蛍光輝点が観察されず、回収物に未反応の色素が残っていないことを確認しました。
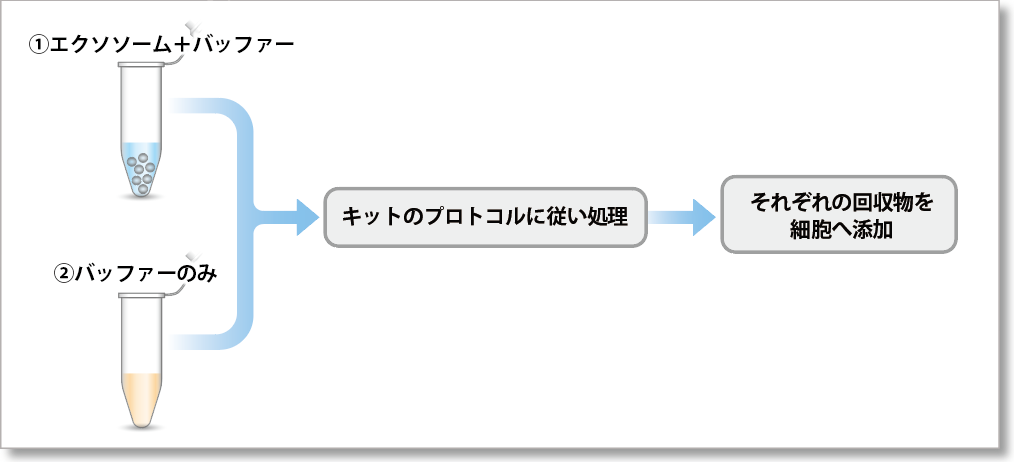
①エクソソーム+バッファーをキットで処理した場合
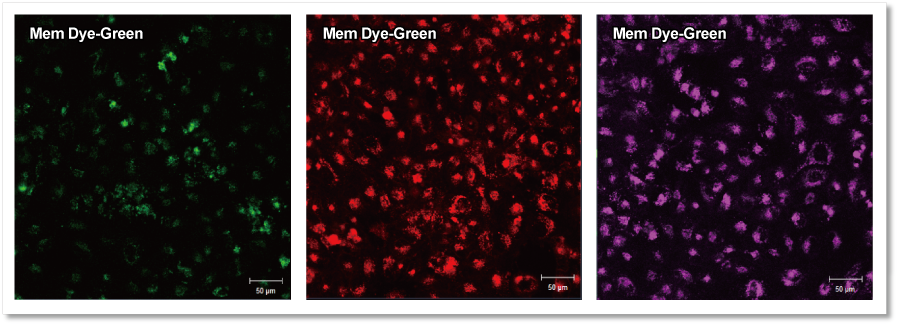
細胞へ添加後(4h)の蛍光画像
②バッファーのみをキットで処理した場合

細胞へ添加後(4h)の蛍光画像
■ 検出条件
Green:Ex 488 nm / Em 490 – 540 nm
Red :Ex 561 nm / Em 570 – 640 nm
Deep Red:Ex 640 nm / Em 640 – 760 nm
-
Q
染色後のエクソソームは保存できますか。
-
A
染色後のエクソソームの保存は推奨しておりません。
エクソソームの染色後はできるだけ早く実験にご使用ください。
-
Q
エクソソームの取込実験で使用実績のある培地を教えてください。
-
A
小社では染色後のエクソソームを用いた細胞への取り込み実験において、
MEM(Minimum Essential Medium)ならびにDMEM(Dulbecco's Modified Eagle's Medium)での実績がございます。なお、ExoSparklerシリーズは血清含有培地中での取込実験に最適化しているため、
無血清培地中で使用することはお勧めできません。
-
Q
1sampleあたりの染色できるエクソソーム量(タンパク質量、粒子数)を教えてください。
-
A
1sampleあたりのエクソソーム量(タンパク質量、粒子数)は以下の通りです。
精製済エクソソーム(超遠心法)として、タンパク質:1-10 μg/sample, 粒子数 10-100x 108 個/sample
-
Q
エクソソーム以外に夾雑物が含まれる場合、夾雑物も染色されますか?
-
A
はい。エクソソームにタンパク質やポリマー*等の夾雑物が含まれると、夾雑物も染色されてしまいます。
そのため、精製したエクソソームをご準備ください。
*精製方法によっては、ポリマーが残存する場合があります。精製方法については「推奨されるエクソソームの精製法はありますか?」をご参照ください。
取扱条件
| 保存条件: 冷蔵,遮光 |