ECGreen-Endocytosis Detection

エンドサイトーシス検出試薬
- より正確にエンドサイトーシスを可視化できる
- 生細胞でエンドサイトーシスを追跡できる
- pH変化に対する応答性が高い
-
製品コードE296 ECGreen-Endocytosis Detection
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 40 μl | ¥51,600 | 342-09751 |
<使用回数の目安> 40 μl あたり、35 mm dish 20 枚、μ-Slide 8 well 20 枚
性質
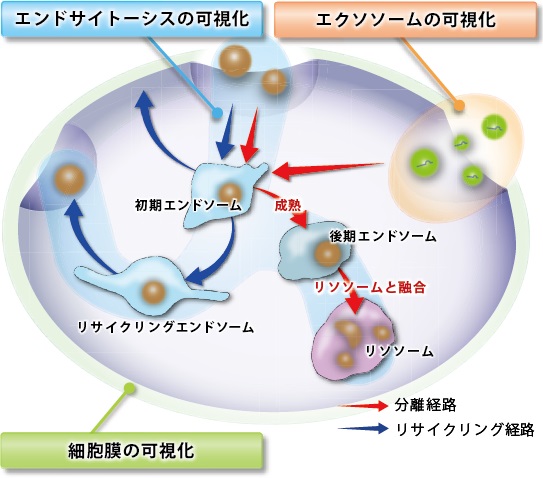
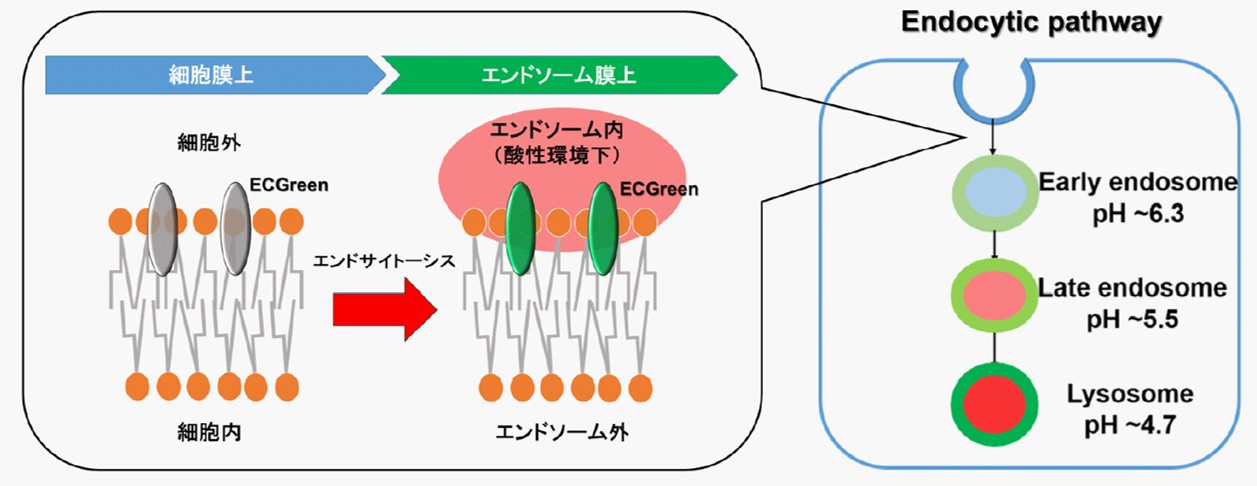
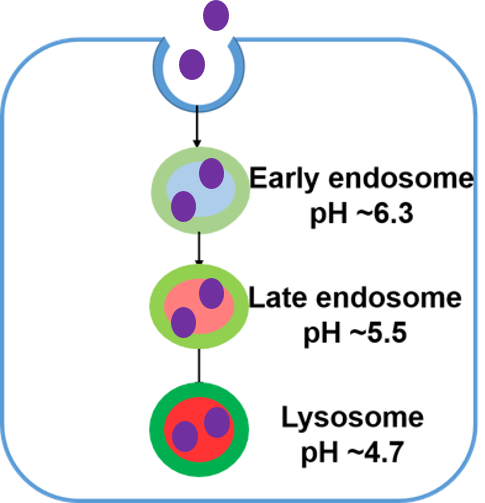
エンドサイトーシスは細胞膜由来の小胞(エンドソーム)を介した細胞内取り込み機構です。この過程において、様々な栄養因子を取り入れるだけでなく、細胞内外の不要物をリソソームに輸送し分解することで細胞の恒常性維持に寄与しています。このエンドサイトーシスの破綻が神経変性疾患や免疫疾患と密接に関わっていることが近年明らかとなり、注目を浴びています。生細胞における解析にはエンドサイトーシスで取り込まれるデキストラン等を蛍光標識したプローブが汎用されています。しかしながら、デキストランはその大きさによって取り込まれる経路や細胞内動態が変化することが知られており、より正確にエンドサイトーシス経路を解析できるツールが求められています。
ECGreenは細胞膜非透過性の低分子蛍光色素であり、細胞膜上に滞留します。その後エンドサイトーシスによって取り込まれ、小胞内の酸性環境に応答して蛍光強度が増大します。蛍光標識デキストラン等とは異なり、ECGreenは取り込まれたエンドソーム膜を直接染色するためより正確にエンドサイトーシス経路をライブイメージングすることが可能です。
マニュアル
技術情報
従来法の課題を解決
これまでエンドサイトーシスの可視化で用いられてきた蛍光標識デキストランや膜染色試薬は、染色の正確性や色素の滞留性の低さなどから、生細胞におけるエンドソームの動態を観察するには大きな課題がありました。ECGreenではそれらの課題を解決することができます。
他社製品との比較
| 製品名 | Endosome での局在 | pH 応答性 | Lysosome への局在 |
|---|---|---|---|
| ECGreen-Endocytosis Detection | 小胞膜 | ECGreen > デキストラン | 局在 |
| T社 製品P(蛍光標識デキストラン) | 小胞内 | 局在 | |
| T社 製品F(膜染色試薬) | Endosome への局在は少ない | 応答性なし | 局在 |
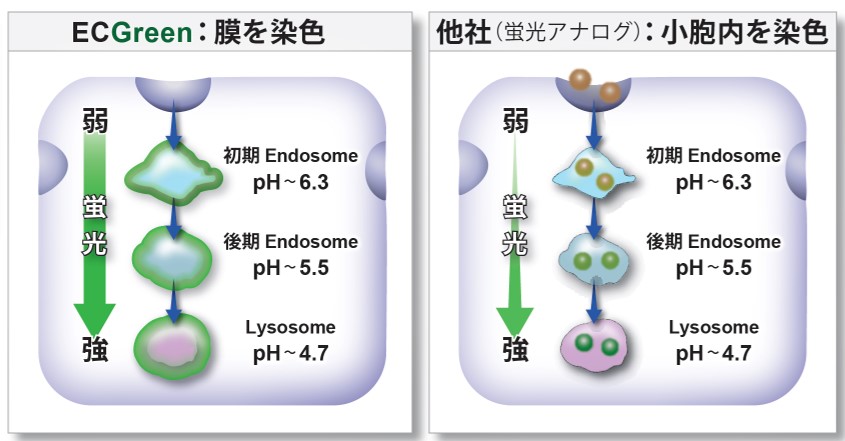
直接的にエンドソームを可視化
ECGreen-Endocytosis Detection は小胞膜に局在し、pH に依存して蛍光を発する試薬です。
そのため、蛍光アナログよりも直接的に初期エンドソームの段階から可視化することができます。
pH変化への応答性が高い
ECGreen-Endocytosis Detection は従来用いられてきた蛍光標識デキストランと比較して、pH変化に対する応答性に優れています。
そのため、初期エンドソームも高感度に検出することが可能です。
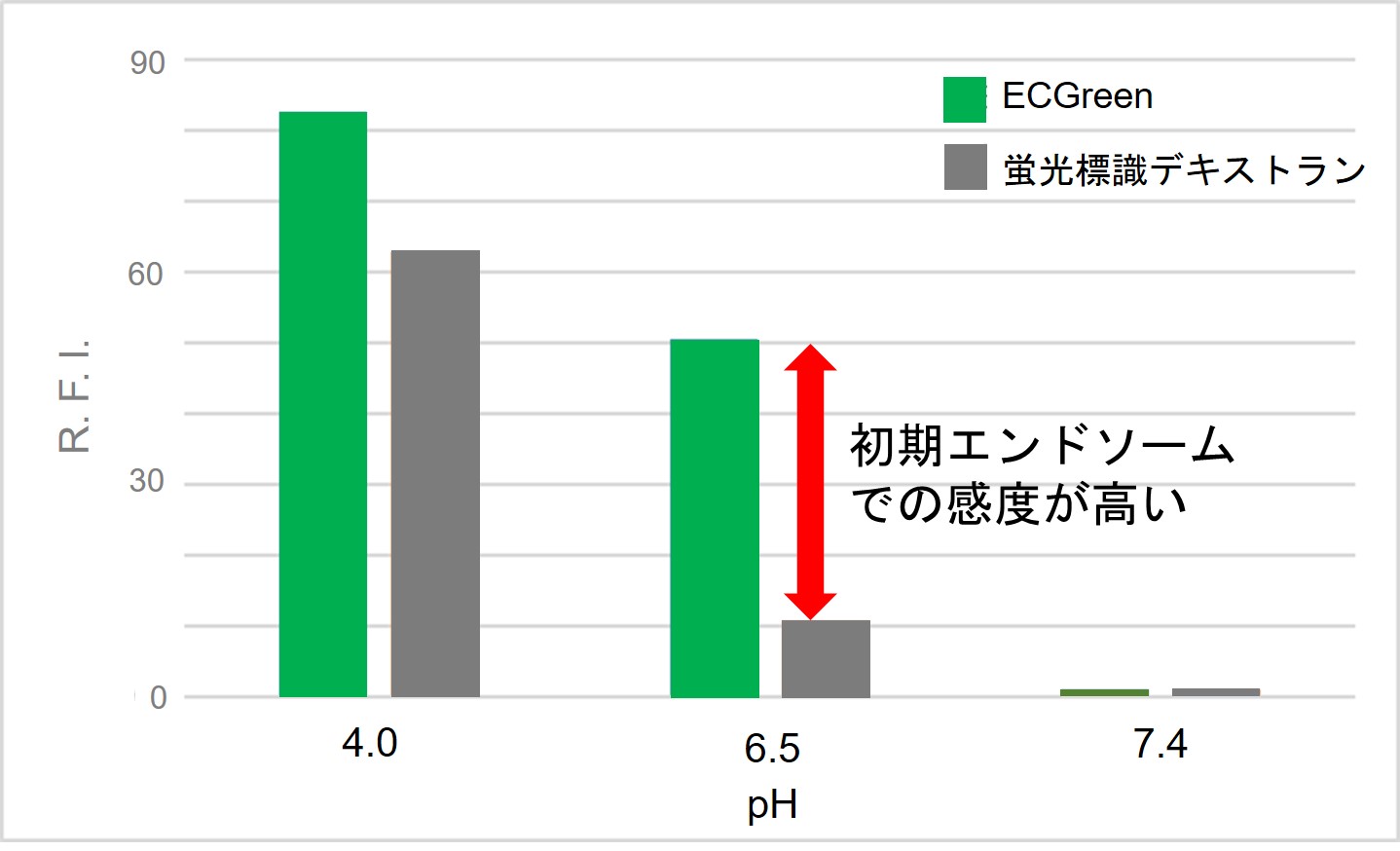
各試薬の pH に対する蛍光強度変化
実験例:薬剤を用いた初期エンドソームの観察
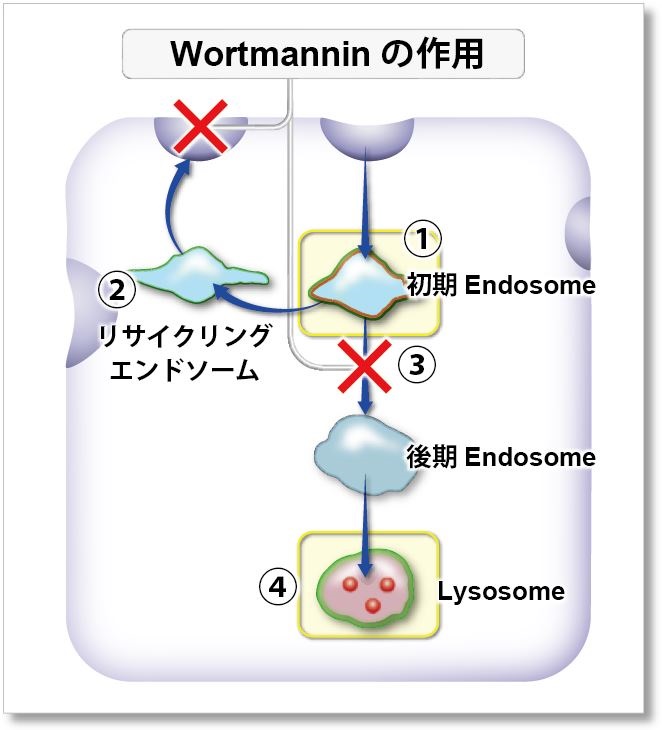
Wortmannin はエンドソームのリサイクリングやリソソームへの移行を阻害し、エンドソームの肥大化を惹起することが知られています。
Wortmannin によるこれらの変化をECGreen(緑)と以下に示す指標の共染色で確認しました。
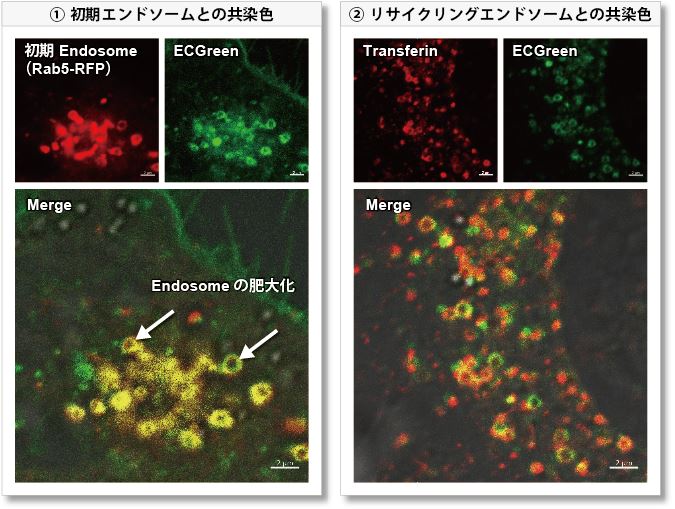
① 初期エンドソーム:Rab5-RFP(赤)
② リサイクリングエンドソーム:蛍光標識Transferin(赤)
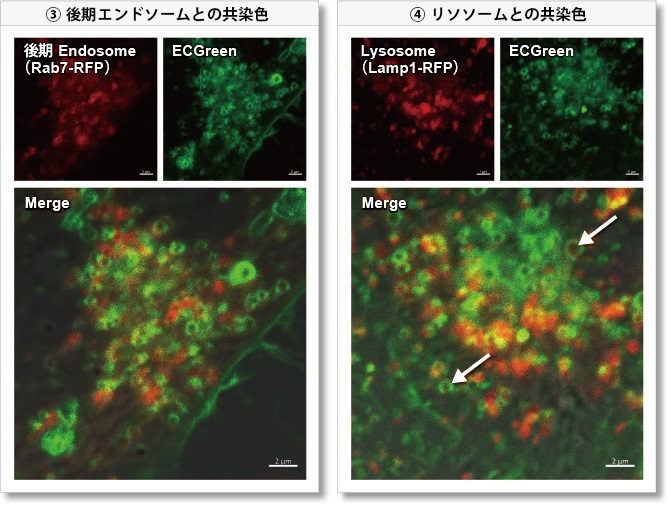
③ 後期エンドソーム:Rab7-RFP(赤)
④ リソソーム:Lamp1-RFP(赤)
その結果、ECGreen(緑) は Wortmannin の作用を裏付けるように肥大化した初期エンドソームやリサイクリングエンドソームのみと共局在し(図①、②)、後期エンドソームや Lysosomeとは共局在しない(図③、④)ことが確認されました。ECGreen では細胞内小胞輸送系やエンドソーム形状の変化を可視化することができます。
(①~④ スケールバー:2 µm)
<観察条件>
エンドソーム(ECGreen、緑): Ex. 405 nm / Em. 500 - 560 nm
初期エンドソーム(Rab5-RFP、赤):Ex. 561 nm / Em. 560 - 620 nm
後期エンドソーム(Rab7-RFP、赤):Ex. 561 nm / Em. 560 - 620 nm
リソソーム(Lamp1-RFP、赤):Ex. 561 nm / Em. 560 - 620 nm
<実験操作>
(1) μ-Slide 8well に HeLa細胞を播種し、1晩インキュベート
(2) HBSSで洗浄後、10% FBS含有MEM培地で調製した Wortmannin(終濃度:100 nmol/l)を 200 µl 添加
(3) 37℃ で 30分間インキュベート
(4) 上澄みを除かずに 10% FBS含有MEM培地で調製した ECGreen(1,000倍希釈)を 200 µl 添加
(5) 37℃ で 30分間インキュベート
(6) HBSSで細胞を2回洗浄し、10% FBS含有MEM培地を添加
(7) 共焦点レーザー顕微鏡で観察
実験例:エンドサイトーシス経路を介したエクソソーム取り込みの可視化
時間依存的なエンドサイトーシスによるエクソソーム取り込みの様子を可視化しました。結果、ECGreen-Endocytosis DetectionとExoSparkler Exosome Membrane Labeling Kit-Deep Red(製品コード:EX03)で染色したエクソソームの時間依存的な集積による蛍光強度の増加が確認でき、共局在を示す白色輝点が増加していることが確認出来ました。この結果より、エクソソームはエンドサイトーシスを介して細胞内に取り込まれることが示唆され、エクソソーム本来の挙動を示していることが確認できました。
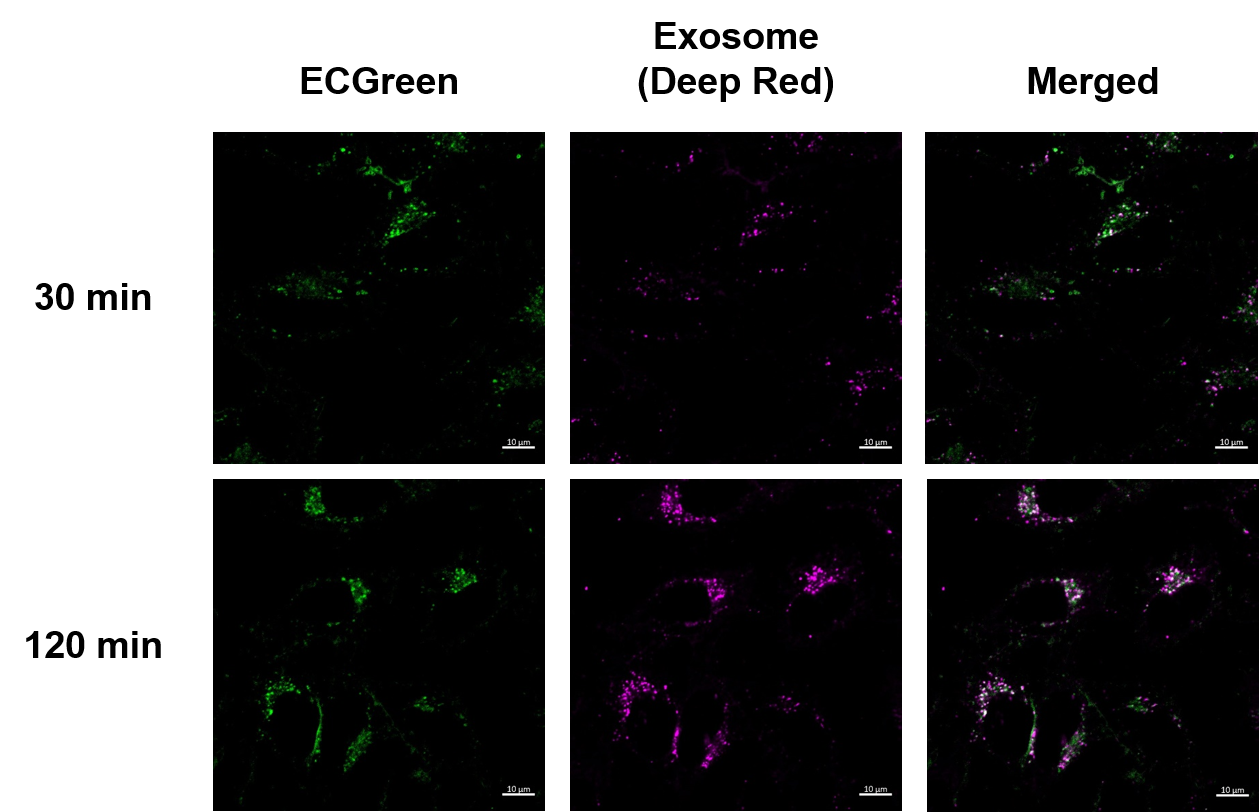
<観察条件>
エンドソーム(ECGreen-Endocytosis Detection、緑): Ex. 405 nm / Em. 500 - 560 nm
エクソソーム(ExoSparkler Exosome Membrane Labeling Kit-Deep Red、紫):Ex 640 nm / Em 640-760 nm
スケールバー:10 µm
<実験操作>
(1) HeLa細胞に10% FBS含有MEM培地で希釈した10 µmol/l ECGreenを加え30分インキュベーション
(2) 洗浄せずに、ExoSparkler Exosome Membrane Labeling Kit-Deep Redで染色したエクソソーム(10 µgタンパク質相当量)をHeLa細胞に添加
(3) 各サンプルをインキュベーション (30分、120分)
(4) 各時間毎サンプルを洗浄し、細胞を共焦点レーザー顕微鏡で観察
実験例:エンドサイトーシス継時変化の観察
A431細胞をECGreen (2000倍希釈)で5分間染色、PBSで洗浄後に蛍光顕微鏡にてタイムラプス観察しました。
結果、ECGreenの蛍光強度は観察開始10分あたりで、上昇する傾向が見られました。

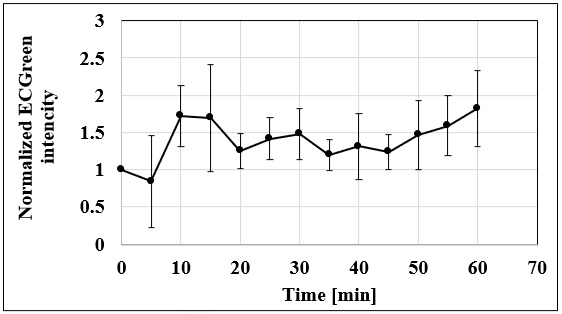
<観察条件>
蛍光顕微鏡:Olympus社製 倒立型リサーチ顕微鏡 IX83
フィルター:Semrock社製 励起フィルター:FF01-387/11-25 吸収フィルター:FF01-542/27
撮像カメラ:QImaging社(現TELEDYNE PHOTOMETRICS社)製 EM-CCDカメラ Rolera EM-C2
Duration: 60 minutes, Interval: 5 minutes
※本データは、北海道大学大学院医学研究院・医学院 細胞生理学教室 大場雄介 先生よりご提供いただきました。
実験例:浮遊細胞を用いた温度依存的なエンドサイトーシス変化の観察
Jurkat細胞の温度依存的なエンドサイトーシスの変化をECGreen-Endocytosis DetectionとPlasMem Bright Red (製品コード: P505)を用いて可視化しました。
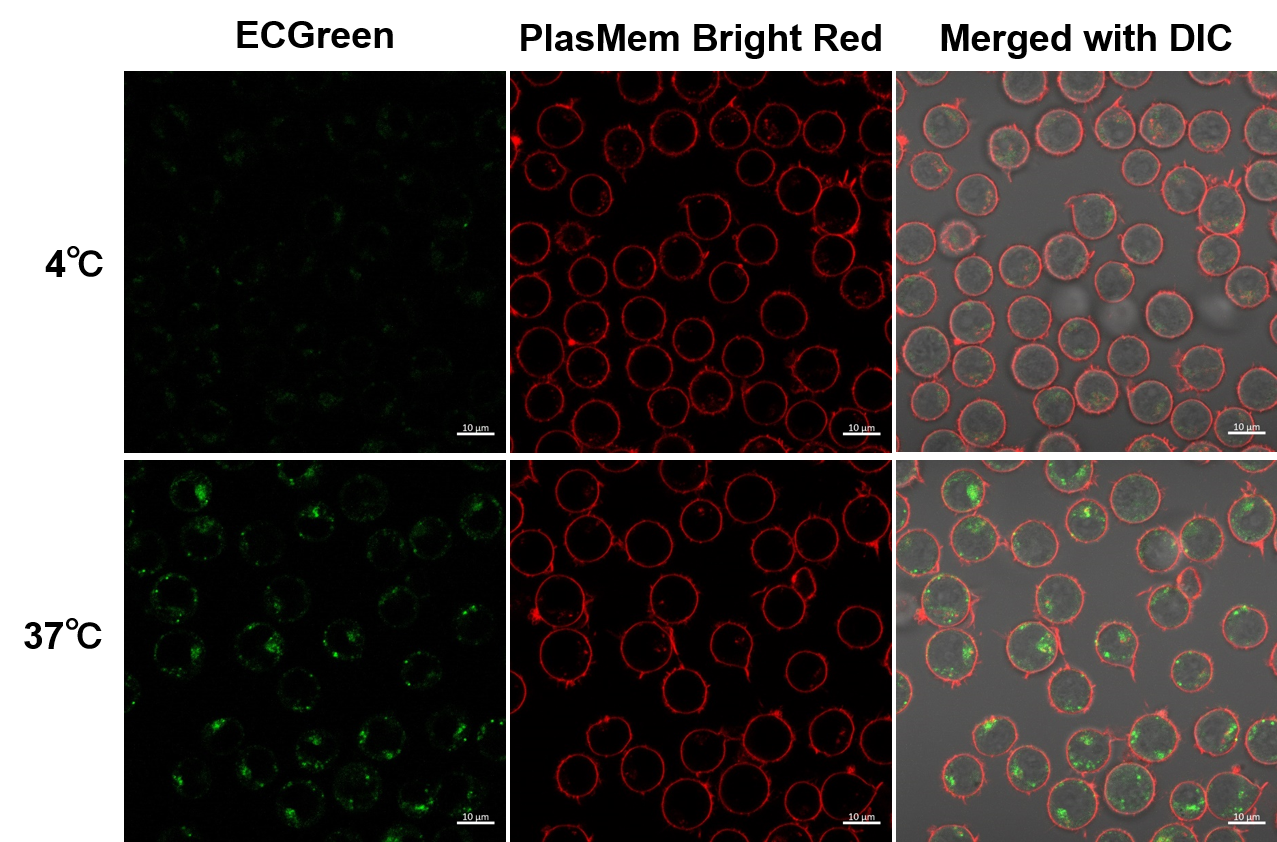
(スケールバー: 10 µm)
<測定条件>
エンドソーム(ECGreen、緑): Ex. 405 nm / Em. 500 - 560 nm
細胞膜(PlasMem Bright Red、赤):Ex. 561 nm / Em. 560 - 700 nm
<実験操作>
(1) Jurkat 細胞の懸濁液(10% FBS, RPMI)をサンプルチューブに入れ、4 ℃もしくは37 ℃にて30 分間インキュベート
(2) (1) の懸濁液を用いてECGreen 溶液 を1000 倍希釈
(3) 4 ℃もしくは 37 ℃にて30 分間インキュベート
(4) HBSSを用いて、細胞を2回洗浄
(5) PlasMem Bright Red (100倍希釈濃度)を含む培地を添加し、細胞を懸濁
(6) 懸濁液をイメージングプレートに移し、共焦点レーザー顕微鏡を用いて細胞を観察
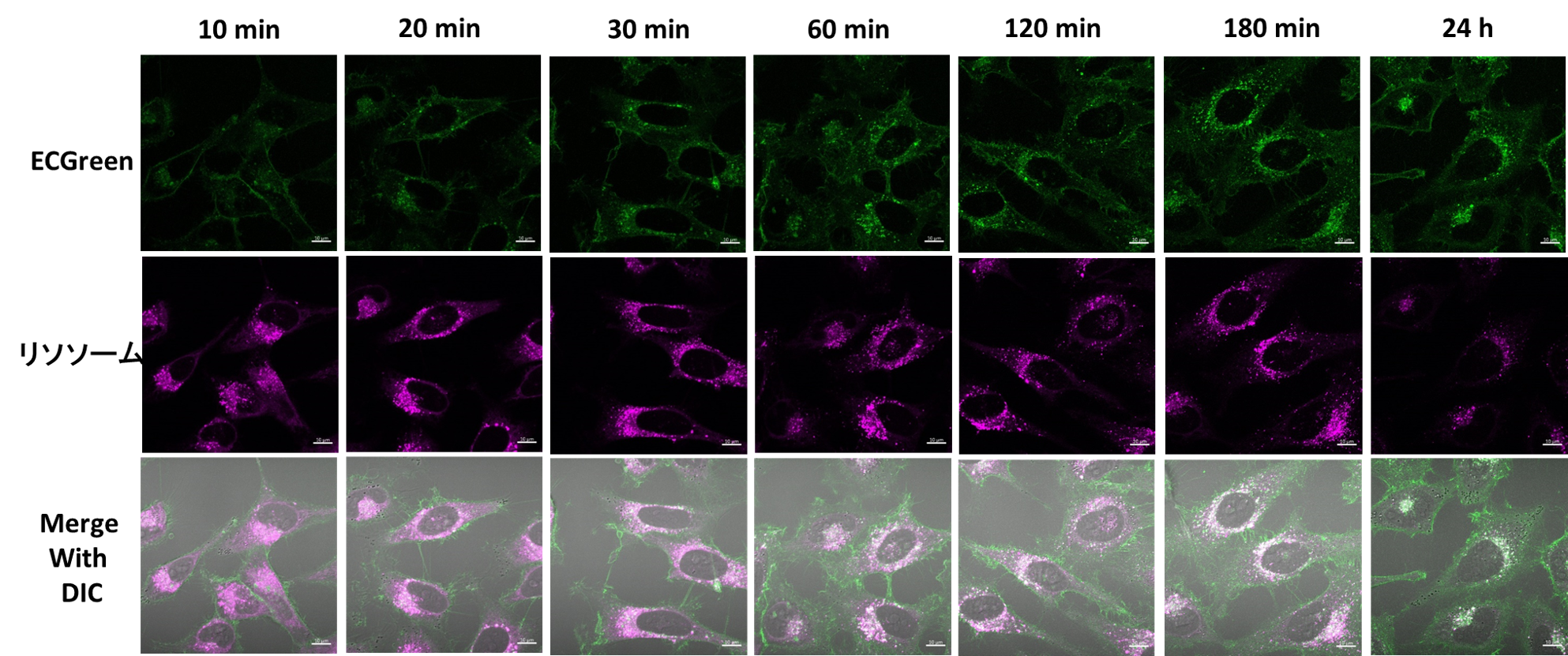
応用例:エンドソームの局在の時間変化
ECGreenを共焦点レーザー顕微鏡で観察する場合、染色後は未洗浄でもエンドサイトーシス由来蛍光輝点の観察が可能です。ECGreenを利用した応用実験例として、HeLa細胞をECGreen(緑)及びリソソーム染色試薬(赤)にて染色後、イメージング画像の時間変化を確認しました。
その結果、時間経過とともにエンドソームがリソソームと共局在することが確認されました。
|
|
<観察条件>
エンドソーム(ECGreen、緑): Ex. 405 nm / Em. 500 - 560 nm
リソソーム(Lysosome 染色試薬、赤):Ex. 561 nm / Em. 600 - 700 nm
<実験操作>
(1) HeLa細胞を播種し一晩培養
(2) HBSSで細胞を一回洗浄
(3) 10% FBS含有MEM培地で調製した ECGreen(1,000倍希釈)ならびにリソソーム染色試薬(終濃度:100 nmol/l)を添加
(4) 各時間毎に未洗浄の細胞を共焦点レーザー顕微鏡で観察
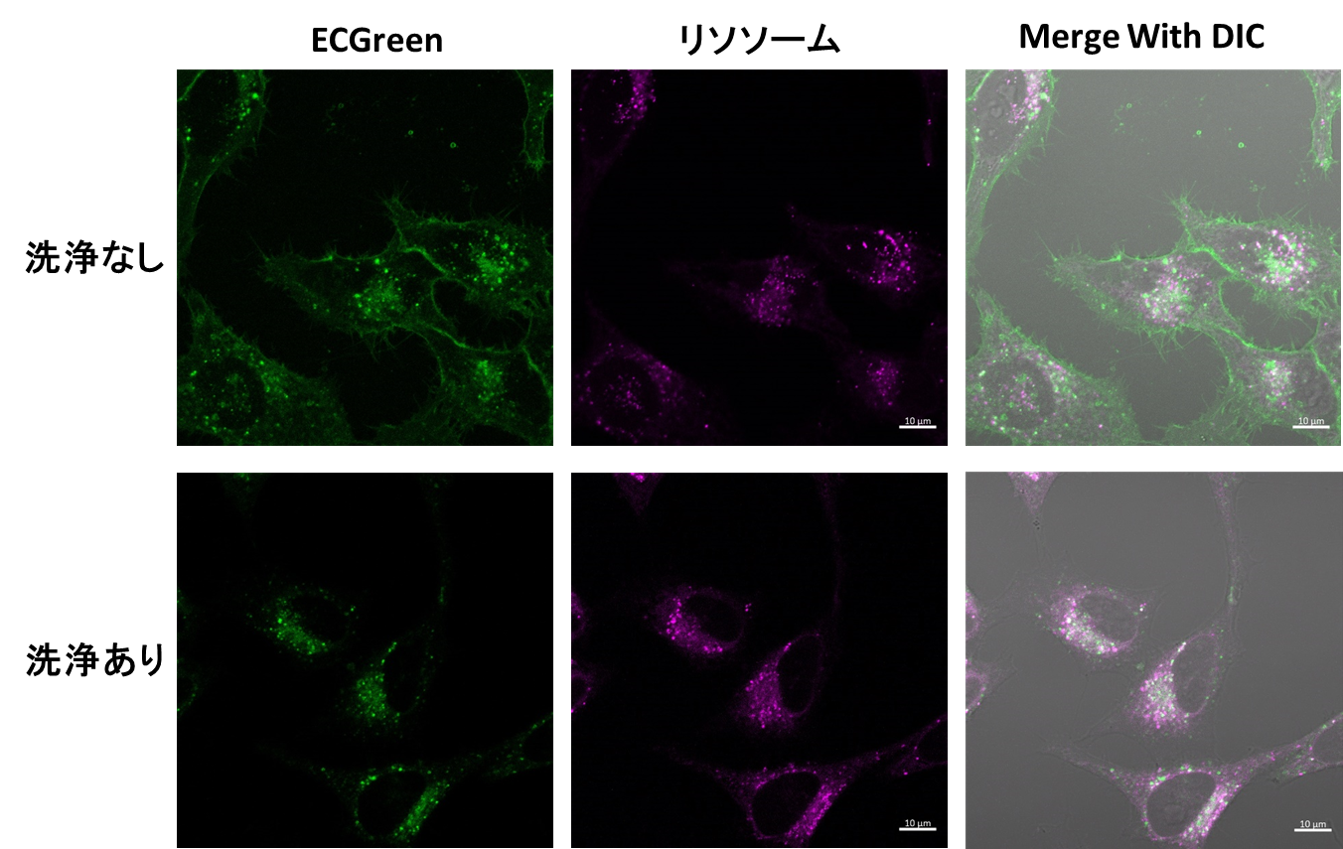
染色後の洗浄有無について
洗浄後に未洗浄で観察を行う場合、得られるイメージング像には以下の特長があります。
|
〇染色後の洗浄なし: |
色素が細胞膜に滞留した状態を維持できるため、エンドサイトーシスの様子を時間変化で観察することが可能 |
|
〇染色後の洗浄あり: |
細胞膜に過剰量滞留した残存色素を除き、エンドサイトーシス由来の蛍光輝点をより鮮明に観察することが可能 |
|
|
ECGreenの蛍光特性
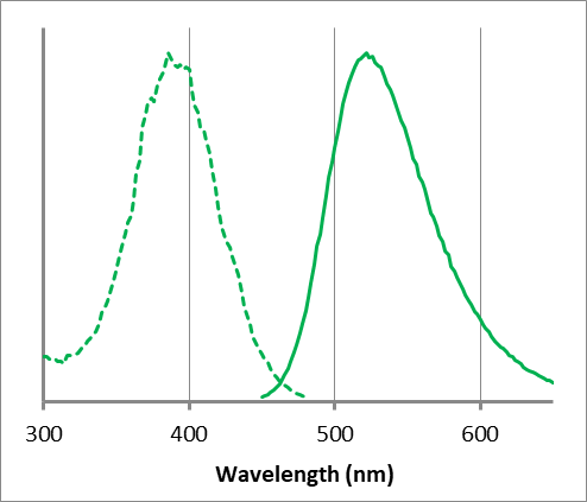
λex: 386 nm, λem: 522 nm
<観察条件>
Ex : 350 ~ 410 nm, Em : 500 ~ 560 nm
参考文献
| 文献No. | 対象サンプル | 装置 | 引用(リンク) |
|---|---|---|---|
| 1) | 細胞 (HepG2) |
蛍光顕微鏡 | Y. Miyakawa, M. Otsuka, K. Sekiba, K. Funato, K. Koike, "Humanized virus-suppressing factor inhibits hepatitis B virus infection by targeting viral cell entry ", Heliyon, 2021, doi:10.1016/j.heliyon.2021.e07586. |
| 2) | 細胞 (皮膚線維芽細胞) |
蛍光顕微鏡 | H. L. Marko, N. C. Hornig, R. C. Betz, P. Holterhus, J. Altmüller, H. Thiele, M. Fabiano, H. Schweikert, D. Braun, Ul Schiweizer, "Genomic variants reducing expression of two endocytic receptors in 46,XY differences of sex development", Hum. Mutat. 2022, doi:10.1002/humu.24325. |
| 3) | 細胞 (HeLa) |
蛍光顕微鏡 | K. Qiu, R. Seino, G. Han, M. Ishiyama, Y. Ueno, Z. Tian, Y. Sun, J. Diao, "De Novo Design of A Membrane-Anchored Probe for Multidimensional Quantification of Endocytic Dynamics", Adv. Healthcare Mater., 2022, doi:10.1002/adhm.202102185. |
よくある質問
-
Q
落射型顕微鏡でも観察できますか。
-
A
共焦点顕微鏡での観察を推奨しておりますが、落射型顕微鏡でも観察は可能です。
小社ではDAPI filter set (Ex : 360/40 nm, Em : 460/50 nm)で検出した実績があります。
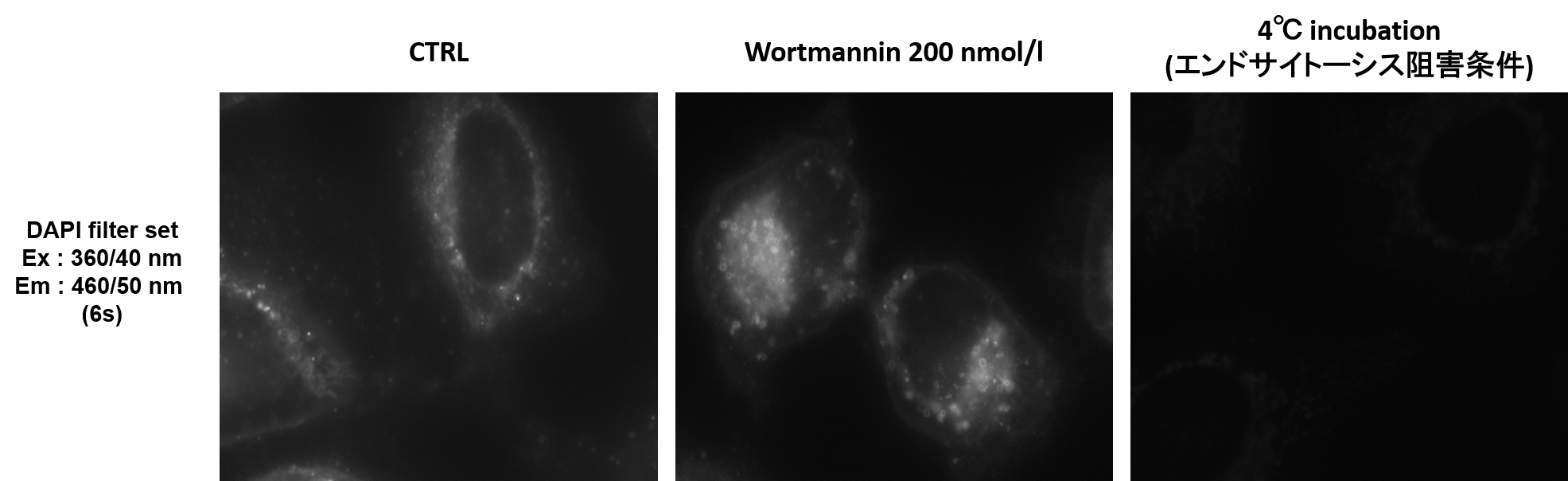
図1. 落射型顕微鏡での観察
-
Q
血清含有培地で染色できますか?
-
A
血清含有培地での染色も可能です。
HeLa細胞では血清含有培地で作成したworking solutionを用いて24時間まで細胞毒性なく染色した実績があります。
細胞毒性の評価は小社製品「 Cell Counting Kit-8 」を用いて確認しています。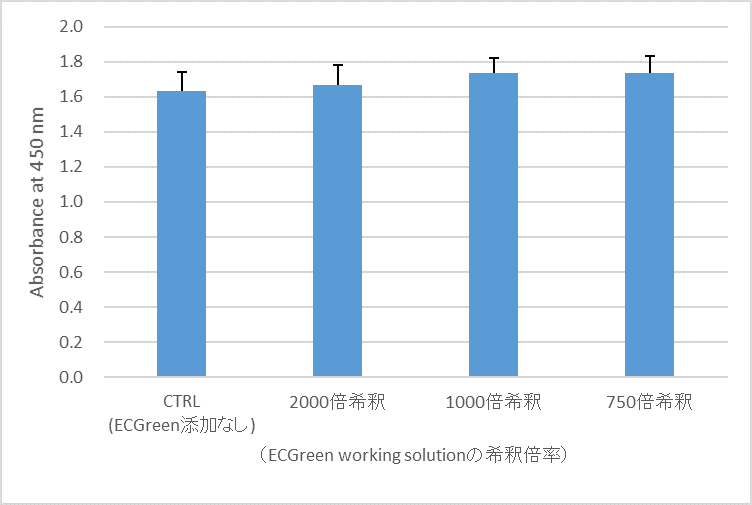
図. Cell Counting Kit-8を用いた細胞毒性試験(24時間)