AcidSensor Labeling Kit - Endocytic Internalization Assay
pHセンサーラベル化キット
- pH感受性蛍光色素をラベル化できる
- ラベル化に必要なものが同梱されているオールインワンのキット
- 詳細な標識マニュアル
-
製品コードA558 AcidSensor Labeling Kit - Endocytic Internalization Assay
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 3 samples | ¥48,200 | 340-10041 |
| サンプル量 | 50-200 µg |
|---|---|
| 標識部位 | -NH2 |
| 検出方法 | 顕微鏡・FCM |
| 蛍光特性 | [Ex:645, Em:666] |
|
・分子量50,000以上のタンパク質が標識できる。 ・Filtration Tubeを用いた分離操作により高い回収率で標識体が得られる。 |
|
| 3 samples | ・NH2-Reactive AcidSensor ・WS Buffer ・Reaction Buffer ・Filtration Tube |
3 tubes 4 ml ×1 500 μl×1 3 tubes |
|---|
性質
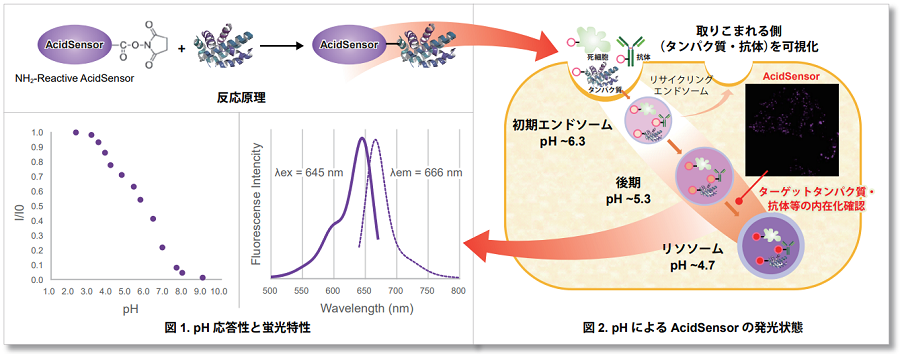
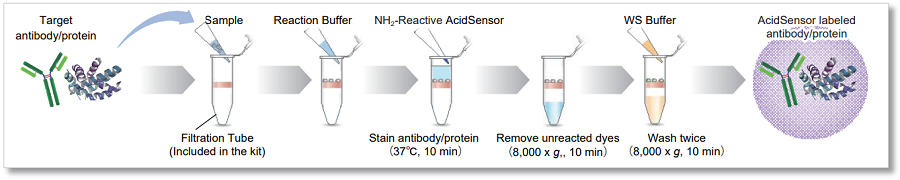
本キットは、目的物質のエンドサイトーシスによる取り込みを可視化することができるオールインワンのキットです。 キットに同梱の NH2-Reactive AcidSensor(蛍光プローブ)は、分子内に活性エステル基を持ち、アミノ基を有する目的物質(タンパク質)と混合 するだけで安定な共有結合を形成します。AcidSensor 標識体は 633 nm で励起可能であるため、緑色や赤色蛍光との多重染色ができます(図 1)。 また AcidSensor 標識体は中性では蛍光をほとんど示さず、エンドサイトーシスによって取り込まれた細胞内で酸性化されると蛍光を発します(図 2)。
※注意点
・小社製品のエンドサイトーシス検出色素:ECGreen (製品コード : E296)とは異なり、本キットは、細胞内に入る目的物質を染色します。
・分子量が 50,000 以上で、反応性のアミノ基を有するサンプルへ標識することができます。
マニュアル
技術情報
初めてでも迷わない実験操作
本キットは、未反応の色素を除くために必要なフィルトレーションチューブを同梱しており、標識から精製操作までを行うことができます。※
また、取扱説明書に沿って実験していただくことで、初めての方でも容易に AcidSensor を標識することが可能です。
※ 抗体やタンパク質は含まれません。
※ DMSO と培地は、別途ご準備ください。
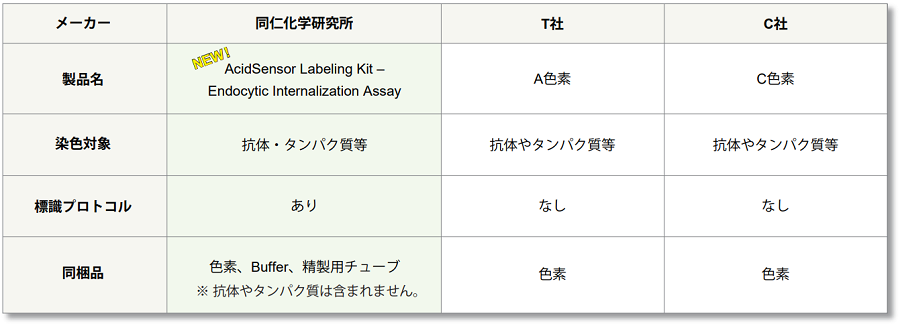
他社製品との比較
共染色でエンドソームとの観察が可能に
ラベル化 IgG の細胞内取り込みの経時観察
本キットを用いて染色した AcidSensor 標識マウス IgG と小社エンドサイトーシス検出色素(製品コード : E296, ECGreen -Endocytosis Detection)を HeLa 細胞に添加し、10 分、20 分、180 分後の AcidSensor 標識体(紫)とエンドソーム膜を同時に観察しました。 その結果、AcidSensor 標識マウス IgG が経時的に細胞内に取り込まれ、その蛍光輝点がエンドソームと共局在していることから、IgG がエンド サイトーシス経路で細胞内に取り込まれたことが確認されました。
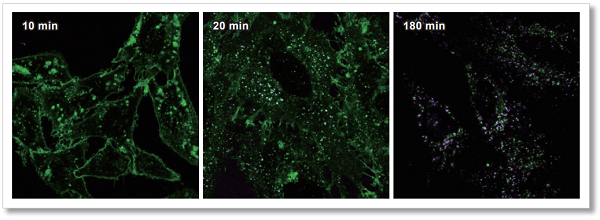
<検出条件>
緑:ECGreen (Ex = 405 nm, Em = 500-550 nm)
紫:AcidSensor (Ex = 633 nm, Em = 650-700 nm)
実験例:AcidSensor 標識 BSA、Mouse IgGの HeLa への取り込み実験
本キットを用いて標識したBSAまたはMouse IgGをHeLa細胞に添加し、2時間後のHeLa細胞の取り込みを観察しました。その結果、HeLa細胞内にAcidSensorの蛍光輝点が検出され、標識した対象物がそれぞれエンドサイトーシス経路にて取り込まれていることが確認できました。
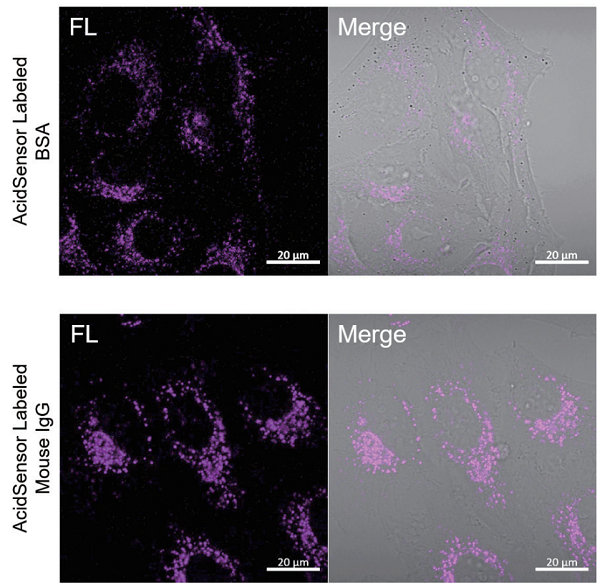
<検出条件>
検出装置:共焦点レーザー顕微鏡
Ex = 633 nm, Em = 650-700 nm
応用例: AcidSensor 標識アポトーシス細胞を用いたファゴサイトーシス活性評価
AcidSensor 標識体がマクロファージ等の細胞に取り込まれ、酸性環境下に到達することで Deep Red 蛍光が増大します。AcidSensor で Jurkat 細胞を標識後にアポトーシスを誘導し、さらに Calcein-AM で染色した THP-1 細胞由来マクロファージと共培養することで、アポトーシス細胞に対するファゴサイトーシスを評価しました。
その結果、フローサイトメトリーにて Calcein (Green) と AcidSensor (Deep Red) のダブルポジティブ細胞が観察されました(図1a) 。さらに、Cytochalasin D を用いて THP-1 細胞由来マクロファージのファゴサイトーシス機能を阻害したところ、ダブルポジティブ細胞の割合が減少したことから (図1b、1c) 、アッセイ系が正確にファゴサイトーシスを評価できていることが確認できました。
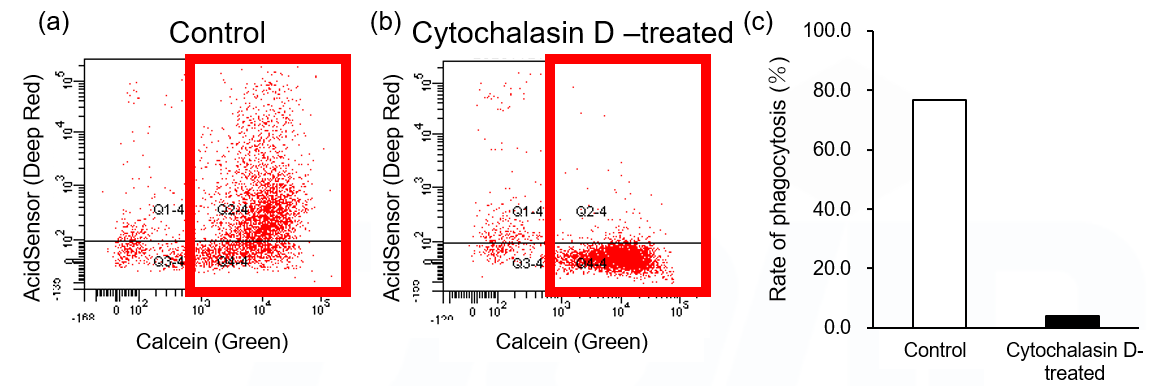
図1
近年の研究では、貪食細胞のミトコンドリア機能が阻害されることで細胞のエネルギー代謝が解糖系へシフトし、さらに貪食機能が低下することがわかっています*。実際に FCCP 存在下でファゴサイトーシスを評価したところ、 THP-1 細胞由来マクロファージのミトコンドリア膜電位 (MT-1, Red) 低下と (図2) 貪食作用の低下 (図3) が同時に観察されました。
*LH. Fairley, et al., Proc Natl Acad Sci U S A. 2023, 120(8):e2209177120.
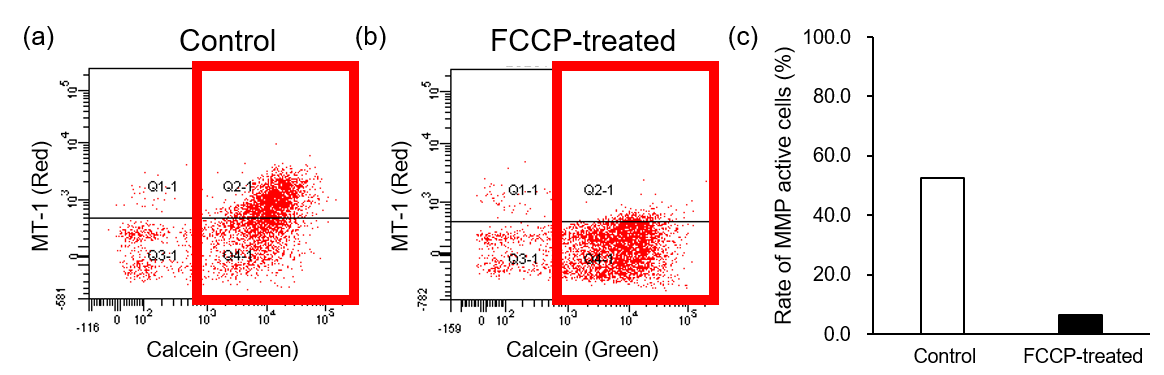
図2
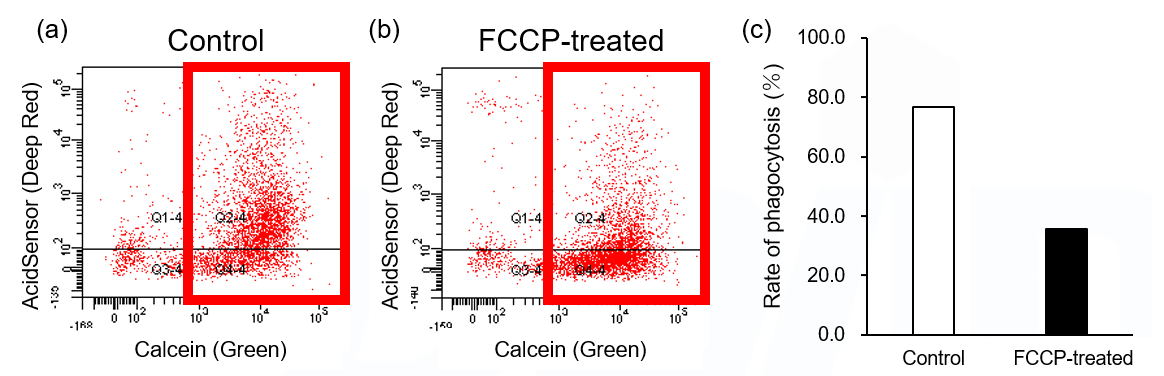
図3
[実験手順]
<AcidSensor 標識アポトーシス誘導細胞の準備 (Assay 前日)>
1. NH2-Reactive AcidSensor に DMSO 10 μl を加え溶解させた。
2. 5 μl NH2-Reactive AcidSensor 溶液 を 5 ml HBSS (+) に加え Working solution を作製した (1000 倍希釈)。
3. Jurkat 細胞を HBSS (+) で 2回洗浄した。
4. 5×107 cells のJurkat 細胞をチューブに取り、遠心後に上清のみを取り除いた。
5. Jurkat 細胞を 5 ml Working solution で懸濁した (1×107 cells/ml)。
6. 37℃ で 30 分間インキュベートし、AcidSensor 標識した。
7. 標識後、HBSS (+) で 2回洗浄した。
8. AcidSensor 標識 Jurkat 細胞を、0.5 μM スタウロスポリンを加えた培養培地 (10% FBS 入りRPMI 培地) に懸濁した。
9. インキュベータ内 (37℃、5% CO2存在下) で o/n 培養 (18時間) を行い、アポトーシスを誘導した。
10. アポトーシス誘導後、培養培地で洗浄しファゴサイトーシスアッセイに用いた。
<THP-1 細胞由来マクロファージを用いたファゴサイトーシスアッセイ>
1. マクロファージへ分化させるため、THP-1 細胞を 1x106 cells/ well となるように 6 well プレートに播き、100 nM PMA を加えインキュベータ内で 3日間培養した。
2. THP-1由来マクロファージを HBSS (+) で 2回洗浄後、 0.5 μg/ml Calcein-AM と MT-1 dye (Code: MT13、1000倍希釈) を含む HBSS (+) 溶液を加え、インキュベータ内で 30 分間インキュベートした。
3. 培養培地で2回洗浄した。
4. 10 μM Cytochalasin D で 1 時間、または 5 μM FCCP で 30 分間、薬剤を加えてインキュベータ内でインキュベートした。
5. 培養培地で2回洗浄後、上清を取り除いた。10 μM Cytochalasin D または 5 μM FCCPを含む培養培地で AcidSensor 標識アポトーシス誘導 Jurkat 細胞を懸濁し、3x106 cells/ well となるように加えた後、インキュベータ内 で 4時間インキュベートした。
6. HBSS で2回洗浄した。
7. Imaging Buffer solution (Code: MT13) 500μ を加え、セルスクレーパーを用いてTHP-1由来マクロファージを剥がした。
8. 細胞懸濁液を回収し、フローサイトメトリーにて解析した。
よくある質問
-
Q
サンプル溶液中の共存物は標識反応に影響しますか。
-
A
共存物の種類により影響することがあります。
溶液中にどのような物質が含まれるかを確認の上、状況に応じて標識に用いるサンプルの精製を行い、ご使用ください。
標識対象以外の分子量 10,000 以上のアミノ基を有する共存物は標識効率を低下させます。
また、アミノ基を持たない化合物でも、高分子の不純物が多いとフィルターの目詰まりの原因になり、標識・精製操作に支障がでる可能性もあります。
反応に使用する前に別途除去操作を行ってください。
-
Q
標識体を回収するWS buffer に細胞毒性はありますか?
-
A
WS buffer 中には、細胞毒性をほとんど示さない量の安定化剤(界面活性剤)を含んでいます。もし細胞への影響が気になる場合は、別途任意のバッファーを用いて標識体を回収してください。
-
Q
血清含有培地で標識体の取込みや観察ができますか?
-
A
血清成分がAcidSensor の性能に影響を与えることはありませんが、血清タンパク質によりエンドサイトーシス経路の取り込みが阻害される可能性があります。実験に応じて血清を含めるかどうかご検討ください。
-
Q
標識率はどのように算出すればよいですか。
-
A
標識体を WS buffer で5倍希釈して500nm と280 nmの吸光度を測定後、以下の式より標識率を算出してください。

A500: 500 nm の吸光度
A280: 280 nm の吸光度
εprotein: タンパク質の280nmでのモル吸光係数、
NH2-Reactive AcidSensor のWS buffer 中における A500 のモル吸光係数が 48400 です。
NH2-Reactive AcidSensor は280nmと500nmに吸収があり、280nm/500nmの比が 0.16です。
標識対象が IgG の場合、はεprotein は216,000 を使用してください。
-
Q
タンパク質1分子あたりにNH2-Reactive AcidSensor はいくつ標識されますか。
-
A
Mouse IgG において、1分子あたり平均3つのAcidSensor が標識されることを確認しています。
取扱条件
| 保存条件: 冷蔵,遮光 , 取扱条件: 吸湿注意 |