DAPGreen - Autophagy Detection

オートファジー(オートファゴソーム)の検出試薬
-
製品コードD676 DAPGreen - Autophagy Detection
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 5 nmol | ¥46,000 | 340-09291 |
 DAPGreenの最適濃度の検討については、
DAPGreenの最適濃度の検討については、
よくある質問の「DAPGreenの最適濃度の検討方法を教えてください」
をご覧ください。
性質
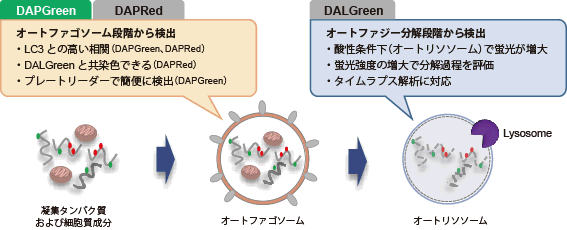
オートファゴソームで見るオートファジー
DAPGreenは、細胞内の不要なタンパク質・細胞小器官などの再利用や、代謝のための分解過程であるオートファジーを培養細胞に試薬を添加するだけで簡便に検出できる蛍光色素です。オートファジーマーカーのLC3を指標とした検出法とも高い相関性が得られています。
マニュアル
技術情報
原理
 |
|
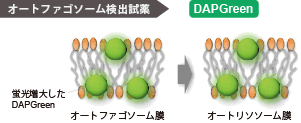 |
オートファゴソーム膜が形成される際に、DAPGreenは膜内に取り込まれ、脂溶性環境下に応答し蛍光が増大します。なお、オートファジーマーカーのLC3 を指標とした検出法とも高い相関性が得られています。 |
操作は試薬の添加だけ
遺伝子導入が不要。準備した細胞に試薬を添加するだけの簡単操作で蛍光イメージングを実現できます。
オートファジー検出試薬の比較表
蛍光顕微鏡だけでなくフローサイトメーターでも検出頂けます。またDAPGreenでは、プレートリーダーによる検出も実現しました。ご使用の装置で検出可能な蛍光特性をご確認の上、ご使用ください。
| 対応装置 | 蛍光特性 | 容量 / 使用回数 の目安 |
既存検出法 | |||
|---|---|---|---|---|---|---|
| 蛍光顕微鏡 | フローサイト メーター |
プレート リーダー |
||||
| DAPGreen | ○ | ○ | ○ | Ex. 425-475 Em. 500-560 ※ 共焦点顕微鏡では 488 nmにて励起可能 |
5 nmol x 1 / 35 mm dish: 25枚分 (0.1 μmol/lで使用時) |
LC3-GFP MDC Cyto-ID など |
| DAPRed (オートファゴソーム検出) |
○ | × | × | Ex. 500-560 nm Em. 690-750 nm |
5 nmol x 1 / 35 mm dish: 25枚分 (0.1 μmol/lで使用時) |
|
| DALGreen (オートリソソーム検出) |
○ | ○ | × | Ex. 350-450 Em. 500-560 ※ 共焦点顕微鏡では 488 nmにて励起可能 |
20 nmol x 1 / 35 mm dish: 10枚分 (1.0 μmol/lで使用時) |
LC3-GFP-RFP など |
※ DAPGreenとDALGreenの共染色イメージングはできません。
LC3との高い相関
オートファジーマーカーであるLC3を指標とした検出法と共染色を行い局在の比較を行った。
<検出条件>
DAPGreen:Ex. 488 nm / Em. 500-563 nm
スケールバー:10 μm
RFP-LC3発現Hela細胞にDAPGreen添加後、Rapamycinによりオートファジーを誘導しました。誘導から4時間後に、DAPGreen及びRFPの蛍光像を共焦点顕微鏡にて確認しました。結果、DAPGreenと、LC3が共局在する結果が得られた。
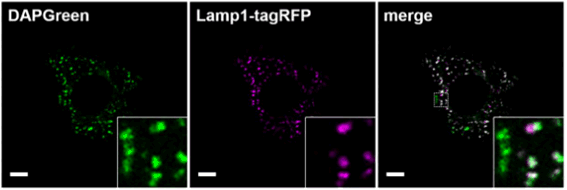
Lamp1との共染色
Lamp1-tagRFP発現MEF細胞へ、DAPGreenとの共染色を行いました。結果、リソソーム膜選択的なLamp1とDAPGreenが共局在する輝点(オートリソソーム)とDAPGreenのみが輝点となる箇所(オートファゴソーム)が確認できました。(スケールバー:10 μm)
詳細は論文にて解説。
データ引用元: H. Iwashita, H. T. Sakurai, N. Nagahora, M. Ishiyama, K. Shioji, K. Sasamoto, K. Okuma, S. Shimizu, and Y. Ueno, "Small fluorescent molecules for monitoring autophagic flux", FEBS Letters., 2018, 592, (4), 559–567.
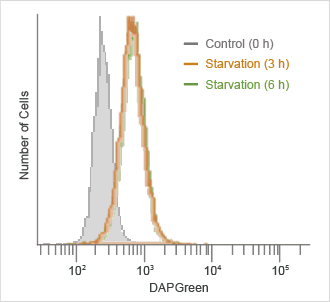
フローサイトでの定量解析
オートファジー誘導後に、DAPGreenの蛍光をフローサイトメーターにて検出しました。
<検出条件>
検出波長 :Ex. 488 nm / Em. 500-560 nm
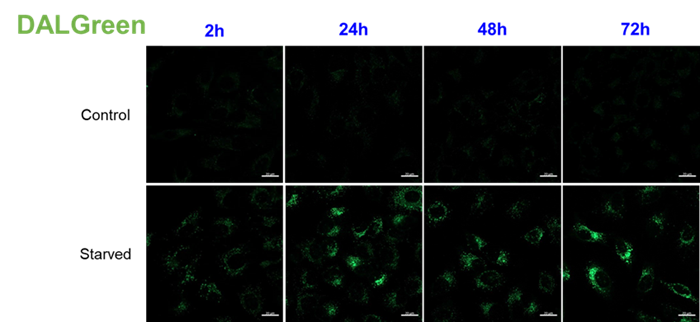
DAPGreenで染色後のHeLa細胞を、アミノ酸不含培地にて0、3、6時間培養し、フローサイトメーターにて検出した。結果、飢餓培養開始から3時間後には、強い蛍光シグナルが検出された。
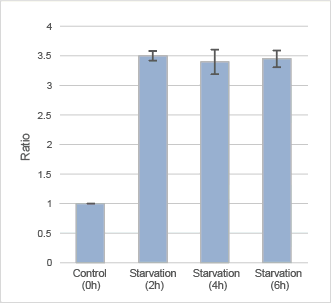
プレートリーダーでの定量解析
オートファジー誘導後のDAPGreenの蛍光を、プレートリーダーにて検出した。
<検出条件>
波長 :Ex. 450 nm / Em. 535 nm
DAPGreenで染色後のHeLa細胞を、アミノ酸不含培地にて0、2、4、6時間培養し、プレートリーダーにて検出した。結果、飢餓培養を開始してから2時間後には、コントロールより約3.5倍強い蛍光を確認した。
測定操作の詳細は、よくある質問「プレートリーダーでの定量解析の測定条件を教えてください。」をご参照ください。
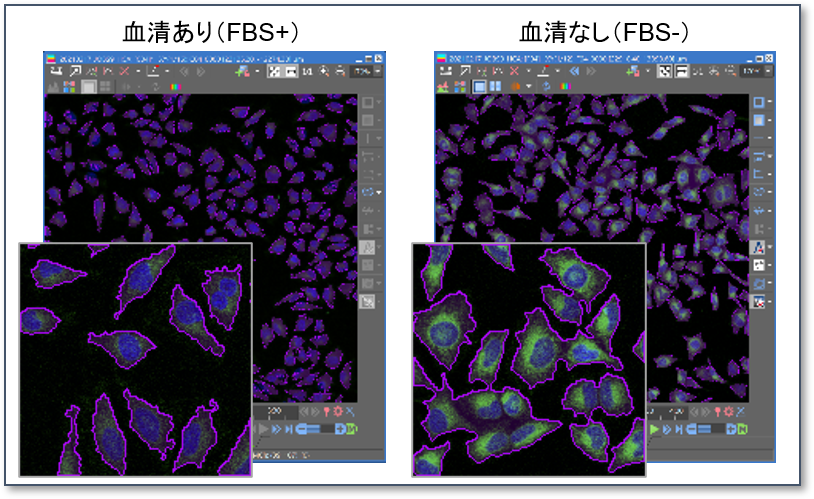
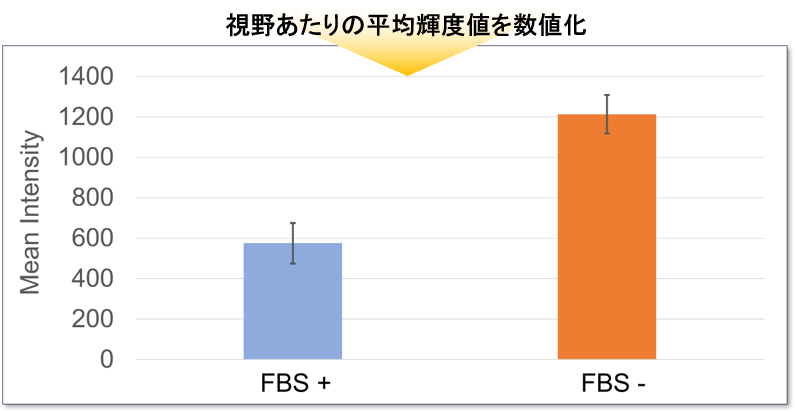
応用例:蛍光顕微鏡での数値化
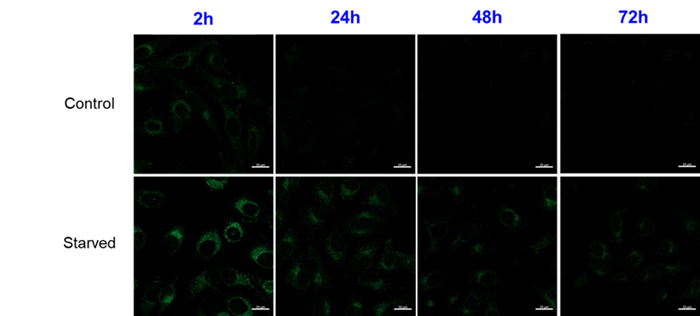
96-well マイクロプレートにHeLa細胞を播種して DAPGreen で染色後、一部のウェルのみ血清不含培地に置換して培養を継続しました。
培養後に視野あたりの DAPGreen の平均輝度値を計測した結果、血清不含有培地に置換したウェルで DAPGreen の輝度値は高くなることが確認されました。
<使用装置>
蛍光顕微鏡:Nikon 共焦点レーザー顕微鏡A1R
解析ソフト:NIS-Elements
<検出条件>
Ex:488 nm, Em : 500-550 nm
対物レンズ:CFIプランアポクロマート VC 20x
撮影モード:レゾナントスキャナ
XY解像度:512x512
<実験手順>
1. 96-well マイクロプレートに HeLa細胞を播種して培養
2. 培地を除去後、培養培地(血清入り)で 1 回洗浄
3. 調整した DAPGreen working solution を添加し、37℃ で 30分間インキュベート
4. 培地を除去後、培養培地(血清入り)で 2 回洗浄
5. オートファジーを誘導するウェルに無血清培地を加え、37℃ で 6時間インキュベート(その後、4%PFA固定)
6. 蛍光顕微鏡で観察
上記撮影の後、100倍の対物レンズで追加撮影し、細胞内の DAPGreen のシグナルをカウントした結果、血清ありの条件では細胞あたり平均1.5個だったのに対して、血清不含有培地では平均27個の DAPGreen のシグナルが検出されました。
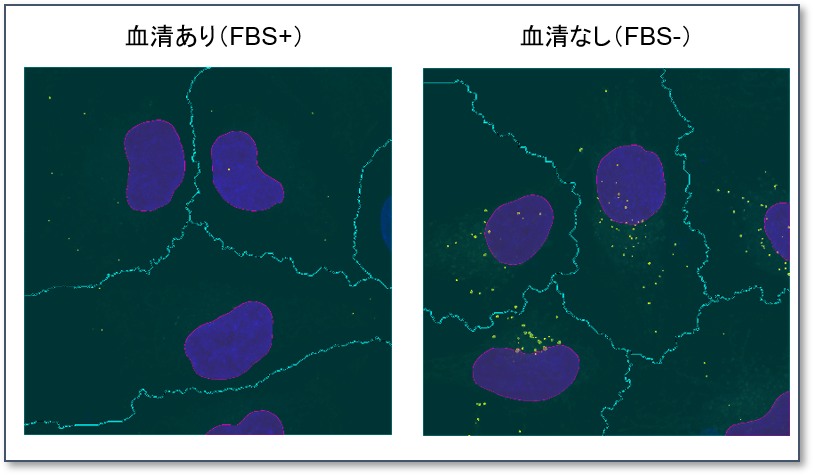
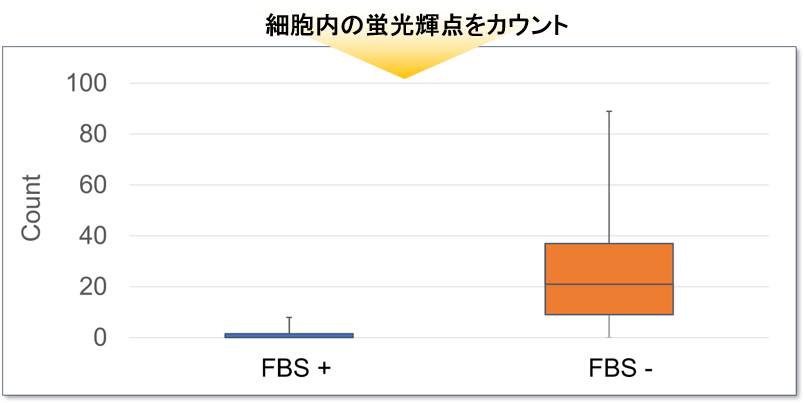
<使用装置>
蛍光顕微鏡:Nikon 共焦点レーザー顕微鏡A1R
解析ソフト:NIS-Elements
<検出条件>
Ex : 488 nm, Em : 500-550 nm
対物レンズ:CFIアポクロマート TIRF 100xC Oil
撮影モード:ガルバノスキャナ
XY解像度:512x512
※本データはユーザー様よりご提供頂きました。
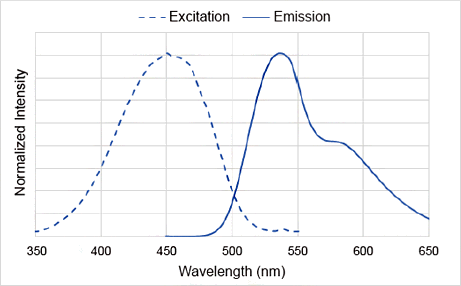
DAPGreenの励起、蛍光スペクトル
参考文献
| 文献No. | 対象サンプル | 装置 | 引用(リンク) |
|---|---|---|---|
| 1) | 細胞 (HeLa, MEF) |
蛍光顕微鏡 |
H. Iwashita, H. T. Sakurai, N. Nagahora, M. Ishiyama, K. Shioji, K. Sasamoto, K. Okuma, S. Shimizu, and Y. Ueno, "Small fluorescent molecules for monitoring autophagic flux.", FEBS Letters., 2018, 592, (4), 559–567. |
| 2) | 細胞 (HepG2; Huh-7) |
蛍光顕微鏡; フローサイトメーター |
L. Hu, T. Zhang, D. Liu, G. Guan, J. Huang, P. Proksch, X. Chen and W. Lin, "Notoamide-type alkaloid induced apoptosis and autophagy via a P38/JNK signaling pathway in hepatocellular carcinoma cells", RSC Adv., 2019, 9, 19855. |
| 3) | 細胞 (HepG2) |
蛍光顕微鏡 |
Q. Chu, S. Zhang, M. Chen, W. Han, R. Jia, W. Chen and X. Zheng, "Cherry Anthocyanins Regulate NAFLD by Promoting Autophagy Pathway", Oxid Med Cell Longev., 2019,DOI:10.1155/2019/4825949. |
| 4) | 細胞 (HLMVEC) |
蛍光顕微鏡 |
K. Koike, E. V. Berdyshev, A. M. Mikosz, I. A. Bronova, A. S. Bronoff, J. P. Jung, E. L. Beatman, K. Ni, D. Cao, A. K. Scruggs, K. A. Serban and I. Petrache, "Role of Glucosylceramide in Lung Endothelial Cell Fate and Emphysema", Am. J. Respir. Crit. Care Med., 2019,DOI:10.1164/rccm.201812-2311OC. |
| 5) | 細胞 (HeLa) |
蛍光顕微鏡 |
F. Hongbao,Y. Shankun, C. Qixin, L. Chunyan, C. Yuqi, G. Shanshan, B. Yang, T. Zhiqi, L. Z. Amanda, T. Takanori, C.Yuncong, G. Zijian, H. Weijiang and D. Jiajie , "De Novo-Designed Near-Infrared Nanoaggregates for Super-Resolution Monitoring of Lysosomes in Cells, in Whole Organoids, and in Vivo.", ACS Nano, 2019, 13, (12), 1446. |
| 6) | 細胞 (HeLa; A375) |
フローサイトメーター |
B. Yang, L. Ding, Y. Chen and J. Shi, "Augmenting Tumor-Starvation Therapy by Cancer Cell Autophagy Inhibition", Adv. Sci., 2020,DOI:10.1002/advs.201902847. |
| 7) | 細胞 (PC12) |
蛍光顕微鏡(超解像) |
Y. Tan, L. Yin, Z. Sun, S. Shao, W. Chen, X. Man,Y. Du and Y. Chen, "Astragalus polysaccharide exerts anti-Parkinson via activating the PI3K/AKT/mTOR pathway to increase cellular autophagy level in vitro.", Int. J. Biol. Macromol., 2020, DOI:10.1016/j.ijbiomac.2020.02.282. |
| 8) | 細胞 (Wild type Hepa 1-6) |
蛍光顕微鏡 (ImageJで数値化) |
Z. Peng, Y. Liao, X. Wang, L. Chen, L. Wang, C. Qin, Z. Wang, M. Cai, J. Hu, D. Li,P. Yao, A. K. Nüssler, L. Liu and W. Yang, "Heme oxygenase-1 regulates autophagy through carbon-oxygen to alleviate deoxynivalenol-induced hepatic damage., Arch. Toxicol., 2020, 94(2), 573. |
| 9) | 細胞 (マウス皮膚線維芽細胞) |
フローサイトメーター |
J. Kim, W.Y.Chee, N. Yabuta, K. Kajiwara, S. Nada and M. Okada, "Atg5-mediated autophagy controls apoptosis/anoikis via p53/Rb pathway in naked mole-rat fibroblasts", Biochem. Biophys. Res. Commun., 2020, 22, DOI:10.1016/j.bbrc.2020.05.083. |
| 10) | 細胞 (HeLa) |
蛍光顕微鏡(超解像) |
Q. Chen, M. Hao, L. Wang, L. Li, Y. Chen, X. Shao, Z. Tian, R. A. Pfuetzner, Q. Zhong, A. T. Brunger, J. Guan and J. Diao, "Prefused lysosomes cluster on autophagosomes regulated by VAMP8", 2021, doi:10.1038/s41419-021-04243-0. |
よくある質問
-
Q
DAPGreen working solutionは、どのくらい安定ですか?
-
A
DAPGreen working solutionの保存はできません。用時調製してください。
-
Q
DAPGreenのDMSO stock solutionは、どのくらい安定ですか?
-
A
DAPGreenのDMSO stock solutionは、調製後、-20℃、遮光下で保存してください。調製後1ヶ月間安定です。
また、使用量に応じて小分けし保存することをお勧めします。
-
Q
推奨の励起・蛍光フィルターを教えてください。
-
A
励起フィルター:425~475 nm
蛍光フィルター:500~560 nmなお、共焦点顕微鏡を用いて488 nm励起により蛍光観察した実績がございます。
弊社HP内の製品ページの実験例を参照ください。
-
Q
タイムラプスイメージングを行う上で注意点はありますか?
-
A
測定条件設定のための予備実験を行ってください。
試薬の特性上、染色直後は初期蛍光値が高くなる傾向があるため、以下の手順を参考に予備実験およびタイムラプスイメージングを行ってください。①予備実験
・コントロール細胞(オートファジーを誘導しない細胞)を用いる。
・取扱説明書に従い、Working soluitonで染色後、培養培地で2回洗浄する。
・通常培地を添加した後、蛍光の時間変化を観察する。
・下図の様に、染色後に細胞内の蛍光が次第に低下した後、蛍光の変化が安定してくる時間(図中 T)を確認する。
※条件は細胞の種類により変わる可能性があります。(参考)
HeLa細胞の場合、染色後の約60分経過すると蛍光強度が安定することを確認しております(DAPGreen)。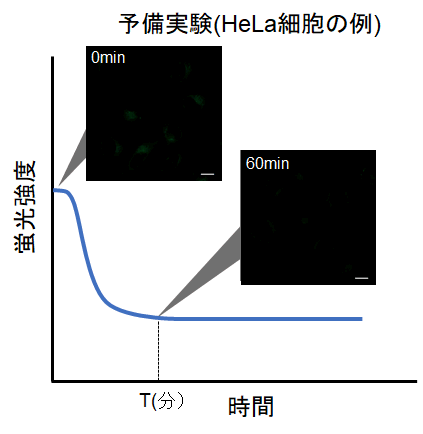
②タイムラプスイメージング
・細胞を Working solutionで染色後、培養培地中で細胞を37℃でインキュベートする。
※予備実験で設定した時間でインキュベートする。
※染色後、直ぐにはオートファジー誘導は行わない。
・インキュベート後にオートファジーの誘導を開始して、タイムラプスイメージングをする。(参考)
HeLa細胞をDAPGreenで染色し、通常培地中で60分間(予備実験で設定した時間)培養後、オートファジーを誘導しました。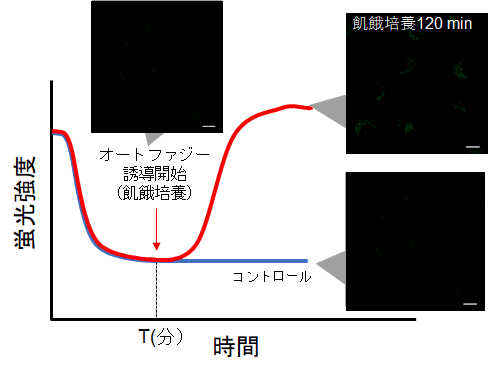
-
Q
DAPGreenの最適濃度の検討方法を教えてください。
-
A
試薬の特性により、試薬の濃度が高すぎたり低すぎたりすると、オートファジー誘導時と
誘導していないコントロールとの差が判りにくい場合があります。
下記の情報を参考に試薬濃度の検討することをお勧めします。細胞種によりDAPGreenの最適濃度は異なります。
DAPGreenを薄い濃度から(目安0.05 μmol/l)から数点段階的に振って
ご検討ください(濃い濃度は1 μmol/l前後を目安としてください)。(参考)
小社では、HeLa, HepG2、CHO細胞にて、細胞種毎のDAPGreenの最適濃度の検討を行いました。
DAPGreenを下記濃度で染色し、アミノ酸不含培地にて培養し、オートファジーを誘導しました。
その結果、下記の赤字の濃度条件ではコントロールとの差が見られました。細胞種 検討濃度 HeLa 0.4 µmol/l, 0.2 µmol/l, 0.1 µmol/l, 0.05 µmol/l HepG2 0.4 µmol/l, 0.2 µmol/l, 0.1 µmol/l, 0.05 µmol/l CHO 0.4 µmol/l, 0.2 µmol/l, 0.1 µmol/l, 0.05 µmol/l 【HeLa細胞】
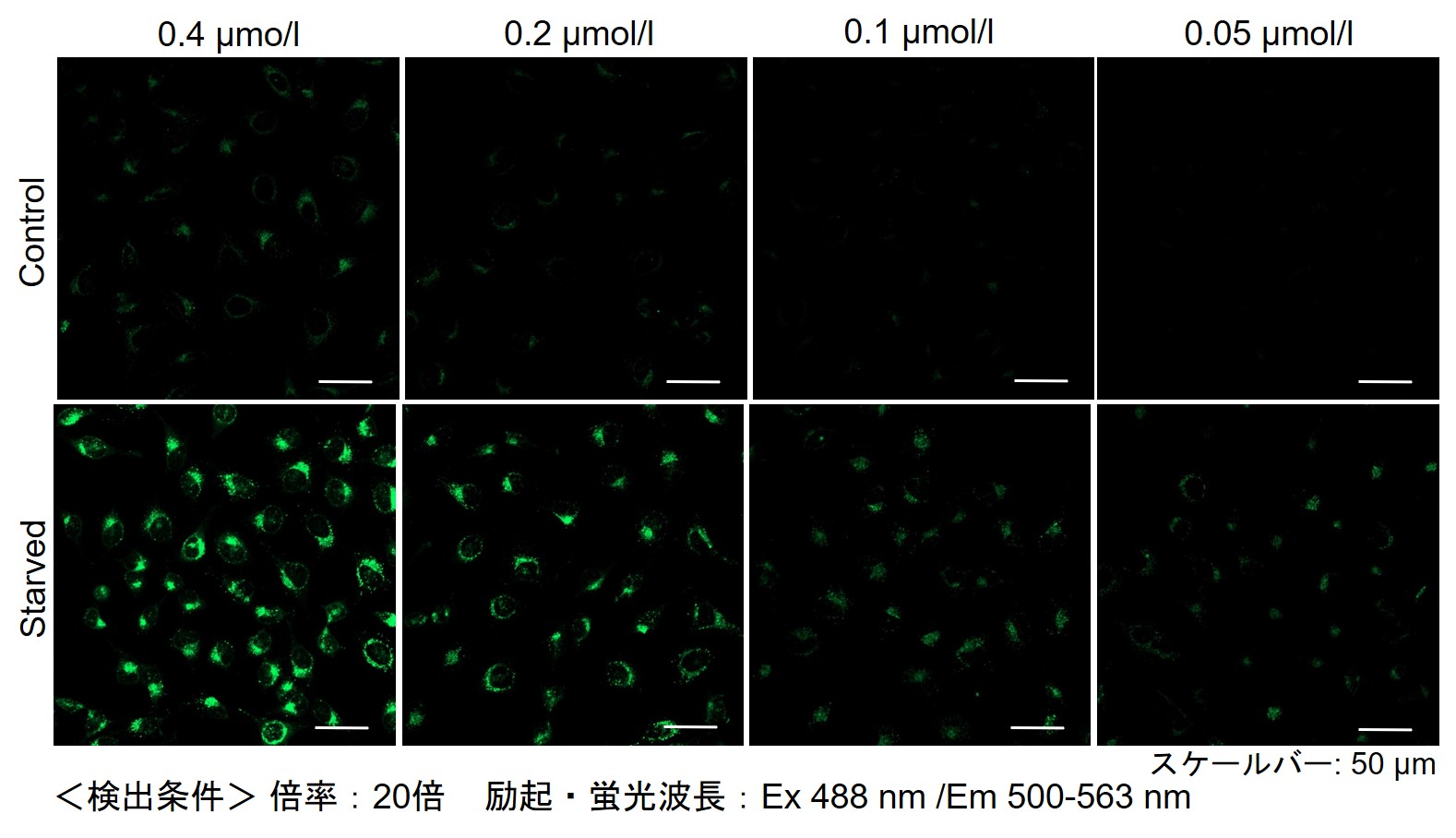
【HepG2細胞】
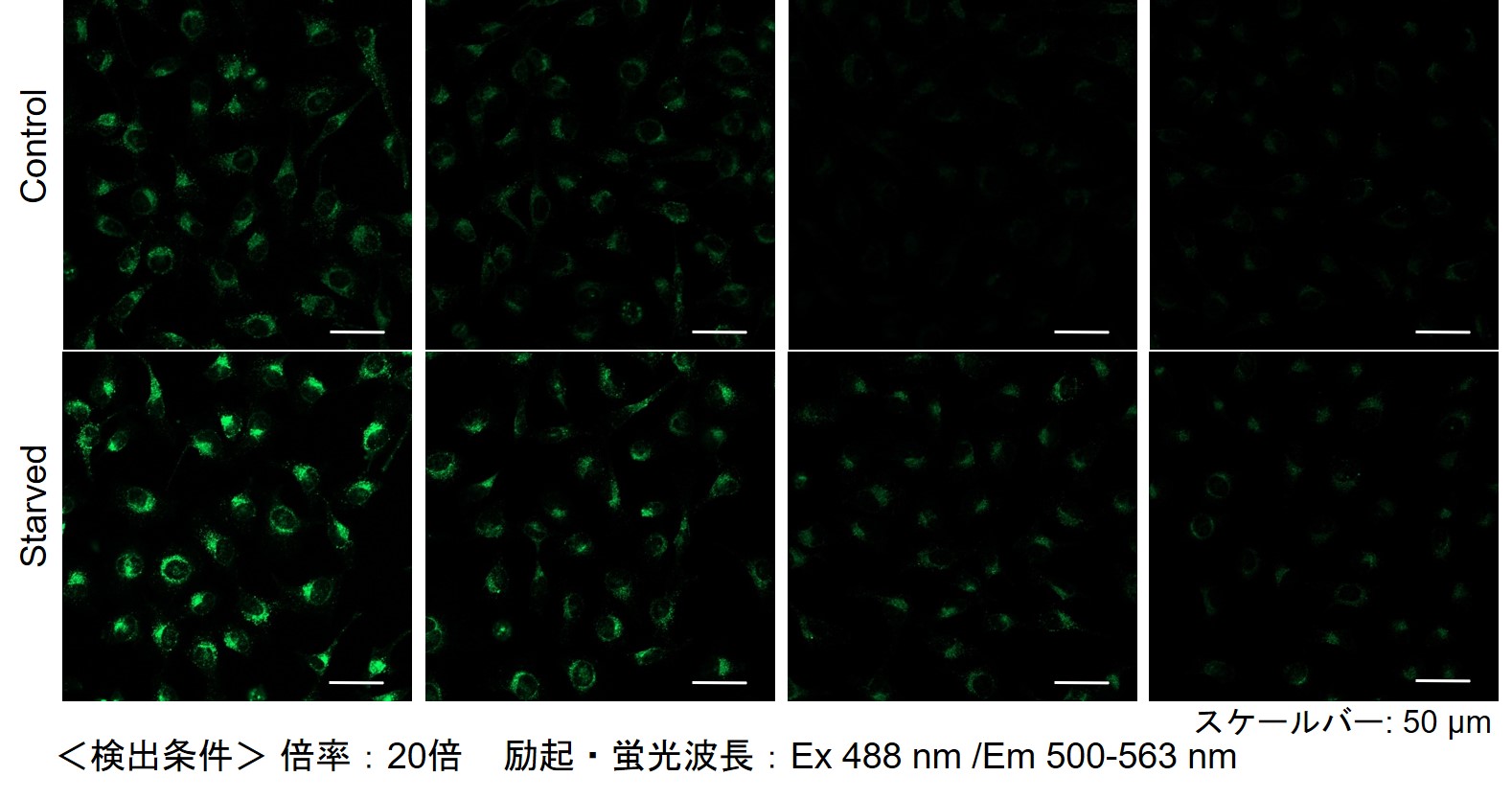
【CHO細胞】
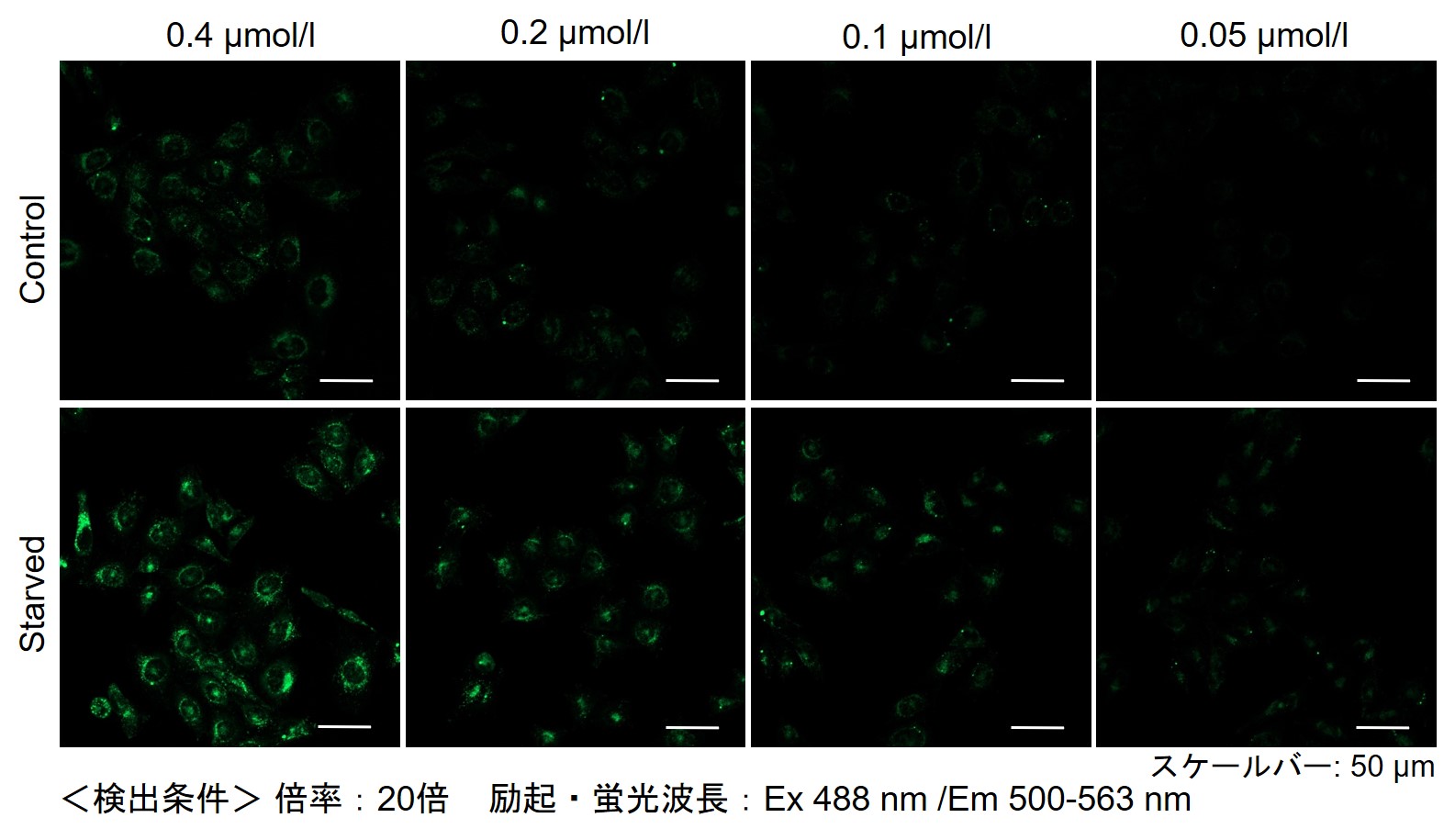
-
Q
プレートリーダーでの定量解析の測定条件を教えてください。
-
A
HeLa細胞を用いた測定例は下記となります。
DAPGreenで染色後のHeLa細胞を、アミノ酸不含培地にて0、2、4、6時間培養し、プレートリーダーにて検出
<操作>
1) 透明底のブラックプレートに細胞を播種 (HeLa cell, 1.6×10^4 cells/well, 100 µl/well)
2) 一晩培養(37℃, 5%CO2)
3) 上清を除き培地で調整したWorking solution(DAPGreen:0.1 µmo/l)を100 µl添加
4) 37℃で30分間インキュベート(37℃, 5%CO2)
5) 培地で洗浄(100 µl×2回)
6) 飢餓培地(富士フィルム和光純薬, code:048-33575)を添加(100 µl)
7) 37℃で各時間インキュベート
8) プレートリーダー(TECAN,infinite pro M200)で測定(Ex/Em=450/530nm)
(0minはHBSSに置換して測定)<結果>
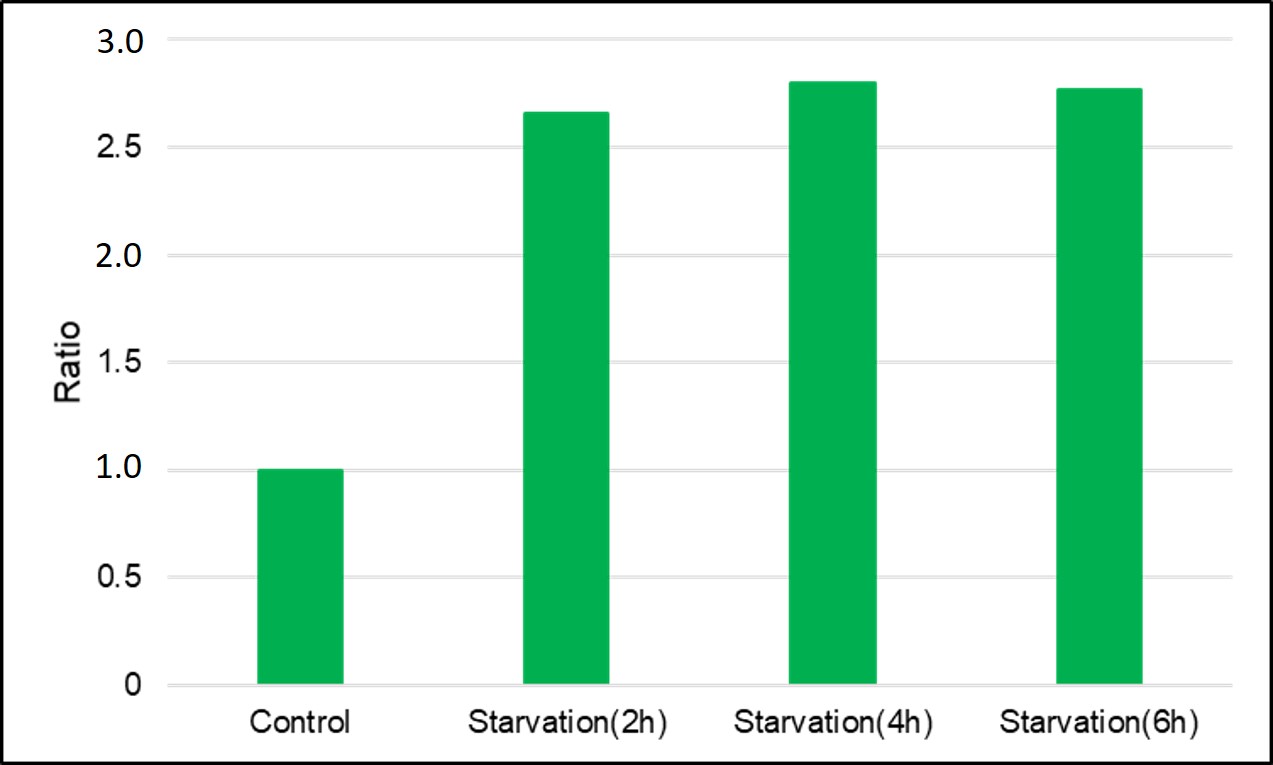 <検出条件> 波長 :Ex. 450 nm / Em. 535 nm
<検出条件> 波長 :Ex. 450 nm / Em. 535 nm飢餓培養を開始してから2時間後には、コントロールより約2.5倍強い蛍光を確認した。
-
Q
オートファジーにはどのような経路があり、 DAPGreenはどの状態を検出するのですか?
-
A
オートファジーには、Atg5依存的オートファジー(LC3が変化する)とLC3の変化を伴わない、Atg5非依存的オートファジーがあることが知られております*。
DAPGreenはオートファゴソーム膜に取り込まれ疎水環境下で蛍光を発し、オートファゴソームの状態を検出します。
*参考資料 : 新たなオートファジー機構の発見 清水重臣
▶初めて検出する細胞種や実験系の場合は、よくある問い合わせ【 DAPGreenの最適濃度の検討手順】をご参照ください。
-
Q
どのくらいの時間まで蛍光検出できますか?
-
A