新たなオートファジー機構の発見
 |
清水 重臣 東京医科歯科大学 難治疾患研究所 病態細胞生物 教授 |
Abstract
Autophagy is a catabolic process by which the contents of cells are digested within lysosomes. Autophagy is a low-level constitutive function, which is accelerated by a variety of cellular stressors such as nutrient starvation, DNA damage, and organelle damage. Basically, autophagy is a protective mechanism that facilitates the degradation of superfluous or damaged cellular constituents. The molecular basis of autophagy was elucidated in
autophagy-defective mutant yeasts. The subsequent identification of vertebrate homologs greatly expanded our understanding of the molecular mechanisms of autophagy, in which Atg5 and Atg7 are believed to be essential molecules. However, we discovered that mammalian cells possess an Atg5/Atg7 -independent type of autophagy, known as alternative autophagy. This novel type of autophagy is involved in the clearance of mitochondria from reticulocytes during erythrocyte differentiation. Both the conventional and alternative types of autophagy are involved in the protection of various diseases, including Parkinson's Disease.
キーワード: Autophagy, Alternative autophagy, mitochondria, Red blood cell maturation, Parkinson' Disease
1. はじめに
オートファジー(自食現象)とは、細胞内の自己構成成分(例えば、不要なタンパク質や傷害を受けたオルガネラなど)を分解する細胞機能である。オートファジーの中には、①細胞内成分が二重の膜によって周囲から隔離され、リソソームと融合することによって消化されるマクロオートファジー、②リソソーム膜の陥入を介して細胞質成分が消化されるミクロオートファジー、③個別の分子が直接リソソームに運搬されて消化されるシャペロン依存性オートファジーなどが存在するが、この中で、最も生理的、病理的に重要なオートファジーは、マクロオートファジーであり、単にオートファジーと称する場合は、マクロオートファジーを意味する。本稿においても、以後はマクロオートファジーをオートファジーと記す。
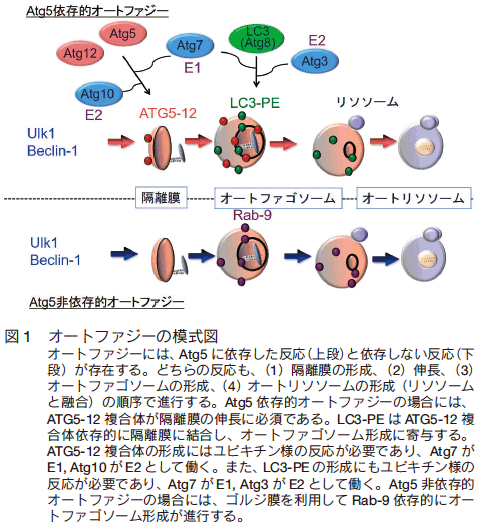
オートファジーの研究は、肝細胞の電子顕微鏡観察中に、二重膜を有するユニークな構造体が発見されたことが端緒となって、まず形態学的解析が進められた。オートファジーの初期段階では、隔離膜と呼ばれる小さな二重膜の構造物が形成される。この隔離膜は伸長すると共に湾曲し、細胞質やオルガネラを囲い込み、最終的には両端が融合したオートファゴソームが出来上がる。オートファゴソームが形成されると、その後にリソソームが直接融合し、リソソームの消化酵素によってその内容物が消化される 1)(図 1)。リソソームには、カテプシンなどのタンパク質分解酵素、酸性リパーゼ、DNA 分解酵素など様々な種類の消化酵素が含まれているため、内容物はほぼ完全に消化されることとなる。
上述した形態学的特徴が解析された後に、哺乳動物細胞で見出されたオートファジーが、出芽酵母においても見られることが明らかとなった。この出芽酵母でのオートファジー発見は、オートファジー研究の進捗を大幅に早めることとなった。即ち、出芽酵母の遺伝学解析によって、オートファジーに関わる分子が次々に明らかにされ、分子生物学的、生化学的解析が容易になったのである 2)。現在、酵母のオートファジー関連遺伝子を基盤として、哺乳動物におけるオートファジー機構が解き明かされつつあるが、オートファジーに重要な分子はその構造、機能共に酵母から哺乳動物細胞まで保存されている。即ち、オートファジーはあらゆる真核生物に共通に存在する普遍的な細胞機能なのである。これら一連のオートファジー解析の多くは、大隅良典先生とそのグループによるものであり、そのインパクトの大きさから 2016 年度のノーベル医学生理学賞を受賞した。本稿では、はじめにこのようなオートファジーの一般的な知見を概説し、その後に筆者らが独自に発見した新しいオートファジーに関して詳述する。
2. オートファジーとは何か?
前述のごとく、オートファジーとは自己成分を分解する細胞機能の 1 つである。では、生体内でオートファジーは、いつ、どこで、どのように機能しているのであろうか? この点に関しては、現在様々な角度から解明されつつあるが、オートファジー誘導刺激の観点とオートファジー分解物の観点から分類すると理解しやすい(図 2)。即ち、誘導刺激に関しては、定常状態でのオートファジー(恒常性オートファジー)と刺激によって誘導されるオートファジー(誘導性オートファジー)に大別でき、分解物に関しては、分解基質を選ばないバルクオートファジーと特定の基質のみを分解するセレクティブオートファジーに大別できる。例えば、最もよく解析されている栄養飢餓によるオートファジーは、アミノ酸不足による誘導性オートファジーであり、細胞質成分をランダムに分解することからバルクオートファジーに分類できる。このオートファジーは、自己タンパク質を大量に分解し再利用することによって、不足した栄養を補填しているものと考えられている。一方、細胞に DNA 傷害などのストレスが加わると、細胞内に傷ついたタンパク質やオルガネラが生じ、誘導性オートファジーがこれらの変性成分を分解する(セレクティブオートファジー)。生じたアミノ酸は、ストレス応答に必要なタンパク質を合成するために利用される。また、神経や心臓においてオートファジーを欠損させると神経細胞や心筋細胞に不溶性タンパク質が蓄積し神経変性疾患や拡張型心筋症を発症する。即ち、これらの細胞においては恒常性オートファジーが機能しており、変性タンパク質をセレクティブに分解していることが窺える。このように、オートファジーはストレス応答や恒常性の維持など、生体にとって必要不可欠な生命現象である。
3.オートファジーの分子機構
では、このようなオートファジーはどのように実行されるのであろうか? 前述のごとく、オートファジーの分子機構は、出芽酵母の遺伝学的解析から明らかにされ、これらが哺乳動物細胞に応用される形で研究が進行した。まず、隔離膜形成の初期段階においてはセリン-スレオニンキナーゼである ATG1(哺乳動物では Ulk1)複合体(Fip 200 などを含む)や PI3 キナーゼ classⅢ 複合体(Beclin1 などを含む)の存在が重要となる(図 1)。続いて起こる隔離膜の伸長にはATG8(LC3)システム(ATG3, 4, 7, 8 により機能する)と Atg5 システム(Atg5, 7, 10, 12, 16 により機能する)が必須である。これらはいずれも特徴的なユビキチン様の結合システムを用いている。即ち、ATG8(LC3)とフォスファチジールエタノールアミン(PE)、 Atg5 と ATG12 の共有結合がそれである。 Atg5-12 複合体は隔離膜の外膜に偏って分布し隔離膜の伸長に寄与し、オートファゴソームが形成される前後に膜から離脱する。一方、ATG8-PE 複合体は、 Atg5-12 複合体依存的に隔離膜やオートファゴソーム膜に結合し、オートファゴソーム形成に寄与する(図 1)3)。
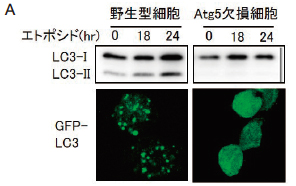
Atg5 や Atg7 を欠損したマウス由来の細胞においては、隔離膜の伸張に障害が生じオートファジーが実行されにくくなる。このため、 Atg5 や Atg7 はオートファジー実行に必要不可欠な分子として考えられてきた。また、酵母 ATG8 の哺乳類ホモログの一つである LC3 には、細胞質に存在する LC3-Ⅰ フォーム(前駆体 LC3)と、オートファゴソーム膜に結合した LC3-Ⅱフォーム( LC3-Ⅰ に PE が結合した形と考えられる)の二つのフォームが存在しており、オートファジーの誘導により LC3-Ⅰから LC3-Ⅱ に変換することが知られている(図 3A)。このために、LC3 の局在変化や LC3-Ⅱ 形成は、オートファジーの良いマーカーとして考えられてきた。
4.新しい分子機構を介したオートファジーの発見
上述したように、Atg5/Atg7 の存在や LC3 と PE との結合は、オートファジーに必要不可欠であると考えられてきた。しかしながら私たちは、Atg5 を欠損したマウスの胎仔には殆ど異常がみられない4)ことより、Atg5 に依存しない代替のオートファジー機構の存在を疑った。
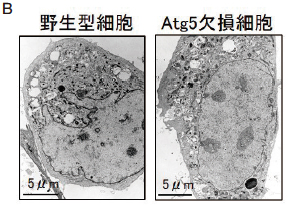
この代替メカニズムの存在を検討するために、野生型マウスと Atg5 欠損マウスより細胞を調製し、様々な刺激を加えてみた。すると、ラパマイシン(mTor 阻害剤)を投与した時には、野生型細胞でのみオートファジーが観察され、 Atg5 欠損細胞ではオートファジーは誘導されなかった。一方、エトポシド(DNA 傷害誘導剤)を加えた時には、野生型細胞において大規模なオートファジーが観察されたのみならず、Atg5 欠損細胞においても同程度の大規模なオートファジーが観察された(図 3 B)5)。また、この際に、オートファジーの各ステップ(隔離膜、オートファゴソーム、オートリソソーム)が全て観察できた。即ち、 Atg5 欠損細胞においても、正常細胞と同様の形態学特徴を持ったオートファジーが実行されているものと思われた。さらに、 Atg5 欠損細胞におけるオートファジーの存在を確認するために、オートファジーの初期反応の阻害剤である 3-methyl adenine をエトポシドと共に添加したところ、オートファゴソーム形成より前のステップでオートファジーが阻害され隔離膜が多数出現した。一方、オートファゴソームとリソソームの融合を阻害する BafilomycinA を投与したところ、オートリソソーム形成の直前のステップで阻害されオートファゴソームが大量に蓄積した。これらの結果は、 Atg5 欠損細胞においてもオートファジーが実行されていることを示している 5)。

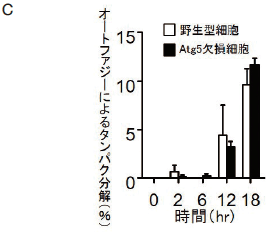
さらに、オートファジーの重要な機能であるタンパク質分解の有無を解析したところ、 Atg5 欠損細胞においても正常細胞と同様に、エトポシド投与によってオートファジー依存的タンパク質分解が行われていることが判明した(図 3C)。これらの結果より、 Atg5 を必要としないオートファジーの存在が明らかとなり、このオートファジーを我々は “alternative macroautophagy”(以下、「新規オートファジー」と記す)と命名した 5)。
上述の如く、LC3と PE との共有結合は、 Atg5 依存性のオートファジーに重要な反応であり、オートファジーの多寡を示す良い指標として認識されてきた 3)。そこで、新規オートファジーにおける LC3 の変化を検討した。野生型の細胞にオートファジーを誘導すると、 LC3-Ⅱが経時的に増加すると共に、GFP 融合 LC3(以下 GFP-LC3)が細胞質から隔離膜に移動し、GFP-LC3 がドット状に観察された。一方、 Atg5 欠損細胞では、オートファジーを誘導しても、 LC3-Ⅱ の出現や GFP-LC3 の変化は見られなかった(図 3A)。さらに、GFP-LC3 の蛍光画像と電子顕微鏡像を重ね合わせたところ、① Atg5 欠損細胞では、GFP-LC3 のドットが無いところにオートファジーが存在すること、②正常細胞では、GFP-LC3 のドットを含むオートファジーと、含まないオートファジーが存在することが明らかとなった。これらの実験事実は、①新規オートファジーには LC3 の変化は伴わないこと、②正常細胞では、 Atg5 依存的オートファジーと新規オートファジーが共存していること、を示している 5)。
5.新規オートファゴソームはトランス・ゴルジやエンドソームを介して形成される
それでは、このような新規オートファジーはどのようなメカニズムによって実行されるのであろうか? まず、既知のオートファジー関連分子の中から新規オートファジーに関わる分子を検討したところ、Ulk1, Fip200, Beclin1 などオートファジー機構の比較的上流で機能する分子群は、新規オートファジーにおいても重要な役割を果たしていることが判明した(図 1)。一方、 Atg5, Atg7, Atg9, Atg12, Atg16, LC3 の関与はみられなかった。これらの分子は、隔離膜からのオートファゴソーム形成に必須と考えられていることから、この反応の代替機構の存在が想定された。この機構を解析するため、微細構造観察等による検討を行った。その結果、①隔離膜はゴルジ体のトランス側(トランス・ゴルジ)より伸張してくること、②オートファゴソームの形成は、隔離膜とゴルジ体輸送小胞/エンドソームとの融合によって行われていること、を見出した 5)。実際に、トランス・ゴルジやエンドソームの融合を担っている低分子量 G タンパク質 Rab-9 は、オートファゴソーム/オートリソソーム上に存在していた。また、Rab-9 の発現を抑制すると新規オートファジーの誘導は妨げられた 5)。これらの結果より、新規オートファジーにおけるオートファゴソーム形成は、トランス・ゴルジ膜やゴルジ体輸送小胞膜/エンドソーム膜を利用して行われているものと考えられた(図 1)。
6.新規オートファジーは酵母から保存されている
Atg5 依存的オートファジーの研究が、酵母の解析を端緒として急激に進んだことを踏まえて、我々は酵母における新規オートファジー機構の有無を検討した。具体的には、 Atg5 欠損酵母細胞に様々な化合物を添加し、オートファジー誘導の有無を位相差顕微鏡と電子顕微鏡を用いて観察した。その結果、抗真菌薬のアンホテリシン B1 に新規オートファジー誘導活性が存在することが明らかとなった。即ち、アンホテリシン B1 を投与した Atg5 欠損酵母細胞の電子顕微鏡像では、①細胞質中のオートファゴソーム形成、②オートファゴソームと液胞(哺乳動物細胞のリソソームに相当)との融合、が観察され、③ western blotting では、ゴルジ体タンパク質や細胞質局在タンパク質の分解が認められた 6)。
さらに興味深いことに、アンホテリシン B1 による酵母細胞の新規オートファジーは、哺乳動物細胞と同様にトランス・ゴルジ膜を必要としていた。酵母細胞のゴルジ体は通常細胞質中に散在しているが、アンホテリシン B1 を投与すると、ゴルジ体が集積・多層化(スタック形成)し、その遠心部でトランス・ゴルジ膜が湾曲して細胞質成分やミトコンドリアを包み込みオートファゴソームを形成していたのである。実際に、ゴルジ体のスタック形成に関わる分子である GRH1 や湾曲に関わる分子である GRASP65 を欠損した酵母細胞では、オートファゴソーム形成が起こらないことが確認できた 6)。また、免疫電顕を用いて、オートファゴソーム膜上にゴルジ体分子が局在することも確認できた。時系列的には、アンホテリシン B1 によるゴルジのスタック形成、トランス・ゴルジ膜の変形によるオートファゴソーム形成、液胞との融合の順で進行するものと考えられた。
7.新規オートファジーの細胞機能
では、アンホテリシン B1 を投与したときに機能する新規オートファジーの役割は何であろうか? アンホテリシン B1 を投与すると、ゴルジ体から細胞膜への蛋白質輸送系あるいは細胞外への分泌系が障害されるため、新規オートファジーはゴルジ体から先に行き場を失った蛋白質を分解している可能性が考えられた。そこで、ゴルジ体から細胞膜、細胞外への輸送に関わる分子を欠損させたり、輸送を阻害する薬剤 CBM [1,3-cyclohexanebis(methylamine)]を投与させたりしたところ、全ての場合にゴルジ体の変形、オートファゴソーム形成、ゴルジ体タンパク質のオートファジー分解が実行されていた 6)。即ち、新規オートファジーはゴルジ体から細胞膜/細胞外への輸送が障害されて細胞内に貯留したタンパク質を分解する役割を果たしているものと考えられた。
また、この機能は、酵母細胞だけでなく哺乳動物細胞でも同様に観察された。インスリンは、膵臓のインスリン分泌細胞( β 細胞)で合成されゴルジ体を介して分泌されるが、細胞周囲のグルコース濃度が低下すると、更なる低グルコースを防ぐためにインスリン分泌が抑制される。この時 β 細胞内ではインスリンが貯留することになるが、新規オートファジーの活性化によってインスリンの過度な蓄積は回避されていた 6)(他に、SINGD と呼ばれるタンパク質分解系も機能する)。即ち、新規オートファジーは、ゴルジ体からの輸送障害が生じた時(ゴルジ体ストレス)に、不要タンパク質を除去する役割を担っているものと考えられた。
8.二つのオートファジーの使い分け
これまで、2 種類のオートファジー機構の存在を記してきたが、これらはどのように使い分けられているであろうか? Atg5 に依存したオートファジーも新規オートファジーも、タンパク質分解やオルガネラ分解を行っている。しかしながら、両方のオートファジーが分解する基質に一定の選択性がみられることが明らかにされつつある(但し、両方のオートファジーが同じ基質を分解するケースもある)。基質選択性が見られる代表として、p62 タンパク質が挙げられる。p62 タンパク質は Atg5 依存的オートファジーの基質としてよく知られているが、新規オートファジーでは分解されない。一方で、前述したゴルジ体からの分泌不全によって蓄積した分子の除去は、主に新規オートファジーによって実行されている。即ち、 1 つの細胞の中で、 2 種類の異なるオートファジー機構が活性化されており、異なる基質を分解しているのである。この基質の認識機構がどのように行われているかに関しては、今後の検討が必要である。
2 種類のオートファジーの個体における役割分担に関しても、更なる詳細な解析が必要であるが、現時点で明らかにされている機能の一端を、マイトファジーを例にして紹介したい。マイトファジーとは、セレクティブオートファジーの1つのタイプであり、ミトコンドリアを選択的に分解するオートファジーを意味する。
9.新規オートファジーを介したマイトファジー(赤血球分化)
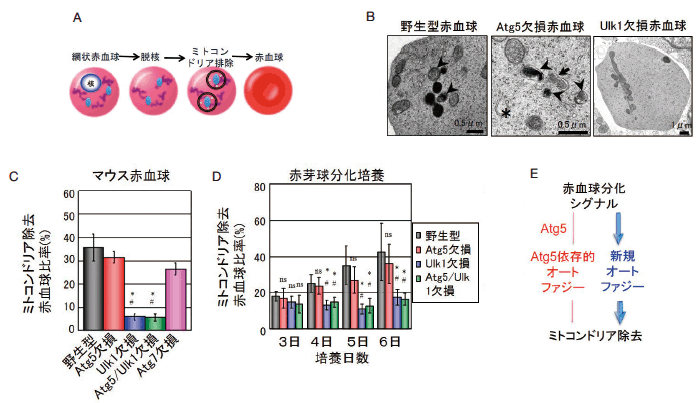
新規オートファジーが関わるマイトファジーの代表は、赤血球の最終分化におけるマイトファジーである。赤血球は、赤芽球、網状赤血球を経たあと脱核とミトコンドリアの除去が行われて成熟赤血球となる(図 4A)。ミトコンドリアの除去は、脱核後 24 時間以内に行われ、これはマイトファジーによって実行されていることが古くから示唆されていた。実際に、我々が電子顕微鏡を用いて正常マウスの網状赤血球を観察したところ、ミトコンドリアを二重の膜で囲んでいるオートファゴソーム、ミトコンドリアの一部を分解しているオートリソソームが観察された(図 4B)。即ち、ミトコンドリアの除去がマイトファジーによって行われているのは間違いないものと確認された。さらに、 Atg5 を欠損したマウスにおいても、ミトコンドリアを囲んだオートファゴソームやオートリソソームが同程度に観察され 5)(図 4B)、このマイトファジーは新規オートファジーによるものであると考えられた。そこで、電子顕微鏡を用いて、ミトコンドリアの多寡を胎仔肝臓(赤血球の造血の場である)と血液で検討したところ、 Atg5 欠損マウスにおけるマイトファジーは野生型マウスとほぼ同程度であり、赤血球の多くはミトコンドリアを失っていることが確認された 7)。一方で、新規オートファジー制御に関わっている Ulk1 を欠損したマウスにおいては、マイトファジーが誘導されず、赤血球内にミトコンドリアが多数残存していた7)(図 4B)。また、 Atg5/Ulk1 二重欠損マウスでは、 Atg5 の影響はほとんどなく、Ulk1 欠損マウスと同程度にミトコンドリアが残存していた。これらの事実は、胎仔における赤血球マイトファジーが新規オートファジーに大きく依存していることを示している7)。
赤血球中の残存ミトコンドリアをより定量的に評価するために、赤血球の分化マーカー Ter119, CD71 とミトコンドリア(Mitotracker deep red)を 3 重染色してフローサイトメーターにて測定したところ、正常赤血球や Atg5 欠損赤血球、 Atg7 欠損赤血球ではミトコンドリアが除去されていたが、Ulk1 欠損赤血球、Ulk1/Atg5 二重欠損赤血球ではミトコンドリアが残存していた(図 4C)7)。さらに、野生型マウス、 Atg5 欠損マウス、Ulk1 欠損マウス、 Atg5/Ulk1 二重欠損マウスから、それぞれ赤芽球を調製し、シャーレの中で血球を分化させたところ、野生型赤芽球と Atg5 欠損赤芽球では、脱核後にミトコンドリア除去が行われたが、Ulk1 欠損赤芽球と Atg5 /Ulk1 二重欠損赤芽球では、ミトコンドリア除去は行われなかった(図 4D)7)。これらの解析より、赤血球の最終分化時にみられるミトコンドリア除去は、 Atg5 依存的なオートファジーではなく、Ulk1 に依存した新規オートファジーに依存していることが証明された(図 4E)。なお、この赤血球最終分化時のマイトファジーもトランス・ゴルジ膜に依存して実行されていた。

10. Atg5 依存的オートファジーを介したマイトファジー(パーキンソン病の予防)
Atg5 依存的オートファジーを介したマイトファジーの代表として、パーキンソン病の予防があげられる。パーキンソン病は、黒質から線条体に投射するドーパミン性ニューロンの変性脱落により線条体のドーパミン枯渇が主原因と考えられる神経変性疾患で、振戦、固縮、無動、姿勢反射障害を主訴とする疾患である。家族性パーキンソン病の解析から複数の原因遺伝子が同定されているが、この中で Parkin(PARK2)と Pink1(PARK6)による病態形成にはマイトファジーが関わっている可能性が示されている。これら二つの遺伝子はともに常染色体劣性若年性パーキンソン病の原因遺伝子で、両者の臨床病像は酷似していることが知られている8)。また、ショウジョウバエを用いた遺伝学的解析から、① Parkin と Pink1 の欠落はともに、ドーパミン性ニューロンの脱落を示すこと、② Pink1 欠損による表現型は Parkin の発現によって補填されるが、 Parkin 欠損による表現型は Pink1 の発現によって補填されないこと、が明らかになっている。これらの事実は、 Parkin と Pink1 が同じシグナル伝達経路に乗っていて Pink1 が上流で機能していることを示している9, 10)。
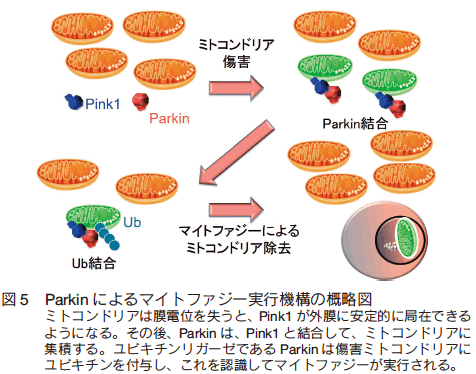
Youle らは、HeLa 細胞等の培養細胞に CCCP(Carbonyl cyanide m-chlorophenyl hydrazone;ミトコンドリアの膜電位を枯渇させる薬剤)を添加した際に、マイトファジーが惹起されることを発見した11)。さらに、この分子メカニズムは複数のグループによって解析され、以下のステップが明らかとなっている。即ち、①ミトコンドリアは膜電位を失うと、 Pink1 が外膜に安定的に局在できるようになる、② Parkin は、 Pink1 の局在依存的にミトコンドリアに集積する、③ユビキチンリガーゼである Parkin の集積により、傷害ミトコンドリアにはユビキチンが付与される。④このユビキチンが認識されマイトファジーが実行される、というシナリオである(図 5)12, 13)。 Parkin や Pink1 に異常が生じると、このシナリオが破綻し、病的ミトコンドリアが残存することによって、疾患が発症するものと考えられる。実際に、上記のシナリオは正常の Parkin においては実行されるものの、家族性パーキンソン病患者由来の Parkin では実行されない。これらの事実は、マイトファジーによるミトコンドリアの品質管理の破綻が、パーキンソン病の病態形成に関与していることを示している。この Parkin によるマイトファジーは Atg5 の欠損によって大きく損なわれるため、 Atg5 依存的オートファジーが大きな役割を果たしているものと考えられる。
11.マイトファジーの検出
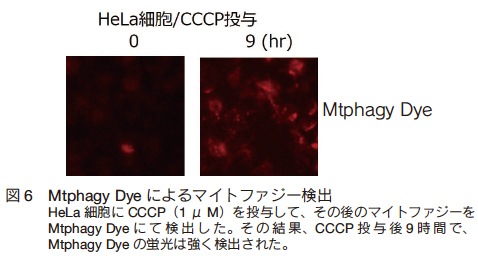
2 つの系統を介したマイトファジーは、更に広範な生命現象に関わっているものと思われるが、これらの解析を進めるためには、マイトファジーを適切に検出することが重要である。現時点では、細胞にマイトファジー感受性遺伝子を導入する方法、マイトファジー感受性化合物を用いる方法、免疫染色や western blot を用いる方法があり、いずれも両方のマイトファジーを検出することができる。マイトファジー感受性遺伝子としては、Keima 遺伝子もしくは GFP-RFP 融合遺伝子のアミノ末端にミトコンドリア局在シグナルを付与した合成遺伝子を用いる。これらを細胞に発現させることにより、Keima タンパク質、GFP-RFP 融合タンパク質をミトコンドリアに局在させることができる。前者は 2 種類の蛍光ピークを発するタンパク質であり 1 種類の蛍光波長のみが酸性環境で変化することを利用してオートリソソーム内(酸性環境)のミトコンドリアを検出する。後者は、GFP の蛍光は酸性環境で減弱するが、RFP の蛍光は酸性環境の影響を受けないことを利用してオートリソソーム内のミトコンドリアを検出する。マイトファジー感受性化合物としては、 Mtphagy Dye が有用である。 Mtphagy Dye はミトコンドリア指向性を有する蛍光化合物で、酸性環境下で初めて蛍光を発する。このため、ミトコンドリアがオートリソソームに取り込まれる時に蛍光が出現する(図 6)。免疫染色や western blot を用いる方法では、ミトコンドリア局在タンパク質を可視化/定量することにより、ミトコンドリアの絶対量を検出する。遺伝子や化合物を用いる方法では、ミトコンドリアがオートリソソームに取り込まれるフェーズを検出するのに対し、免疫染色などではミトコンドリアが分解されるフェーズを検出する。このため、両者の結果に乖離が生じる可能性があり、マイトファジー動態を正しく解析するためには、複数のアッセイ法を組み合わせることが望ましい。
12.おわりに
本稿では、Atg5 や Atg7 に依存しない新規オートファジー機構を中心に、オートファジーの生理機能、病理機能に関して概説した。 Atg5 依存的オートファジーに比して、新規オートファジーに関する知見は充分ではない。具体的には、①新規オートファジー実行のメカニズムの詳細、②新規オートファジーの生理機能、③新規オートファジーの変調による疾患など、今後解決していくべき問題は多い。
| 著者プロフィール | |
| 氏名 | 清水 重臣(Shigeomi Shimizu) |
|---|---|
| 所属 | 東京医科歯科大学 難治疾患研究所 病態細胞生物 教授 |
| 連絡先 | 〒113-8510 東京都文京区湯島1-5-45 TEL: 03-5803-4692 FAX: 03-5803-4821 E-mail : shimizu.pcb@mri.tmd.ac.jp |
| 出身学校 | 大阪大学医学部卒業 |
| 学位 | 医学博士(大阪大学) |
| 専門分野 | 細胞生物学(特に、細胞死、オートファジー、ミトコ ンドリア) |