LLPS Starter Kit
相分離液滴 作製・観察スターターキット
- BSA(ウシ血清アルブミン) タンパク質を用いて相分離液滴の作製ができるオールインワンキット
- マイクロピペットと顕微鏡だけで液滴の観察が可能
- 計算例や操作詳細を記載した取扱説明書付き
-
製品コードLL01 LLPS Starter Kit
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 1 set | ¥19,800 | 341-10211 |
| 1 set | BSA BSA Dissolving Buffer (20 mmol/l HEPES pH7.4, 150 mmol/l NaCl) Assay Buffer (60 mmol/l HEPES pH7.4, 450 mmol/l NaCl) 30% PEG8000 Solution Slide Glass with Double-Sided Tape Cover Glass 1.5 ml Micro Tube 0.5 ml Micro Tube |
10 mg× 1 × 1 × 1 × 1 × 2 × 4 × 4 × 4 |
|---|
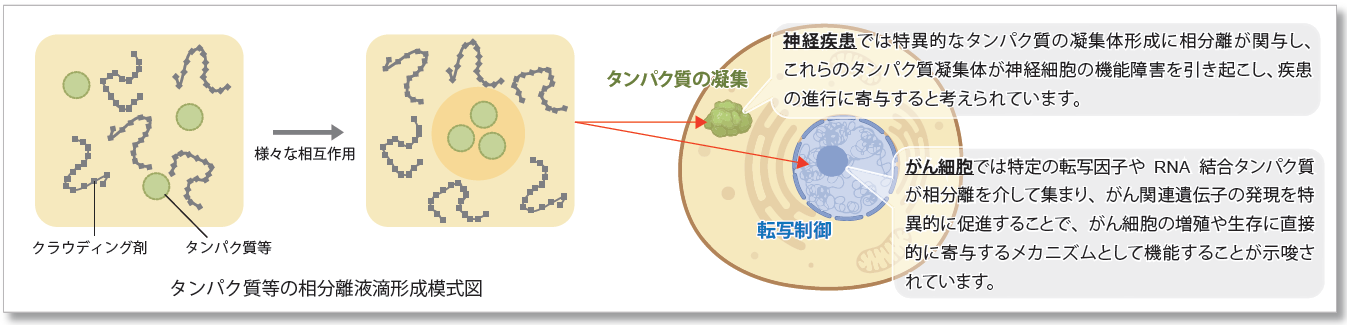
液- 液相分離(LLPS)とは
液‐液相分離( liquid-liquid phase separation: LLPS)は細胞内で特定の分子が局所的に集まり、液体のような性質を持つ生体分子の凝集体(液滴)を形成する現象です。近年、LLPS が細胞内での多くの生物学的プロセスに影響を与えることが明らかになり注目を浴びています。 相分離によって形成される液滴の研究はまだ初期段階ですが、これらの生物学的な現象がどのようにして細胞の機能や疾患の発症に影響を与えるかを解明することは、新しい治療法の開発につながる重要な鍵と考えられてます。
参考文献 E. Dolgin, Nature, 2018, DOI: 10.1038/d41586-018-03070-2.
性質
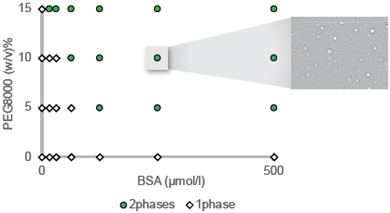
生体内における相分離現象を理解するための一つのステップとして、精製タンパク質を使用し、細胞を用いない系での相分離液滴の観察が行われています。精製タンパク質の液滴としてのふるまいを解明するための手段として、様々な化学物質を加えた環境で液滴がどのような挙動を示すか観察することにより、液滴が形成されるメカニズムを解析する研究が行われます。
本製品は、液滴を作製する際によく用いられる手法を元に、必要な試薬、容器類を同梱した、初めて実験をされる方向けのオールインワンキットのキットです。BSAをポジティブコントロールとして、作製したプレパラートで相分離により形成したドロップレットの基本的な顕微鏡観察を行うことが可能です。
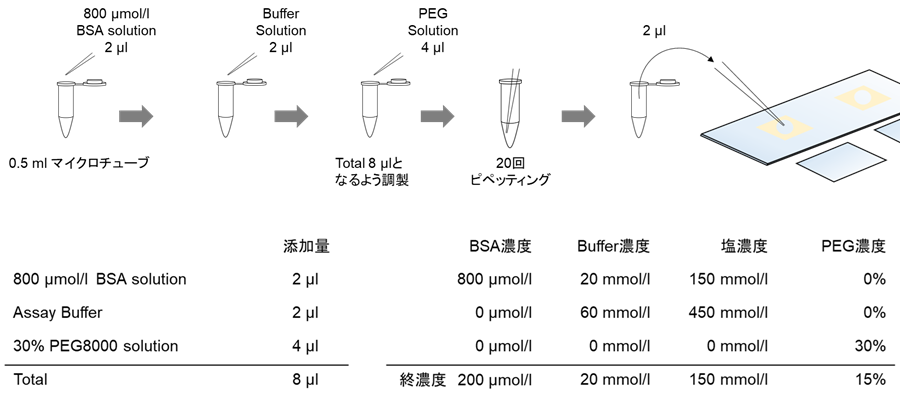
図1. 液滴作製操作及び各種組成表
マニュアル
技術情報
LLPS 研究をすぐにはじめられるキット
一般的にLLPS 研究を始める際には、細胞を用いない系で標的タンパク質が液滴を形成するかの確認を行うことが多いです。
しかしながらこのステップも、タンパク質によって最適条件は異なり、pH や塩の種類、クラウディング剤の有無※など様々な検討事項や注意点
があり、またさらに取り揃える試薬も多いため、初めての検討時には多くの労力がかかります。
小社ではLLPS研究をこれからは始める方に最適な2種類のキットを準備しております。
※ クラウディング剤(分子夾雑物再現剤): 細胞内の混みあった環境を再現するために添加される、PEG やFicoll などの高分子。
-
▶ 液滴作成法・観察方法の確認
・マイクロピペットと顕微鏡だけで液滴の観察が可能
・計算例や操作詳細を記載した取扱説明書付き
・液滴形成のポジティブコントロールに最適
-
▶ 標的タンパク質液滴の最適条件の確認
-
・液滴作製条件の検討に必要な試薬のセット
・本キットでクラウディング剤、pH、塩の検討が可能
・pH の異なる緩衝液を混合し各種pH の緩衝液調整が可能
・緩衝液のpH 調整方法を記載した取扱説明書付き
-
作製・観察スターターキットを用いた時間経過によるBSAタンパク質の相分離液滴の観察
取扱説明書記載の方法でBSAの相分離液滴を作製し、蛍光顕微鏡(機種 : BZ-X710 : KEYENCE社)にて時間経過による変化を観察しました。

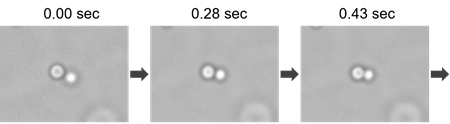
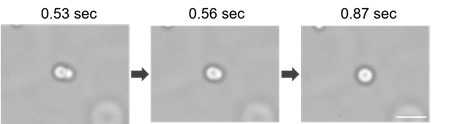
相分離液滴の融合の観察
相分離液滴であることを確認するために作成したBSA液滴の流動性を確認しました。LLPS Starter Kitを用いて作製したBSAの相分離液滴の融合の様子を、顕微鏡にて明視野観察しました。
※使用顕微鏡: KEYENCE社 BZ-X710 (60倍率)
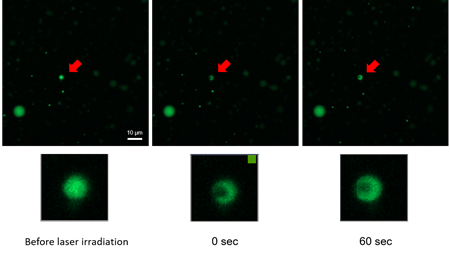
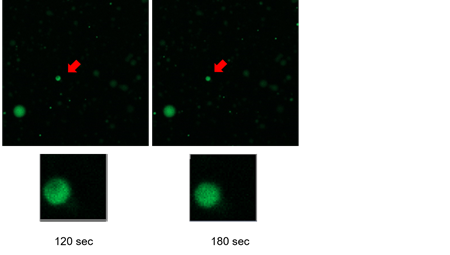
相分離液滴の光退色後蛍光回復法(FRAP)測定
FRAP測定は液滴を構成するタンパク質に蛍光タンパク質や蛍光色素で標識し、作製した液滴の一部をレーザーで退色させ、その蛍光が時間経過により回復するかを観察する方法です。退色させた液滴に流動性がなければ、退色した部分はそのままです。それに対し、液滴が流動性のある相分離液滴であれば退色した部分に周りの分子が入って蛍光が回復してくるため、相分離液滴の確認方法として汎用されています。本キットと小社製品(LK01) Fluorescein Labeling Kit – NH2を使用してFRAP測定を行った例を以下に掲載します。
蛍光色素を標識したBSAを用いて相分離液滴を作製し、30分後にFRAP測定を行いました。レーザー照射後、退色した液滴の蛍光が回復する様子が観察できました。
※本実験のBSAの終濃度は100 µmol/lとした。また蛍光色素標識BSAが0.5%含まれるように調製した。
※蛍光色素の標識には、 BSA 100 µgに対し、(LK01) Fluorescein Labeling Kit – NH2 1 sampleを用いて標識した。
※使用顕微鏡:Zeiss社 LSM 8 (63倍率)、 Ex: 488 nm / Em: 500-600 nm, 0.5%, 500V
よくある質問
-
Q
1キットで何回観察できますか。
-
A
キット付属のスライドガラスを用いれば、4回観察可能です。
また、別途、スライドガラス、両面テープ、カバーガラスをご準備いただければ約20回作製、観察可能です。
-
Q
両面テープ付スライドガラスは自分で作製可能でしょうか。
-
A
キット付属の穴開き両面テープ貼付スライドガラスはご自身でも作製可能です。
両面テープを穴あけパンチにて穴を開け、スライドガラスに貼り付けてご使用下さい。
使用実績のあるスライドガラス、両面テープ、カバーガラスは下記の通りです。
スライドガラス
松浪硝子工業社 「スライドグラス 白縁磨 No.1」 型番:S1111両面テープ
日東電工社「再はく離可能&強接着 両面接着テープ」型番: No.5000NS (テープ幅: 10 mm)カバーガラス
松浪硝子工業社 「NEOカバーグラス」 型番: C024321
-
Q
液滴の観察ができません。
-
A
原因として以下の点が考えられますので、ご確認ください。
1. 温度により相分離液滴の数が増減する可能性があります。室温20–25℃で実験されることを推奨します。
2. ピペッティングを行う前に、泡立ちや、壁面に溶液が付着している場合は、しっかりと混合できない場合があります。卓上遠心機などを用いて溶液を落としてからピペッティングしてください。またピペッティングは泡立たないように優しく行ってください。
3. 様々な要因により相分離液滴のでき方が異なる場合がございます。サンプル作製し、30分後、1時間後、2時間後と測定時間を伸ばして下さい。
4. 調製したBSAの濃度が低い可能性があります。BSA solutionを1000 µmol/lで調製して下さい。
5. 滴下した溶液の端がドロプレットを確認しやすく、まずは溶液の外周を確認することを推奨します。また、顕微鏡のレンズも4倍率、20倍率、60倍率と、相分離液滴の位置を確認しながら倍率を上げていくことを推奨します。
-
Q
ピペッティングの回数は20回でいいですか。
-
A
溶液が十分混合するために本キットの実験系においてはピペッティングを20回に設定しております。BSA以外の実験系を試される場合、溶液が十分混合されるようピペッティング回数を設定して下さい。またピペッティング回数は統一されることを推奨します。
-
Q
相分離液滴であることを確認するにはどうすればいいですか。
-
A
観察物が流動性を持った液滴であることを証明するために、液滴同士の融合の観察や液滴の球形度の測定、FRAP測定などが行われます。詳しくは本製品ページの技術情報:相分離液滴の光退色後蛍光回復法(FRAP)測定、相分離液滴の融合の観察をご覧ください。
取扱条件
| 保存条件: 冷蔵 |