LLPS Forming Condition Screening Kit
相分離液滴 作製条件検討キット
- 相分離液滴の作製条件検討を実施するために必要な試薬のセット
- 本キットでクラウディング剤、pH、塩の検討が可能
- 計算例や緩衝液のpH調整方法を記載した取扱説明書付き
-
製品コードLL02 LLPS Forming Condition Screening Kit
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 300 tests | ¥39,800 | 348-10221 |
| 300 tests | PEG400 PEG4000 PEG8000 500 mmol/l MES Buffer Solution pH 5.5 500 mmol/l MES Buffer Solution pH 7.0 500 mmol/l Phosphate Buffer Solution pH 6.0 500 mmol/l Phosphate Buffer Solution pH 7.5 500 mmol/l HEPES Buffer Solution pH7.0 500 mmol/l HEPES Buffer Solution pH8.0 500 mmol/l Tris-HCl Buffer Solution pH7.0 500 mmol/l Tris-HCl Buffer Solution pH9.0 2 mol/l Sodium Chloride Solution 2 mol/l Potassium Chloride Solution 2 mol/l Ammonium Sulfate Solution |
15 g×1 15 g×1 15 g×1 10 ml×1 10 ml×1 10 ml×1 10 ml×1 10 ml×1 10 ml×1 10 ml×1 10 ml×1 20 ml×1 20 ml×1 20 ml×1 |
|---|
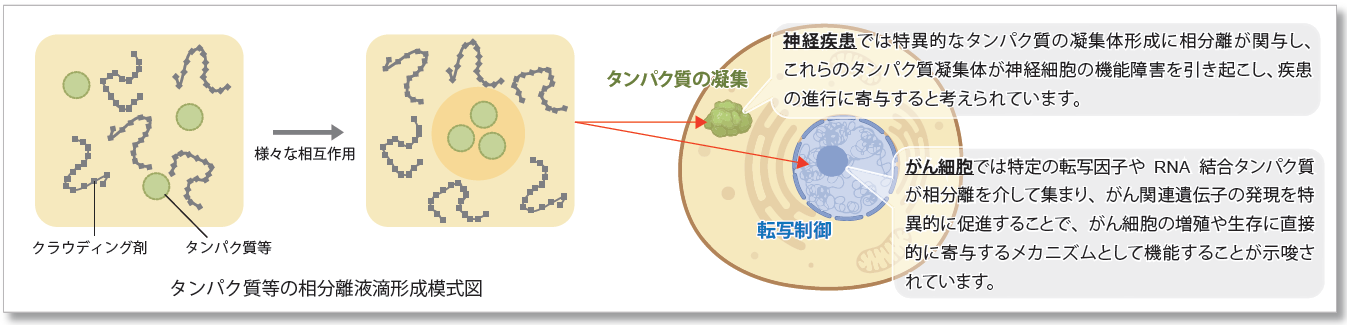
液- 液相分離(LLPS)とは
液‐液相分離( liquid-liquid phase separation: LLPS)は細胞内で特定の分子が局所的に集まり、液体のような性質を持つ生体分子の凝集体(液滴)を形成する現象です。近年、LLPS が細胞内での多くの生物学的プロセスに影響を与えることが明らかになり注目を浴びています。 相分離によって形成される液滴の研究はまだ初期段階ですが、これらの生物学的な現象がどのようにして細胞の機能や疾患の発症に影響を与えるかを解明することは、新しい治療法の開発につながる重要な鍵と考えられてます。
参考文献 E. Dolgin, Nature, 2018, DOI: 10.1038/d41586-018-03070-2.
性質
生体内における相分離現象を理解するための一つのステップとして、精製タンパク質を使用し、細胞を用いないin vitroの系での相分離液滴の観察が行われています。しかし、相分離液滴を形成するタンパク質であってもpHや塩濃度によって液滴を形成しない場合があり、液滴形成条件を検討する必要があります。この検討は、タンパク質が生化学的環境で液滴を形成するかどうかの検証のみならず、どのようなメカニズムで液滴を形成しているのかを知る手がかりにもなります。なお、細胞外の系では、細胞内に比べて分子の混み合い効果が減少することにより、液滴ができにくくなることがあります。この場合、PEGなどの高分子をクラウディング剤として添加し、細胞内の夾雑環境を模倣することで液滴が形成されやすくなります。
本キットにはクラウディング剤、緩衝液、塩が含まれており、プロトコルに沿って実験することで、お手持ちのタンパク質の相分離形成条件を検討することができます。
*本キットはお手持ちのタンパク質の相分離液滴の形成条件を検討するキットです。そのため、標準タンパク質などは同梱されておりませんのでご注意下さい。
マニュアル
技術情報
LLPS 研究を すぐにはじめられるキット
一般的にLLPS 研究を始める際には、細胞を用いない系で標的タンパク質が液滴を形成するかの確認を行うことが多いです。
しかしながらこのステップも、タンパク質によって最適条件は異なり、pH や塩の種類、クラウディング剤の有無※など様々な検討事項や注意点
があり、またさらに取り揃える試薬も多いため、初めての検討時には多くの労力がかかります。
小社ではLLPS研究をこれからは始める方に最適な2種類のキットを準備しております。
※ クラウディング剤(分子夾雑物再現剤): 細胞内の混みあった環境を再現するために添加される、PEG やFicoll などの高分子。
-
▶ 液滴作成法・観察方法の確認
・マイクロピペットと顕微鏡だけで液滴の観察が可能
・計算例や操作詳細を記載した取扱説明書付き
・液滴形成のポジティブコントロールに最適
-
▶ 標的タンパク質液滴の最適条件の確認
-
・液滴作製条件の検討に必要な試薬のセット
・本キットでクラウディング剤、pH、塩の検討が可能
・pH の異なる緩衝液を混合し各種pH の緩衝液調整が可能
・緩衝液のpH 調整方法を記載した取扱説明書付き
-
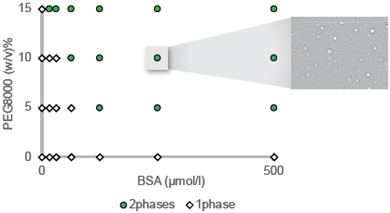
クラウディング剤PEG8000を用いたBSAの液滴形成濃度の検討
液滴形成におけるBSAの濃度およびクラウディング剤の濃度の検討を行いました。クラウディング剤はPEG8000を選択し、その他の条件は、150 mmol/l NaCl, 50 mmol/l HEPES buffer (pH 7.4)としました(いずれも終濃度)。プレートリーダーでの測定の結果、PEG8000の濃度依存的に600 nmの吸光度(濁度)が増加しました (図1)。また目視での顕微鏡観察で液滴の相図作製を行った結果、15% PEG8000添加時にはすべてのBSA濃度で液滴の形成が認められました (図2)。
BSA検討濃度: 0, 15.6, 31.3, 62.5, 125, 250, 500 µmol/l
PEG8000検討濃度:0, 5, 10, 15%
*詳細な実験条件は取扱説明書の実験例1をご覧ください。
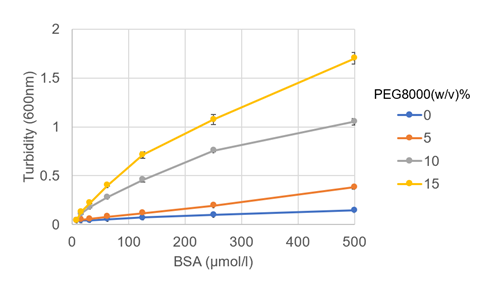
図 1. BSA・PEG8000濃度に対する濁度変化
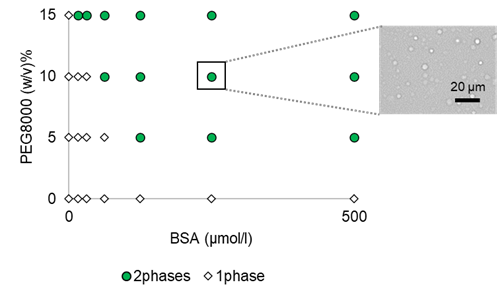
図 2. BSA/PEG系液滴の相図および相分離液滴の顕微鏡観察画像
緩衝液の種類及びpHの影響の検討
BSAの液滴形成に最適な緩衝液の種類、pHを確認するため検討を行いました。BSAは100 µmol/l、クラウディング剤は15% PEG8000、塩は150 mmol/l NaClを用いました(いずれも終濃度)。緩衝液はMES、リン酸緩衝液、HEPES、Tris-HClを使用し、pH5.5 - 9.0の範囲で条件検討を行いました。プレートリーダーでの濁度測定(600 nm吸光度)及び目視での顕微鏡観察の結果、すべての条件で液滴の形成を認められましたが、pHが低いほど、より液滴を形成しました。
*詳細な実験条件は取扱説明書の実験例2をご覧ください。
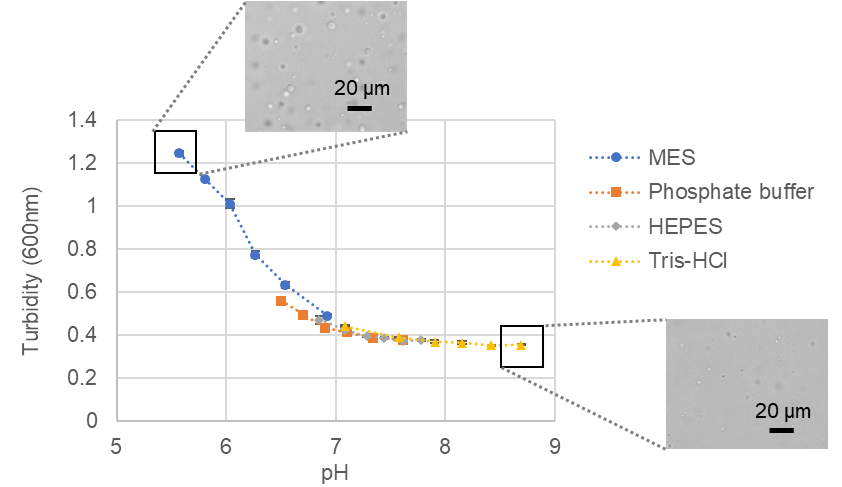
BSA系相分離液滴のpHに対する濁度変化と顕微鏡観察画像
液滴形成における塩の検討
BSAの液滴形成に塩の種類が与える影響について検討を行いました。BSAは100 µmol/l、クラウディング剤は15% PEG8000、緩衝液は20 mmol/l HEPES buffer (pH 7.4) に設定しました(いずれも終濃度)。塩は塩化ナトリウム、塩化カリウム、硫酸アンモニウムの3種類を使用しました。プレートリーダーでの濁度測定(600 nm吸光度)及び目視での顕微鏡観察の結果、BSA液滴はいずれも塩濃度が高いほど、液滴をよく形成していました。塩化ナトリウムを加えた系は濁度も高く、液滴の数も多い傾向を示しました。一方、500 mmol/l硫酸アンモニウムを加えた系は、濁度は低い値を示しましたが、目視では液滴をよく形成していました。形成された液滴が他の条件と比べて大きいため、濁度としては低い値となったと考えられます。
*詳細な実験条件は取扱説明書の実験例3をご覧ください。
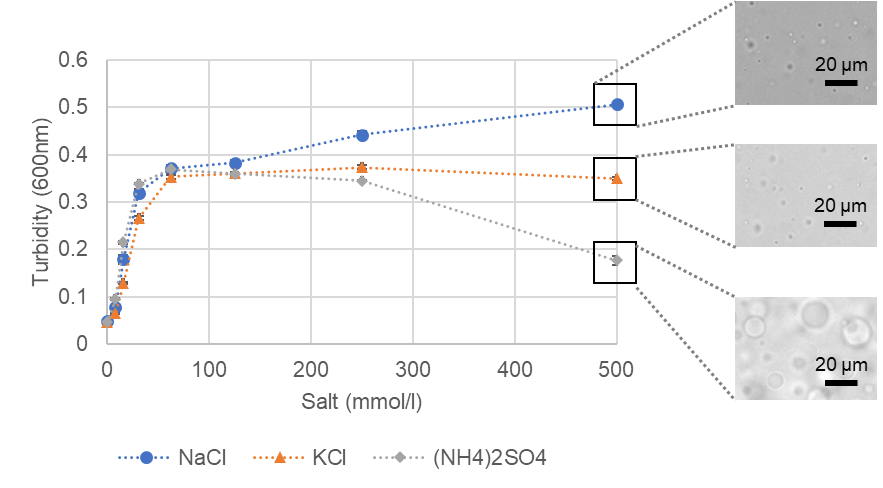
BSA系相分離液滴の塩濃度に対する濁度変化と顕微鏡観察画像
よくある質問
-
Q
1キットでどれくらいの検討が可能ですか?
-
A
検討される濃度設定によって異なりますが、PEGの濃度20%、緩衝液の濃度50 mmol/l、塩の濃度500 mmol/lの溶液を200 µl調製した場合、300回分作成できます。96 well plate を使用する場合、1キットで取扱説明書に掲載している実験例(クラウディング剤濃度とタンパク質濃度の検討、pHの検討、塩の検討)がすべて実施可能です。
-
Q
相分離の実験を行う上での注意点を教えてください。
-
A
以下の点に注意して実験を行ってください。
-
ピペッティングの回数が液滴形成に影響する場合がございます。操作毎のピペッティングの回数は統一してください。
-
温度により相分離液滴の数が増減する可能性がございます。室温に注意し、毎回一定の温度で実験されることを推奨致します。
-
溶液調製後、相分離液滴が形成されるまでの時間は実験条件によって異なります。10分~24時間程度を目安に検討してください。
-
サンプルの種類によっては、スライドガラスやプレートの底に液滴が馴染んで広がって(濡れて)しまい、球状の液滴が観察できない場合があります。濡れが生じる場合は、コーティングを施すことで球状の液滴を観察できる場合がありますのでご検討ください1) 2)。また、底面に触れていない液滴を観察しても問題ありません3)。
1) Ajay Singh Sawner et al., “Modulating α-Synuclein Liquid–Liquid Phase Separation”, Biochemistry, 2021, 60, 48, 3676–3696.
2) Tomohiro Nobeyama, Toya Yoshida, Kentaro Shiraki, “Interfacial and intrinsic molecular effects on the phase separation/transition of heteroprotein condensates”, J. BIOL. CHEM., 2024, 254 (3), 128095
3) Susanne Wegmann et al., “Tau protein liquid–liquid phase separation can initiate tau aggregation”, EMBO J., 2018, 37, e98049
-
-
Q
96 well plateとスライドガラス、どちらで検討した方がよいですか。また384 well plateは使用可能ですか。
-
A
検討したい条件やサンプルの数が多い場合は、溶液調製及び観察が簡便であるため96 well plate を推奨します。また、96 well plateではプレートリーダーを使用して濁度測定を行うことが可能です。
使用される標的タンパク質等の量が少なく、調製する液量を少なくしたい場合はスライドガラスで観察されることをおすすめします(数µl程度から観察が可能です)。なお、スライドガラスによる液滴の観察方法は、(LL01) LLPS Sarter Kit をご参照ください。
また、少ない液量で濁度測定を行いたい場合は、384 well plateを使用することも可能です。
-
Q
96 well plateはどのようなものが使用できますか?
-
A
クリアボトム、フラットボトムのプレートをご使用ください。顕微鏡観察を行う場合は、ガラスボトムやフィルムボトム等の顕微鏡観察向けのプレートを使用されることを推奨します。
-
Q
クラウディング剤などの別売りはありますか。
-
A
現在コンポーネント毎の販売予定はありません。ご要望がある場合は問い合わせフォームよりご連絡いただけますと幸いです。
-
Q
PEG400、PEG4000、PEG8000を保管する場合はラミジップに入れた方がよいですか。
-
A
PEG400は特に吸湿しやすいため、使用後は必ずキャップを閉め、シリカゲル同梱のアルミラミジップで保管してください。繰り返し開封する場合はあらかじめ小分けして保管してください。
PEG4000、PEG8000に関しても吸湿する性質があるため、アルミラミジップに入れて保管することを推奨します。
-
Q
PEG4000が容器内で固まっています。
-
A
PEG4000はまれに輸送時の温度上昇により融解し、固体となっている場合があります。固体となってもクラウディング剤としての性能には影響ありませんので、スパーテル等でかき取ってご使用ください。また、他のコンポーネントについても温度上昇による品質への影響はありませんので安心してご使用ください。
-
Q
顕微鏡観察とプレートリーダー測定の特徴を教えてください
-
A
顕微鏡観察では目視で液滴ができているかどうかの確認を行います。液滴の大きさや形状、液滴同士の融合の観察などによって、検討した条件で液滴ができているかどうかを確認することができます。
一方、液滴を含む溶液は光散乱が大きくなることから、プレートリーダーで濁度を測定することで、液滴ができているかどうか確認することができます。プレートリーダーによる測定は、複数のサンプルを一斉に測定することができ、数値化することにより液滴の形成度合いを客観的に評価することが可能です。ただし、濁度は液滴だけでなく凝集が生じた場合でも上昇し、サンプル自体の吸光度の影響を受けることを考慮する必要があります。
-
Q
プレートリーダーの濁度測定はどの波長で行えばいいですか。
-
A
試料による吸収の影響を避けるため、400~700 nm程度の波長で行われることが多いです。試料に特定の吸収波長がある場合はその領域を避けた波長を選択してください。
-
Q
溶液の濁度が高ければ相分離液滴ができていると考えていいですか。
-
A
濁度は相分離を起こした場合だけでなく、試料が凝集を起こした場合も上昇します。また、まれに相分離液滴が融合し、液滴のサイズが大きくなり、濁度が上がりにくくなることもあります。相分離が起きているかの確認には、顕微鏡での観察も推奨します。
-
Q
どのような条件を検討すればよいかわかりません。
-
A
取扱説明書の実験例をご参照ください。タンパク質が生体内で存在する環境や濃度、また相分離する条件が分かっている場合は、その条件を元に実験を計画することを推奨します。
単一のタンパク質で条件検討を行う場合、はじめにタンパク質濃度とクラウディング剤濃度の検討を推奨します。また、複数のタンパク質や核酸を使用する場合は、それぞれの因子の濃度やモル比を検討してください。
その後、[実験例2][実験例3]を参考に、pHや塩濃度の検討を行うことを推奨します。
取扱条件
| 保存条件: 冷蔵 , 取扱条件: 窒素置換,吸湿注意 |