はじめに
HilyMax (ハイリーマックス) は、新規に開発した陽イオン性合成脂質からなる遺伝子導入試薬です (特許第 4911416 号)。増殖培地中の血清の影響を殆ど受けないため、遺伝子導入時の面倒な培地交換をする必要がなく、多岐にわたる細胞種へ高効率に遺伝子導入することができます。
キット内容
| HilyMax Reagent | 1 tube |
| Lipoform Buffer | 1.0 ml x 1 |
保存条件
購入後は、0 ~ 5 ℃で保存してください。
Lipoform Bufferにてリポソーム溶液を調製後は、-20 ℃で保存してください。調製後6 ヶ月間安定です。
リポソーム溶液を頻繁に使用する際は、0 ~ 5 ℃保存も可能です。0 ~ 5 ℃で、1 ヶ月間安定です。
.png) |
凍結したHilyMaxを融解後は、必ずボルテックス又はピペッティングにより、良く混合してご使用下さい。 HilyMaxは、20回の凍結融解を繰り返しても、導入能に変化がないことを確認しております。また凍結融解の繰り返しを避けたい場合は、滅菌済みチューブへHilyMaxを小分けして、ご使用下さい。 |
リポソーム調製方法
Lipoform Buffer 1.0 ml を HilyMax Reagent の tube に添加し、ボルテックスにより30秒間撹拌し、HilyMax 溶液を調製する。
.png) |
撹拌後は、チューブ底部のフィルム状の固体が消失したことを確認して下さい。 不溶物が残存している場合は、再度完全に溶解するまでボルテックスにより撹拌を行って下さい。 |
HilyMax情報
弊社ホームページにて、HilyMaxに関する情報を提供しております。是非ご覧下さい。
URL:https://www.dojindo.co.jp/products/H357/
≪掲載内容≫
-
- 細胞毎の最適遺伝子導入条件 (18種)
- HilyMaxにより導入実績がある細胞種
-
- HilyMaxの使用例
- HilyMax 使用論文
操作方法
遺伝子導入操作手順 24 ウェルプレート使用時 a)
1. 細胞の準備
- 接着細胞
遺伝子導入時に細胞密度が 50-90%になるよう増殖培地 b) で調整した細胞懸濁液 0.5 ml をプレートへ播種し、一晩培養する。
- 浮遊細胞
1.0-10.0×105 cells/mlとなるよう増殖培地 b)で調整した細胞懸濁液 0.5 ml をプレートへ播種し、一晩培養する。
.png)
2. DNA-HilyMax 複合体の調製 c)
-
無血清培地 d) 30 μl を別途容器に用意する。 プラスミドDNA 0.5-1.5 μg e)を添加、ピペッティングにより混合する。
-
HilyMax 溶液を DNA(μg):HilyMax(μl) の比が 1:2-1:7になるように添加、ピペッティングにより混合する。 室温にて 15 分間静置する f) 。
.png)
- 3. 細胞への添加
インキュベーション後のDNA-HilyMax複合体を 1. で準備した培養細胞へ添加し、プレートを穏やかに振とうする。
- 4. 細胞の培養
CO2インキュベーターにて細胞を18 ~ 48 時間培養する g) 。
- 5. 遺伝子導入評価
レポーター遺伝子の発現活性を測定する。
a) 他のプレートを使用する際は『培養プレート毎条件』の項をご参照下さい。
b) 増殖培地中の血清は、遺伝子導入を妨害しません。
c) 遺伝子導入時の細胞密度により最適な DNA 量及び HilyMax 量が異なります。
d) 抗生物質を含まない無血清培地をご使用下さい。小社では DMEM、MEM、Opti-MEM での使用実績があります。
e) プラスミド DNA は、精製処理後 A260/A280 が 1.7 ~ 1.9 の間にあるものをご使用下さい。DNA 濃度は、0.15 ~ 1.00 mg/ml を推奨します。
f) 長時間インキュベーションすると導入効率が低下することがあります。
g) 細胞によっては、複合体添加 4 時間後に培地交換を行うことで、毒性の低下および導入効率が向上します。
遺伝子導入条件の検討方法
DNA, HilyMax 最適量の検討:24 ウェルプレート使用時
図 1 を参考に HilyMax による最適遺伝子導入条件をご検討下さい。
細胞密度 50% 及び 80% にて評価を行い、最適な細胞密度を確認することをお勧めします。
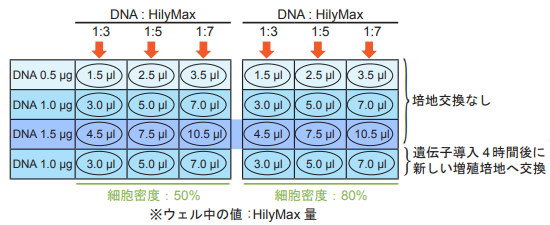  |
図 1 最適条件検討用プレートレイアウト
24 ウェルプレート以外をご使用の際は、図 1 の DNA 量および HilyMax 添加量に表 1 の換算倍率表の値を乗じた量をご使用下さい。
| 96 well plate:x 0.2 | 12 well plate:x 2 | 6 well plate (35 mm dish):x 4 |
| 60 mm dish:x 8 | 100 mm dish:x 24 |
培養プレート毎条件
本プロトコール中の操作方法は、24 ウェルプレート使用時の条件です。他のプレートを使用する際は、表 2 に従って導入実験を行って下さい。
| 細胞培養条件 | DNA-HilyMax 複合体調製条件 | ||||
| 培養容器 | 表面積 | 培養液量 | 培地量 (無血清) | DNA 量 | DNA(μg):HilyMax(μl) |
| 96-well | 0.3 cm2 | 0.1 ml | 10 μl | 0.1-0.3 μg | 1:2-1:7 |
| 24-well | 1.9 cm2 | 0.5 ml | 30 μl | 0.5-1.5 μg | 1:2-1:7 |
| 12-well | 3.8 cm2 | 1.0 ml | 60 μl | 1.0-3.0 μg | 1:2-1:7 |
| 6-well | 9.2 cm2 | 2.0 ml | 120 μl | 2.0-6.0 μg | 1:2-1:7 |
| 35-mm | 8.0 cm2 | 2.0 ml | 120 μl | 2.0-6.0 μg | 1:2-1:7 |
| 60-mm | 21.0 cm2 | 5.0 ml | 300 μl | 5.0-15.0 μg | 1:2-1:7 |
| 100-mm | 58.0 cm2 | 15.0 ml | 900 μl | 15.0-45.0 μg | 1:2-1:7 |
FAQ
プラスミド DNA の導入率が低い時は、以下の事項をご確認下さい。
- HilyMax Reagent は、完全に溶解していますか?
⇒ HilyMax の tube 底部の半透明固体が消失しているか確認して下さい。
- 複合体調製時に、30 分以上インキュベーションをしていませんか?
⇒ 30 分以上インキュベーションすると極端に導入活性が低下する可能性があります。
- 最適な DNA 量、HilyMax 量で遺伝子導入を行いましたか?
⇒ 極端に導入効率が低い場合は、DNA(μg):HilyMax(μl)=1:5 ~ 1:9 の範囲で遺伝子導入を行って下さい。細胞毒性が強い場合は、HilyMax 量を減らして下さい。
- 遺伝子導入時の細胞密度が導入条件に合っていますか?
⇒ 使用する DNA 量、HilyMax 量により最適な細胞密度が異なります。『遺伝子導入条件の検討方法』の項を参考に最適条件をご検討下さい。
よくある質問/参考文献
H357: HilyMax
Revised Nov., 29, 2023


 を押して省略できます。
を押して省略できます。