
|
楠本 賢一 (Ken-ichi Kusumoto) 福岡県工業技術センター 生物食品研究所 |

|
楠本 賢一 (Ken-ichi Kusumoto) 福岡県工業技術センター 生物食品研究所 |
[Abstract]
Modifying the gene transfer process by using artificially constructed compounds is fundamental for research in the field of genomics, cell biology, tissue engineering, and gene therapy. However, few reports have focused on the structural characteristics using a library of artificially synthesized amphiphiles for gene transfer in mammalian cells. In this study, we have demonstrated that film-like self-assembly of amphiphilic compound TMA-C2-DEA-C14 prepared by incubating at room temperature results in more than a 15-fold enhancement in the transfection efficiency with regard to mouse neural stem cells as compared to that of dispersion state by ultrasonication. Electron microscopic analysis revealed that the film-like microstructures were dramatically altered to liposome-like structures, including a number of transport vesicles, on association with nucleic acids. Moreover, we have demonstrated that TMA-C2-Glu-C12 has the potential to efficiently transfer siRNA, which has recently emerged as a powerful tool for gene silencing in the field of RNA interference, into mammalian cells. Our findings may improve the development of the liposome/lipid-mediated gene transfer process and the research regarding the novel biological functions with artificial materials.
キーワード:デリバリーシステム、人工脂質分子ライブラリー、マウス神経幹細胞、DNA、siRNA
核酸(DNA/RNA)は、すべての生物において遺伝情報を担う生体物質である。そのため、哺乳類細胞を標的にした核酸デリバリーシステムは、ゲノム解析、細胞生物学、再生医療学、臨床医療分野まで必要とされている技術である。DNA/RNAを単独で細胞内に輸送することは困難であることから、カチオン性脂質などを利用したリポソーム法1,2)、ウイルスベクター法3)、ポリペプチドのようなポリマーを用いた導入法4)、特殊な装置を用いたマイクロインジェクション法5)、エレクトロポレーション法6,7)、遺伝子銃(パーティクルガン)法8)など、種々のデリバリーシステムが考案されている。各方法には長所と短所がある。我々が研究対 象としているリポソーム法は、インビトロジェン社のLipofectamine2000をはじめ多くの研究用試薬が開発されていることからも分かるように、簡単なプロトコールに沿って核酸を細胞内に導入できる最も利用されている手法である。リポソーム法からなる核酸デリバリーシステムでは、実質的に、脂質分子はDNAやRNAを分解酵素や免疫応答から保護する脂質外皮となり、細胞膜を通過させる役割が知られている。本稿では、人工脂質分子の化学構造とそれらが発揮する細胞内輸送機能にフォーカスを向けて、これまでの研究を紹介したい。将来、人工脂質分子ライブラリーが生み出す輸送機能に関する分子情報の蓄積が、バイオ機能を担う分子材料についてボトムアップからの構造設計を可能とし、優れた機能と安全性を兼ね備えたデリバリーシステムの発展に繋がるものと期待される(概念図)。
リポソーム法においては、まず脂質分子の持つ正電荷をDNAの持つ負電荷と静電的相互作用を利用して複合体形成させることにより、細胞膜を通過させ核内にDNA輸送を高めるという戦略である。リポソーム法は幅広く利用されHEK293細胞やHeLa細胞などの培養細胞では、ほぼ100%に近い導入効率により遺伝子発現を可能にしている一方で、生体組織由来の初代細胞などに対しての遺伝子発現効率は、アデノウイルスベクターと比較して決して高くない。今回、我々が保有する人工脂質分子について、DNA導入が困難とされている中枢神経系細胞に注目して、マウス胎児脳組織由来の正常神経幹細胞に対するDNA輸送能力を評価した。
KunitakeT.らは、人工脂質分子の構造と集合形態の相関について詳細に検討を行い、人為的にH2O中で安定なリポソームを形成させることに成功している9-11)。我々は、これまでに合成・構築してきた人工脂質分子ライブラリーの中から、医療用タンパク質の生産を担う有用な細胞株であるCHO細胞に対してDNAを効率よく細胞内に導入・発現することのできるカチオン性脂質分子ditetradecyl-acetyldiethanolamine-trimethylammonium(TMA-C2-DEA-C14)を報告した12)。TMA-C2-DEA-C14の化学構造は、ジエタノールアミン(DEA)をコネクターとして、ヘッド領域に正電荷のトリメチルアミン(TMA)とカーボン数2を持つ炭化水素鎖(C2)、テイル領域にカーボン数14を持つ2つの炭化水素鎖(C14)を有する(Fig.1)。
脂質分子を利用して遺伝子を細胞内に運ぶための手法では、DNAとの複合体形成前に、まず、どのような溶液にどのような方法で脂質分子を分散・溶解させるのか?ということを考えなければならない。脂質分子/DNA複合体は最終的に細胞と相互作用させるため、用いる溶媒は細胞毒性を示し難いもの、例えば、H2O、メタノール、エタノール、DMSOなどが好まれる。今回、我々は、H2Oを選択し、一般的に使用されている超音波処理によりカチオ
ン性脂質TMA-C2-DEA-C14の分散を試みた。TMA-C2-DEA-C14はH2O中で1分間の超音波処理により完全に分散され透明の溶液になった(Fig.2)。さらに、TMA-C2-DEA-C14の相転移温度が約34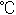 であり、相転移温度以下で調製された脂質分子水溶液が発揮するバイオ機能を評価するために、TMA-C2-DEA-C14をH2O中で1ヶ月間、室温(25
であり、相転移温度以下で調製された脂質分子水溶液が発揮するバイオ機能を評価するために、TMA-C2-DEA-C14をH2O中で1ヶ月間、室温(25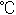 )にてインキュベーションし白濁溶液を得た(Fig.2)。
)にてインキュベーションし白濁溶液を得た(Fig.2)。
神経幹細胞は胚期や成人期の中枢神経系に存在し、未成熟で運命付けられていない自己再生型の組織性幹細胞である13,14)。神経幹細胞が神経疾患への細胞治療/再生治療や脳組織発生における機能解明のために不可欠とされるため、神経幹細胞への核酸デリバリーシステムの確立は重要である。我々は、BarnesD.W.らが提唱する神経幹細胞の無血清培養法15)に則って、マウス胎生14日目の脳組織から神経幹細胞の樹立を試みた。神経幹細胞のための増殖因子として知られているEGFとFGF2存在下で培養・増殖した細胞集団は、神経幹細胞マーカーであるNestinを発現しており(Fig.3)、さらに、樹立されたマウス正常神経幹細胞は、増殖因子を除いた培養液にて神経分化因子の刺激により神経細胞(β-Tub. -positive)ならびにグリア細胞(GFAP-positive)への分化能を有していた。
-positive)ならびにグリア細胞(GFAP-positive)への分化能を有していた。
人工脂質分子による神経幹細胞へのDNA導入能力を評価するために、cytomegalovirus由来のプロモーター+エンハンサー(CMV-IE)制御下に蛍光タンパク質(GFP)を連結したプラスミドDNA(pCMV-IE-GFP)を作製し、TMA-C2-DEA-C14溶液とpCMV-IE-GFPの複合体を形成させ、poly-L-lysineでコートしたplateにて前培養した神経幹細胞に対して複合体を作用させ、GFP発現した細胞を蛍光顕微鏡下で測定し、DNA導入効率として評価した。超音波処理で調製したTMA-C2-DEA-C14溶液を用いたDNA導入効率は2.3%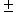 2.0%であり(Fig.4)、水溶液中で十分に分散させたTMA-C2-DEA-C14から生み出された脂質/DNA複合体では、低いDNA輸送能力であった。一方、室温にてインキュベーションを行い調製したTMA-C2-DEA-C14白濁溶液によるDNA導入効率は34.0%
2.0%であり(Fig.4)、水溶液中で十分に分散させたTMA-C2-DEA-C14から生み出された脂質/DNA複合体では、低いDNA輸送能力であった。一方、室温にてインキュベーションを行い調製したTMA-C2-DEA-C14白濁溶液によるDNA導入効率は34.0%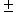 2.4%であり、超音波処理により水溶液中に分散させたものと比較して、およそ15倍の導入能力を示した(Fig.4)。興味深いことに、白濁溶液中にみられるような人工脂質分子TMA-C2-DEA-C14を自己集合体としてマクロ形成させることにより、マウス正常神経幹細胞へのDNA輸送能力を大きく伸ばすことができた。人工脂質分子が発揮するバイオ機能を抽出する際に、脂質分子を組織化させることも新たな機能を生み出すために必要な要素なのかもしれない。
2.4%であり、超音波処理により水溶液中に分散させたものと比較して、およそ15倍の導入能力を示した(Fig.4)。興味深いことに、白濁溶液中にみられるような人工脂質分子TMA-C2-DEA-C14を自己集合体としてマクロ形成させることにより、マウス正常神経幹細胞へのDNA輸送能力を大きく伸ばすことができた。人工脂質分子が発揮するバイオ機能を抽出する際に、脂質分子を組織化させることも新たな機能を生み出すために必要な要素なのかもしれない。
TMA-C2-DEA-C14は、室温にて自己集合化(白濁溶液状)させることで、超音波処理により分散化させたものと比較して、神経幹細胞への高いDNA導入能力を発揮できるようになった。我々は、この白濁溶液を成しているTMA-C2-DEA-C14自己集合体がどのような脂質形状なのか?また、DNAと結合する際にどのよう な複合体形状であるのか?光学顕微鏡ならびに透過型電子顕微鏡のもとで観察した。はじめに、最終的な電子顕微鏡観察で注意しなければならないことは、サンプル作製時の染色処理による標的構造物の形状が崩れることである。本来のTMA-C2-DEA-C14自己集合体の形状を電子顕微鏡下で観察するために、まず光学顕微鏡を用いて無処理のTMA-C2-DEA-C14自己集合体を観察した。TMA-C2-DEA-C14白濁溶液をスライドグラスに滴下し1,000倍にて観察を行うと、その自己集合体はフラットなフィルム様の構造物であり、それら多くは丸いエッジを持った多角体形状であった(Fig.5A)。さらに、TMA-C2-DEA-C14自己集合体にDNAを相互作用させた場合には、フラットなフィルム様構造物は、丸みを帯びた構造に変化し、そこから突出した繊維状の構造物がいくつも観察された(Fig.5B)。一方、超音波処理により十分に分散させたTMA-C2-DEA-C14溶液では、フラットなフィルム様構造物は観察されず、また、DNAと相互作用させた際に生じた丸みを帯びた構造も観察されなかった(Fig.5C)。このように、光学顕微鏡下で観察されたTMA-C2-DEA-C14白濁溶液は、フラットなフィルム様構造物として特定の形状で組織化された自己集合体であり、超音波処理により分散化させたものとは全く異なる形状であった。このことから、TMA-C2-DEA-C14からなるフィルム様自己集合体がマウス神経幹細胞への高いDNA輸送能力を発揮しているものと考えられる。
光学顕微鏡下で観察されたTMA-C2-DEA-C14自己集合体の形状を更に詳細に観察するために、白濁溶液をカーボングリッドに滴下し電顕用染色処理を行わずに透過型電子顕微鏡を用いて観察した。電子顕微鏡下で観察されたフィルム様自己集合体は、0.5μm〜6.5μmの範囲で平均2.7μm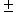 1.5μmの脂質分子から組織化された構造物であった(Fig.6A)。また、一般的に使用されているNegative染色処理を介した自己集合体の観察では、光学顕微鏡下でみられたフィルム様多角形状を壊す結果となり、今回の試験では無染色により全て観察した。次に、TMA-C2-DEA-C14自己集合体にDNAを相互作用させた場合には、脂質分子からなる幹のような繊維形状とそこから分岐した細い脂質繊維も観察され、それらが集まってリポソーム様の小胞を多く生み出していた(Fig.6B)。一方、超音波処理により分散したTMA-C2-DEA-C14とDNAの複合体の形態は、全く異なるものであり、リポソーム様小胞も僅かに観察されるだけであった(Fig.6C)。以上の結果から、TMA-C2-DEA-C14によるフィルム様自己集合体は、DNAと結合する際に多くのリポソーム様小胞を生み出し、神経幹細胞へのDNA輸送能力を格段に上昇させていると考えられる。TMA-C2-DEA-C14脂質分子は、一般的な超音波処理により分散させた分子形態を出発点としてDNA複合体を形成させるよりも、組織化したフィルム様の脂質構造体からDNA複合体を形成させることにより、多くのリポソーム様小胞を生み出し、結果としてマウス神経幹細胞へのDNA輸送能力を高めることができた。興味深いことに、人の手によって作られたTMA-C2-DEA-C14のフィルム様脂質構造物は、DNAとの相互作用によりその形状を劇的に変化させ、リポソーム様小胞を形成するというユニークな特徴を持っていた。
1.5μmの脂質分子から組織化された構造物であった(Fig.6A)。また、一般的に使用されているNegative染色処理を介した自己集合体の観察では、光学顕微鏡下でみられたフィルム様多角形状を壊す結果となり、今回の試験では無染色により全て観察した。次に、TMA-C2-DEA-C14自己集合体にDNAを相互作用させた場合には、脂質分子からなる幹のような繊維形状とそこから分岐した細い脂質繊維も観察され、それらが集まってリポソーム様の小胞を多く生み出していた(Fig.6B)。一方、超音波処理により分散したTMA-C2-DEA-C14とDNAの複合体の形態は、全く異なるものであり、リポソーム様小胞も僅かに観察されるだけであった(Fig.6C)。以上の結果から、TMA-C2-DEA-C14によるフィルム様自己集合体は、DNAと結合する際に多くのリポソーム様小胞を生み出し、神経幹細胞へのDNA輸送能力を格段に上昇させていると考えられる。TMA-C2-DEA-C14脂質分子は、一般的な超音波処理により分散させた分子形態を出発点としてDNA複合体を形成させるよりも、組織化したフィルム様の脂質構造体からDNA複合体を形成させることにより、多くのリポソーム様小胞を生み出し、結果としてマウス神経幹細胞へのDNA輸送能力を高めることができた。興味深いことに、人の手によって作られたTMA-C2-DEA-C14のフィルム様脂質構造物は、DNAとの相互作用によりその形状を劇的に変化させ、リポソーム様小胞を形成するというユニークな特徴を持っていた。
本稿で人工脂質分子TMA-C2-DEA-C14が発揮するバイオ機能;DNA輸送能力を紹介してきた。TMA-C2-DEA-C14は、室温中にてインキュベーションを行うことで、フィルム様の多角構造体として自己組織化され、DNAと相互作用する際には分散形態ではみられない多くのリポソーム様小胞を生み出すことができた。 では、TMA-C2-DEA-C14の化学構造とフィルム様自己集合体を介したDNA輸送機能にはどのような相関があるのだろうか?そこで、我々が保有する人工脂質分子ライブラリーの中から、TMA-C2-DEA-C14の類似化合物(Fig.1;炭化水素鎖の長さが異なる脂質分子TMA-C2-DEA-C12、TMA-C2-DEA-C16、TMA-C4-DEA-C14)を選抜し、TMA-C2-DEA-C14と同様な試験を行った。その結果、TMA-C2-DEA-C12、TMA-C2-DEA-C16、TMA-C4-DEA-C14によるDNA導入効率は、TMA-C2-DEA-C14と比較して非常に低いものであった(Fig.7)。TMA-C4-DEA-C14の炭化水素鎖の長さを変化させるだけで、DNA輸送能力は失われ、TMA-C4-DEA-C14の持つ炭化水素鎖のバランスは DNA輸送機能に大きな影響を与えた。TMA-C2-DEA-C14は、フィルム様自己集合体の形成、DNAとの相互作用で生み出されるリポソーム様小胞、神経幹細胞へのDNA輸送能というポテンシャルを発揮する化学構造を持った人工脂質分子である。
近年、開発されてきたリポソーム法は、汎用されているHEK293細胞やHeLa細胞などの培養細胞に対して高効率に遺伝子を導入・発現させることができる。しかしながら一方で、神経幹細胞のような生体組織に存在する正常細胞などに対しては、アデノウイルスベクターと比較して、その遺伝子発現効率は決して高くない16-18)。その理由として、 細胞膜の通過効率、
細胞膜の通過効率、 細胞核への移行効率、
細胞核への移行効率、 発現遺伝子の転写効率などウイルスベクターの持つ能力と比較して人工ベクターが劣っていることにあると考えられる。これは、人の手によって短期間で発展させてきた人工脂質ベクターと長い進化の過程で獲得してきたウイルスベクターの能力との大きな差であり、ウイルスが獲得してきた機能は洗練されているということである。本稿で述べたTMA-C2-DEA-C14自己集合体によるDNA導入技術についても、汎用されているリポソーム法と同様に、マウス正常神経幹細胞への導入効率は最大でも約40%であり、ウイルスベクターと比較すると決して高いDNA輸送能力ではない。今後、どのような技術により人工ベクターが発展していけるのか、我々は、人工脂質分子の化学構造が持つバイオ機能に関する情報を蓄積することにより、将来、神経幹細胞のような組織性幹細胞をはじめ導入が困難とされている細胞種(多くの分野で遺伝子導入が必要とされている細胞種)に対して高いDNA輸送能力を発揮する新しい脂質分子の発見やリポソーム法の発展への貢献を行っていきたいと考えており、ウイルスベクターで懸念されている腫瘍活性などの副作用19,20)を生じない優れた人工ベクターの創出に繋がれば幸いである。
発現遺伝子の転写効率などウイルスベクターの持つ能力と比較して人工ベクターが劣っていることにあると考えられる。これは、人の手によって短期間で発展させてきた人工脂質ベクターと長い進化の過程で獲得してきたウイルスベクターの能力との大きな差であり、ウイルスが獲得してきた機能は洗練されているということである。本稿で述べたTMA-C2-DEA-C14自己集合体によるDNA導入技術についても、汎用されているリポソーム法と同様に、マウス正常神経幹細胞への導入効率は最大でも約40%であり、ウイルスベクターと比較すると決して高いDNA輸送能力ではない。今後、どのような技術により人工ベクターが発展していけるのか、我々は、人工脂質分子の化学構造が持つバイオ機能に関する情報を蓄積することにより、将来、神経幹細胞のような組織性幹細胞をはじめ導入が困難とされている細胞種(多くの分野で遺伝子導入が必要とされている細胞種)に対して高いDNA輸送能力を発揮する新しい脂質分子の発見やリポソーム法の発展への貢献を行っていきたいと考えており、ウイルスベクターで懸念されている腫瘍活性などの副作用19,20)を生じない優れた人工ベクターの創出に繋がれば幸いである。
近年、遺伝情報を持たないジャンクRNAとされていたnon-coding RNA(ncRNA)の新しい機能が次々と明らかになりつつある。 Fire A.とMello C.C.らによるRNA干渉(RNAi)の発見は、二本鎖RNAをベースとする新たな遺伝子発現の制御メカニズムに関する研究の礎を成した21)。近い将来、RNAiが安全かつ有効に遺伝子発現を制御する手法となりつつあり、低分子化合物とタンパク質に続く第三の標的薬剤としてRNA分子に熱い視線が注がれている。ncRNAを細胞内で機能させるためには、DNAと同様にncRNAを単独で外部から細胞内に輸送することは難しいため、効率の良い細胞内輸送についての手段が必要になる。これまでに我々は、核酸デリバリーシステムのために人工脂質分子ライブラリーの構築を進めてきた。そこで本稿では、我々が保有する分子ライブラリーを用いてncRNA輸送を発揮する脂質分子の化学構造について紹介したい。
第1項で述べてきたように分子ライブラリーは、我々に「核酸の細胞内輸送」を行うために必要な構造的情報を与えてくれる。第2項では、我々が保有する人工脂質分子を用いて、ncRNAとして注目を集めているsmall interfering RNA(siRNA)を輸送するために必要な脂質分子の化学構造について紹介する。人工脂質分子ライブラリーは、glutamate(Glu)をコネクターとして、ヘッド領域にトリメチルアミン(TMA)、テイル領域に2つの炭化水素鎖(C)を有する化学構造からなり(Fig.8)、それぞれ炭化水素鎖のカーボン数が異なる脂質化合物からなる。
人工脂質分子によるsiRNAの輸送効率を簡便に評価するために、我々は蛍光タンパク質(EGFP)を恒常的に発現するCHO-EGFP細胞を作製した(Fig.9)。次いで、脂質分子の細胞内輸送効率はanti-EGFP siRNA duplex(Wako;target site,CGAAGCTGAAGTTCA)を用いて細胞内EGFPの発現低下を観察することにより評価した。人工脂質分子は超音波処理によりH2O中で分散・溶解させた。まず、didodecyl-acetylglutamate-から、siRNA輸送のための脂質分子の化学構造は、ヘッド領域の炭化水素鎖の長さがカーボン数2、テイル領域の炭化水素鎖のカーボン数12であり、コネクターとしてのGlu/Aspは重要な要素ではなかった。今後、分子ライブラリーにより示された構造的情報をもとに、細胞内ncRNA輸送のために優れた人工脂質分子ベクターの開発を行っていきたい。trimethylammonium(TMA-C2-Glu-C12)をベースに、ヘッド領域の炭化水素鎖のカーボン数を増加させた脂質分子(C2→C4→C6→C11)によるsiRNA導入効率を比較検討した。その結果、炭化水素鎖の長さが伸びるほどsiRNAによるEGFPの発現阻害効果が減少していた(Fig.10A)。次に、TMA-C2-Glu-C12のテイル領域にある2つの炭化水素鎖のカーボン数を14とした脂質分子TMA-C2-Glu-C14についてsiRNA導入試験を検討した場合では、TMA-C2-Glu-C12と比較して低いsiRNA導入効率であった(Fig.10B)。また、TMA-C2-Glu-C12の結果と同様に、TMA-C2-Glu-C14のヘッド領域の炭化水素鎖のカーボン数を増加させた場合(C2→C6)でも、siRNAの導入能は向上しなかった(Fig.10B)。このように、TMA-C2-Glu-C12の化学構造は、siRNAを細胞内に輸送するために適した炭化水素鎖の長さを持ち、炭化水素鎖の長さのバランスを変えるだけでsiRNA輸送能力に大きな影響を与えた。さらに、我々は、コネクター領域をグルタミン酸(Glu)からアスパラギン酸(Asp)に交換した脂質分子TMA-C2-Asp-C12の持つsiRNA導入能力についても評価した結果、TMA-C2-Glu-C12とほぼ同等の能力であった(Fig.10C)。以上の結果から、siRNA輸送のための脂質分子の化学構造は、ヘッド領域の炭化水素鎖の長さがカーボン数2、テイル領域の炭化水素鎖のカーボン数12であり、コネクターとしてのGlu/Aspは重要な要素ではなかった。今後、分子ライブラリーにより示された構造的情報をもとに、細胞内ncRNA輸送のために優れた人工脂質分子ベクターの開発を行っていきたい。
本稿で、我々が保有する人工脂質分子ライブラリーによるDNAとsiRNAの細胞内輸送というバイオ機能を脂質分子の化学構造にフォーカスを向けて紹介してきた。ユニークなフィルム様自己集合体やsiRNA輸送のための炭化水素鎖の長さのバランスなど、人工脂質分子が発揮するバイオ機能を明らかにしてきた。我々が人工脂質分子材料に興味を持つ理由は、「化学構造とバイオ機能」の相関からアプローチを行いながら、どのように設計すれば脂質分子に発揮させたいバイオ機能を付加できるようになるのか?大袈裟に言えば、如何にして分子の持つ記憶を見出しながら優れた分子材料を創り出すのか?という面白さである。今後、人工脂質分子が発揮するバイオ機能についての情報を蓄積することにより、脂質分子材料を用いたデリバリーシステムの発展に繋げていけるのではないだろうか。例えば、輸送したい分子を核酸だけでなく低分子化合物やタンパク質に対しても可能とする人工脂質分子を創り出すことも大いに興味深い。実際、我々が保有する約120種類の人工脂質分子の中には、医療分野でも注目を集めているIgG抗体を高効率に細胞内へ輸送可能な脂質分子も存在しており、細胞内にあるシグナルタンパク質などを生きた細胞の状態で染色することも可能であろう。このように、核酸をはじめ単独では導入し難い分子をボトムアップ技術により人為的に輸送することができれば大きな意義になるのではないだろうか。
また現在、優れた分子材料が創りだされている一方で、人為的に生み出されたナノ材料(我々が保有する人工脂質分子も含まれる)による人への安全性が問われている。本稿で紹介してきた人工脂質分子は、直接的に細胞を死滅させるような効果を有していないが、人工脂質分子材料の一部には、細胞に直接作用し細胞膜障害を介してアポトーシス/ネクローシス様の細胞死が誘導されることを確認している。ある特定の化学構造を持つ脂質分子を介して細胞死が誘導されるという情報は、今後、人工脂質分子材料の安全性を考える上で重要となるだろう。
以上、これまでの研究について、我々の保有する人工脂質分子が発揮するバイオ機能を紹介してきた。今後、人工脂質分子の研究開発には克服すべき課題も多く発展途上の段階ではあるが、将来のデリバリーシステムの確立のために、分子材料の開発をより安全にかつ高い能力を発揮させるための情報と議論が積み上げられ、優れた人工分子材料が開発されることを期待したい。
本研究では、神経幹細胞の樹立・培養方法について、The Mount Desert Island Biological LaboratoryのDavid W.Barnes教授からご教示していただいた。現在の「人工脂質分子ライブラリーの構築とバイオ機能」ならびに「 同仁化学研究所・遺伝子導入試薬“HilyMax”の開発」について、京都大学工学研究科の浜地格教授、
同仁化学研究所・遺伝子導入試薬“HilyMax”の開発」について、京都大学工学研究科の浜地格教授、 同仁化学研究所の方々からのご支援をいただいた。また、本研究を進めるにあたり、福岡県生物食品研究所の研究員(石川智之、山下聡子、赤尾哲之、水城英一)をはじめ多くの方々のサポートに深く感謝します。
同仁化学研究所の方々からのご支援をいただいた。また、本研究を進めるにあたり、福岡県生物食品研究所の研究員(石川智之、山下聡子、赤尾哲之、水城英一)をはじめ多くの方々のサポートに深く感謝します。
参考文献
1) Schaeffer-Ridder M., Wang Y., and Hofschneider P. H. Science (1982) 215: 166-168.
2) Felgner P. L., Gadek T. R., Holm M., Roman R., Chan H. W., Wenz M., Northrop J. P., Ringolds G., and Danielsen M. Proc. Natl. Acad. Sci. USA. (1987) 84: 7413-7417.
3) Cone R. D. and Mulligan R. C.Proc. Natl. Acad. Sci. USA. (1984) 81: 6349-6353.
4) Zenke M., Steinlein P., Wagner E., Cotton M., and Brinstiel M. L.Proc. Natl. Acad. Sci. USA. (1990) 87: 3655-3659.
5) Capecchi M. R. Cell (1980) 22: 479-488.
6) Neumann E., Schaefer-Ridder M., Wang Y., and Hofschneider P. H. EMBO J. (1982) 1: 841-845.
7) Chu G., Hayakawa H., and Berg P.Nucleic Acids Res. (1987) 15: 1311-1326.
8) Johnston S. A. and Tang D. C. Genet Eng. (1993) 15: 225-236.
9) Kunitake T. and Okahata Y. J. Am. Chem. Soc. (1977) 99: 3860-3871.
10) Kunitake T., Nakanishi N., Shimonura M., Okahata Y., Kano K., and Ogawa T. J. Am. Chem. Soc. (1980) 102: 6642-6644.
11) Kunitake T. Ann. NY Acad.Sci. (1986) 471: 70-82.
12) Kusumoto K., Akao T., Mizuki E., and Nakamura O.Cytotechnology (2006) 51: 57-66.
13) Eriksson P. S., Perfilieva E., Bjork-Eriksson T., Alborn A. M., Nordborg C., Peterson D. A., and Gage F. H. Nature Med. (1998) 4: 1313-1317.
14) Noctor S. C., Flint A. C., Weissman T. A., Dammerman R. S., and Kriegstein A. R. Nature (2001) 409: 714-720.
15) Loo D. T., Fuquay J. I., Rawson C. L., and Barnes D. W.Science (1987) 236: 200-202.
16) Ma H., Zhu J., Maronski M., Kotzbauer P. T., Lee V. M., Dichter M.A., and Diamond S. L. Neuroscience (2002) 112: 1-5.
17) Kato K., Yoneda Y., Okada Y., Kiyama H., and Shiosaka S.Brain Res Mol Brain Res. (1994) 25: 359-363.
18) Lakkaraju A., Dubinsky J. M., Low W. C., and Rahman Y. E. J Biol Chem. (2001) 276: 32000-32007.
19) Marshall E. Science (1999) 286: 2244-2245.
20) Check E. Nature (2005) 433: 561.
21) Fire A., Xu S., Montgomery M. K., Kostas S. A., Driver S. E., and Mello C. C. Nature (1998) 391: 806-811.
| 氏名 | 楠本 賢一(Ken-ichi Kusumoto) |
| 年齢 | 36歳 |
| 所属 | 福岡県工業技術センター 生物食品研究所 生物資源課 研究員 |
| 連絡先 | 〒839-0861 福岡県久留米市合川町1465-5 TEL(0942)30-6644 FAX(0942)30-7244 E-mail: kkusumoto@fitc.pref.fukuoka.jp |
| 出身大学 | 九州大学大学院農学研究科 遺伝子資源工学専攻 細胞制御工学講座 |
| 学位 | 農学博士 |
| 現在の研究テーマ | ・人工脂質分子材料とバイオ機能 ・セラミックス材料と三次元細胞培養 ・脳神経細胞への抗ストレス因子 |