-SulfoBiotics- Protein Redox State Monitoring Kit Plus
生体硫黄解析用キット
-
製品コードSB12 -SulfoBiotics- Protein Redox State Monitoring Kit Plus
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 20 samples | ¥64,500 | 346-91743 |
| 20 samples | ・Protein-SHifter Plus ・Reaction Buffer A ・Reaction Buffer B ・lysis Buffer |
×20 ×4 ×4 ×4 |
|---|
性 質
タンパク質のチオール基修飾は、代表的な翻訳後修飾の一つであり、生体内のレドックス変化に応答して生じる。チオール基の翻訳後修飾によるタンパク質の機能制御を理解するためには、個々のチオール基の酸化還元状態を検出することが必要不可欠となる。
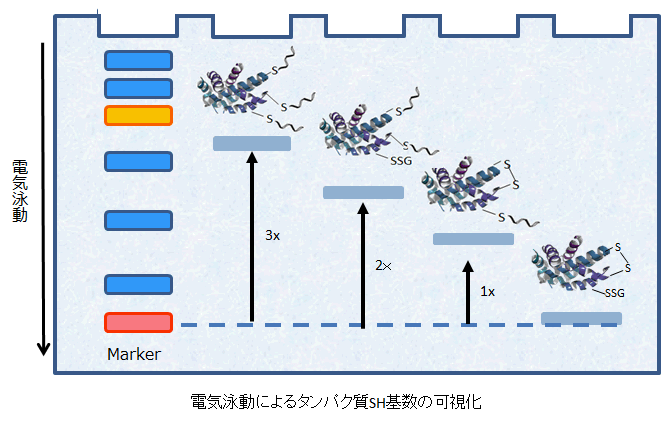
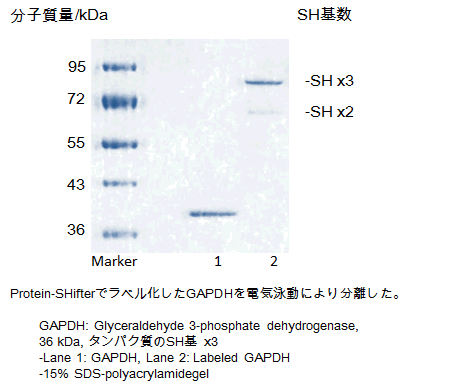
-SulfoBiotics- Protein Redox State Monitoring Kit Plusを用いて、タンパク質のチオール基の数を電気泳動法により可視化することが可能である。マレイミド基を有するProtein-SHifter Plusはタンパク質のチオール基と結合し、1分子のProtein-SHifter Plusが結合することでラベル化されたタンパク質は分子質量約15 kDa増加したバンドとして分離・検出される。更に、Protein-SHifter Plusは光分解機能を有するため、電気泳動後のゲルにUV光を照射することで、ラベル化されたタンパク質から切り離される。そのため、ラベル化する前と同様にウェスタンブロットに適用可能である。(*ラベル化の操作は動物細胞用に最適化されている。)
.gif)
.gif)
| 開発元 | Dojindo Molecular Technologies, Inc. |
|---|
技術情報
チオール数が異なるタンパク質の測定例
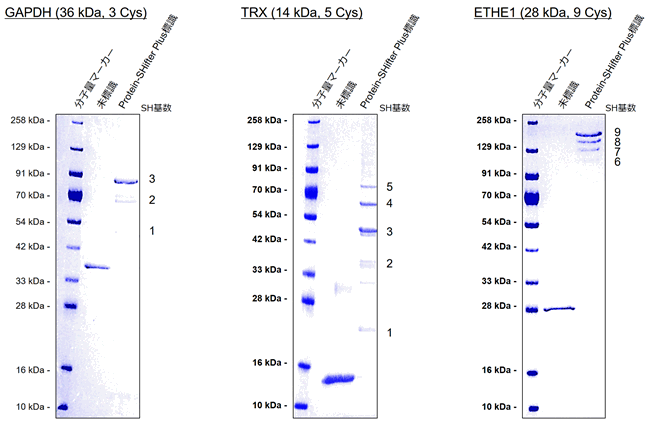
GAPDH(左:チオール数 3個)、TRX(中央:チオール数 5個)、ETHE1(右:チオール数 9個)
標識試薬:Protein-SHifter Plus (製品:Protein Redox State Monitoring Kit Plus, Code: SB12)
染色試薬:CBB
ラベル化されたタンパク質の電気泳動のバンドが、チオール数に応じてより高分子側にシフトすることが確認された。
タンパク質中に10個以上のチオールが存在する場合、電気泳動のバンドが複雑になり解析が困難になる可能性があるため、タンパク質中のチオール数として1~9個を目安に使用いただきたい。
参考文献
1) S. Hara, T. Nojima, K. Seio, M. Yoshida and T. Hisabori, "DNA-maleimide: An improved maleimide compound for electrophoresis-based titration of reactive thiols in a specific protein" Biochim. Biophys. Acta, 2013, 1830(4), 3077.
2) S. Hara, Y. Tatenaka, Y. Ohuchi and T. Hisabori, "Direct determination of the redox status of cysteine residues in proteins in vivo", Biochem. Biophys. Res. Commun., 2015, 456, (1), 339. ![]()
3) Y. J. Suzuki, L. Marcocci, T. Shimomura, Y. Tatenaka, Y. Ohuchi and T. I. Brelidze, 'Protein Redox State Monitoring Studies of Thiol Reactivity', antioxidant., 2019, 8, (5), 143.
よくある質問
-
Q
1サンプル当たりの細胞数が5-10×105 cellsを超える場合、どのような問題がありますか?
-
A
十分にラベル化できない可能性がございます。
また、細胞のペレットをLysis Bufferで溶解後、DNAの影響で溶液がゲル状になることがあります。推奨範囲を超える場合は、Lysis Bufferで適切な濃度まで希釈してください。
-
Q
Protein-SHifter Plusは光に不安定だと思いますが、ラベル化、電気泳動は遮光して行う必要がありますか?
-
A
アルミラミジップから取り出したProtein-SHifter Plusは、蛍光灯下で数時間安定です。
遮光をする必要はありませんが、ラベル化、電気泳動中は直射日光等の強い光は避けてください。
未使用分はアルミラミジップに戻して、口をしっかり閉じてから冷蔵保存してください。
-
Q
ラベル化したサンプルは保存できますか?
-
A
精製タンパク質Glyceraldehyde 3-phosphate dehydrogenaseをラベル化したサンプルは、
一晩冷凍保管し、結果に影響が出ないことを確認しております。サンプルによって安定性は変わる可能性がございます。
-
Q
ラベル化反応を妨害する物質はありますか?
-
A
アスコルビン酸等の還元剤は、タンパク質の還元状態に影響を与えるため使用できません。
また、チオールを有する化合物はラベル化反応を妨害します。
-
Q
検出可能なタンパク質中のチオール数の目安はありますか。
-
A
小社にて、チオール数が9個のタンパク質(ETHE1: ethylmalonic encephalopathy)に適用した実績があります(写真右)。その他、GAPDH(チオール数3個: 写真左)、およびTRX(チオール数5個: 写真中)の測定例は以下の通りです。タンパク質中に10個以上のチオールが存在する場合、電気泳動のバンドが複雑になることで解析が困難になる可能性があるため、タンパク質中のチオール数として1~9個の範囲を目安に使用することをお勧めします。
標識試薬:Protein-SHifter Plus (製品:Protein Redox State Monitoring Kit Plus, Code: SB12)
染色試薬:CBB
-
Q
検出実績のあるサンプルを教えてください。
-
A
シロイヌナズナ由来のThioredoxin(14k)、ヒト由来のThioredoxin(14k)、大腸菌由来のThioredoxin(14k)、
Glyceraldehyde 3-phosphate dehydrogenase (36k)の精製タンパク質の検出実績がございます。またHeLa、HL60、K562細胞のライセート中のThioredoxin及びGlyceraldehyde 3-phosphate dehydrogenaseの検出実績もございます。
-
Q
光切断に使用可能な機器情報を教えてください。
-
A
弊社で光切断実績のある機器は下記の2種類です。
実際の光切断は画像を参考ください。トランスイルミネーター (メーカー:UVP、型番:NTM-15、切断条件:302 nm 15 Wで10分)
ハンディUVランプ (メーカー:アズワン、型番:SLUV-4、切断条件:365 nm 4 Wで30分)また、254 nmの光照射(ハンディUVランプまたはクリーンベンチの殺菌灯など)では、十分な光切断ができません。
例)光切断時のゲルの置き方
※ゲルが作業中に乾燥しないようガラス板に挟んだ状態で光切断を行ってください。
※光源と直接接触させて切断操作を行ってください。

UVトランスイルミネーター ハンディUVランプ
-
Q
使用するサンプルの適切なタンパク質濃度、チオール濃度を教えてください。
-
A
pH7の緩衝液(100 mmol/L HEPES)中に1%濃度で溶解後、4 ℃で保存した場合、2ヶ月間は安定であることを確認しております。
1) N. Hasegawa, H. Jonotsuka, K. Miki and K. Takeda, "X-ray structure analysis of bacteriorhodopsin at 1.3 A resolution", Scientific Reports., 2018, 8, 13123, DOI:10.1038/s41598-018-31370-0. (膜タンパク質: purple membraneの結晶化, trehalose C16).100 mg/10 mL(水)
タンパク質濃度として0.1~1 mg/mL、チオール濃度として100 μmol/mL以下に合わせてください。
○DTNB(製品コード:D029)を用いたチオール濃度の定量例(96 wellプレート用)は以下をご参考ください。
1. 試薬および溶液調製
・反応用バッファー(100 mmol/L sodium phosphate, pH 8.0, 1 mmol/L EDTA)・400 μmol/L DTNB溶液
DTNB [5,5'-Dithiobis(2-nitrobenzoic acid), Code: D029] 4 mgを秤量し、反応用バッファー 1 mLで溶解する。(10 mmol/L)
上記溶液を反応用バッファーで25倍希釈する。(400 μmol/L)
※測定に必要なwell数×0.1 mLを調製する。下記の場合は9 wellであるため、約1 mLを調製する。・ L-Cysteine標準液
L-Cysteine 2.42 mgを反応用バッファー 5 mLで溶解し、4 mmol/L L-Cysteine溶液とする。
この溶液100 μLを反応用バッファー 900 μLで希釈し、400 μmol/L L-Cysteine溶液とする。この溶液を順次2倍希釈して、 L-Cysteine標準液 (200, 100, 50, 25, 12.5, 0 μmol/L)とする。・測定試料
サンプル(細胞溶解液やタンパク質溶液など)を反応用バッファーで希釈したものを数種類準備する。
(N=3で測定するため、350 μL以上調製する。)2. 操作
1) 測定試料および L-Cysteine標準液を96 wellマイクロプレートの各ウェルに100 μLずつ添加する(図1)。
2) 400 μmol/L DTNB溶液100 μLを添加し、ピペッティングにより混合する。
3) 室温で15分間静置した後、マイクロプレートリーダーで412 nmにおける吸光度を測定する。
4) L-Cysteineの検量線から測定試料中のチオール濃度を算出する(図2)。
※サンプル希釈倍率からサンプル中のチオール濃度を計算する。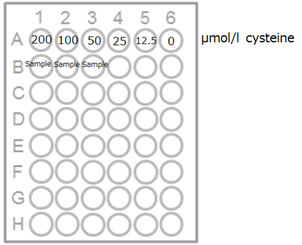
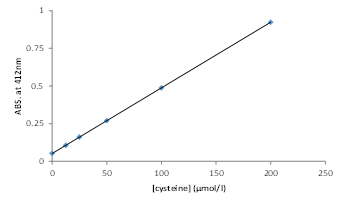
図1.プレート配置例 図2.L-Cysteineの検量線例
取扱条件
| 保存条件: 冷蔵 , 取扱条件: 吸湿注意 | |
|
危険・有害 シンボルマーク |
 
|
|---|---|