はじめに
液‐液相分離 (liquid-liquid phase separation : LLPS) とは、組成の異なる二つの液体が互いに混ざり合わず、二相に分離する現象です。物理化学分野では古くから知られていたこの現象が、生体内でも起きていることが明らかとなり、新たな細胞機能制御として重要視されています。ほぼすべての細胞内現象で LLPS が関与しているとも言われており、神経変性疾患に関わる研究も盛んに行われています。例えば、細胞内でのタンパク質凝集が病因となる疾患 (ミスフォールディング病) のうち、パーキンソン病や前頭側頭葉変性症、アルツハイマー病、筋萎縮性側索硬化症においては、それらの原因タンパク質である α-シヌクレイン、FUS、タウ、TDP-43 が相分離液滴を形成することにより、アミロイドの形成が促進されることも報告されています 1)。LLPS は生体現象を解明するための新たな糸口であり、神経変性疾患と LLPS の関与を明らかにすることで病態の理解、新規治療法の開発に繋がることが期待されています。
本キットは、タンパク質間の疎水性相互作用に応答する色素(ANS、SepaFluor)とアミロイド結合性の蛍光染色色素(Thioflavin T、Congo Red) の4種類をセットにしています。さらに、SepaFluorは疎水性相互作用だけでなく、相分離液滴がゲル化したものも観察可能です。これらの色素を用いることで、相分離液滴の性質の理解につながります。
- 本キットは、細胞内の相分離液滴には適用できません。細胞外における実験でご使用ください。
- 本キットには、標準タンパク質、クラウディング剤、緩衝液等は同梱されておりませんのでご注意下さい。
| コンポーネント | 性質 |
| ANS (8-anilino-1-naphthalenesulfonic acid) | 疎水場で青色蛍光を発する色素 |
| SepaFluor |
疎水場で紫色蛍光を発する色素 |
| Thioflavin T | アミロイド結合性の緑色蛍光を発する色素 |
| Congo Red | アミロイド結合性の赤色蛍光を発する色素 |
キット内容
|
ANS |
50 µl x 1 |
| SepaFluor | 10 nmol x 1 |
| Thioflavin T (10 mmol/l DMSO solution) |
50 µl x 1 |
| Congo Red (10 mmol/l DMSO solution) |
50 µl x 1 |
保存条件
遮光、-20℃にて保存してください。
必要なもの (キット以外)
- 目的のタンパク質など
- クラウディング剤、緩衝液など
- Dimethylsulfoxide (DMSO)
- 電子天秤
- マイクロピペット
- マイクロチューブ
- コニカルチューブ
- ボルテックスミキサー
- 蛍光顕微鏡
- スライドガラス
- カバーガラス
- 両面テープ
- 蛍光測定用マイクロプレート
- 使用実績のあるマイクロプレートについては FAQ をご参照ください。
溶液調製
0.1 mmol/l SepaFluo DMSO solutionの調製
10 nmol SepaFluorを含むチューブに 100 μl の DMSO を加え、ボルテックスミキサーにより溶解する。
- 調製後は遮光し、-20 ℃で保存して下さい(6ヶ月間安定)。
- ANS、Thioflavin T、Congo RedはDMSO溶液ですので本操作は必要なく、そのままご使用いただけます。
操作
最終濃度が1000倍希釈となるように色素のDMSO溶液を相分離溶液に添加して下さい。
相分離液滴を作製し、観察する方法はいくつかありますが、ここでは96穴マイクロプレートを用いる方法とスライドガラスを用いる方法を紹介します。
96穴マイクロプレートを用いる場合
96穴マイクロプレートを用いる場合の詳細な手順は実験例1、2をご覧ください。
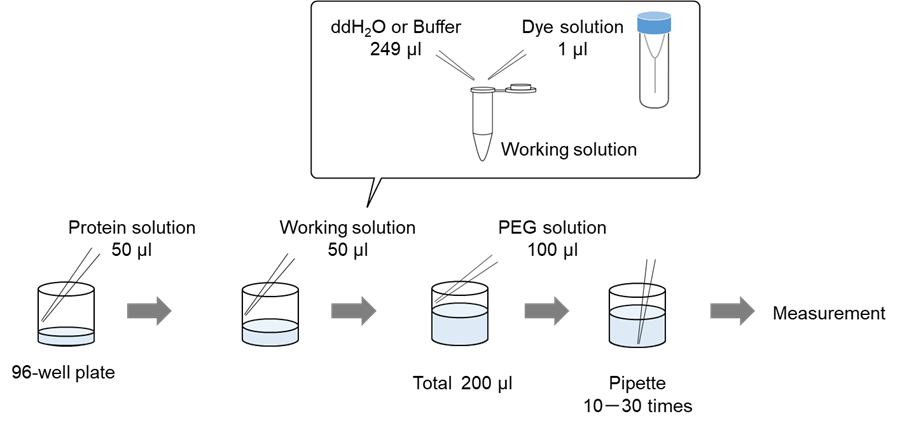
溶液調製例

スライドガラスを用いる場合
スライドガラスで観察する場合の詳細な手順は、実験例3をご覧ください。
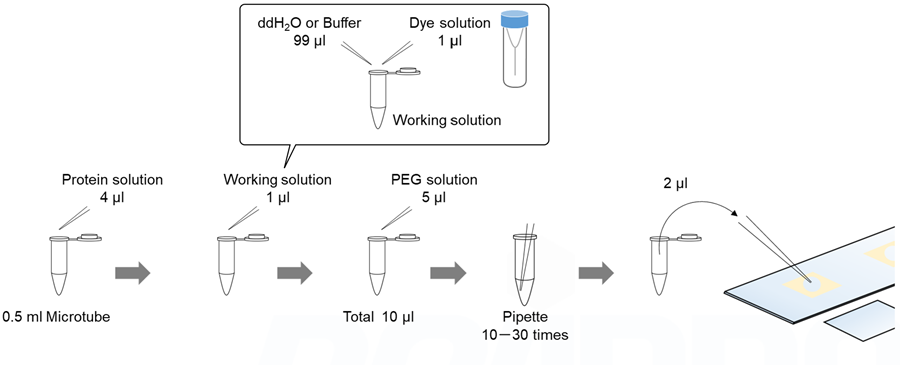
溶液調製例

使用上の注意
- 本取扱説明書に記載の実験は、染色時間を1時間で統一しています。染色時間は相分離液滴の種類によって異なりますが、条件を比較するときは、毎回染色時間を統一しててください。長時間に渡る染色についてはFAQをご参照ください。
- Working solutionの調製には超純水やBufferをご使用下さい。本取扱説明書に記載の実験では、超純水にて色素のDMSO溶液を希釈しております。
- ピペッティングの回数が液滴形成に影響する場合がございます。操作毎のピペッティングの回数は統一してください。
- 温度により相分離液滴の数が増減する可能性がございます。室温に注意し、毎回一定の温度で実験されることを推奨致します。
- サンプルの種類によっては、スライドガラスやプレートの底に液滴が馴染んで広がって(濡れて)しまい、球状の液滴が観察できない場合があります。濡れが生じた場合は、コーティングを施すことで球状の液滴を観察できる場合がありますのでご検討ください。また、底面に触れていない液滴を観察しても問題ありません。
実験例1
クラウディング剤PEG8000を用いたBSA(ウシ血清アルブミン) タンパク質の染色
BSAタンパク質とクラウディング剤PEG8000を用いて相分離液滴を作製し、ANSおよびSepaFluorにて染色した。
Working solutionの調製
ANSおよびSepaFluor DMSO溶液 1 µlを超純水99 µlで希釈し、Working solutionを調製した。
BSA solutionの調製
BSA(A2153-10MG:Sigma-Aldrich社)を超純水にて溶解し、1000 µmol/l BSA水溶液を調製した。
PEG8000 solutionの調製
PEG8000を超純水にて溶解し、30 w/v% PEG8000溶液を調製した。
- (LL02) LLPS Forming Condition Screening KitのPEG8000を使用。
BSAの相分離溶液の調製、染色、観察
1. 96穴黒色クリアボトムマイクロプレート (5882-096:AGC Techno Glass社) の各wellに500 mmol/l HEPES Buffer Solution (pH7.4)を 20 µlずつ添加した。
- (LL02) LLPS Forming Condition Screening Kitの500 mmol/l HEPES Buffer Solutionを使用。
2. 各wellに2 mol/l Sodium Chloride Solutionを 15 µlずつ添加した。
- (LL02) LLPS Forming Condition Screening Kitの2 mol/l Sodium Chloride Solutionを使用。
3. 各wellに超純水を 15 µlずつ添加した。
4. 各wellにANSおよびSepaFluor working solutionをそれぞれ20 µlずつ添加した。
5. 各wellに1000 μmol/l BSA solution 30 µlを添加した。
6. 各wellに30 % PEG8000 solution 100 µlを添加し、20回ピペッティングを行った。
- PEG8000 solutionは粘度が高いため、リバースピペッティングにてゆっくりと添加してください。
- 電動ピペットでは泡立ちやすいため、ピペッティングは手動ピペットで行ってください。
- PEG solution添加後、ピペッティングせずに長時間放置するとタンパク質が凝集する可能性があるため、添加後速やかにピペッティングしてください。

7. 遮光下、室温で静置し、1時間後に落射型蛍光顕微鏡で観察した。
 |
| 図 1 クラウディング剤PEG8000を用いたBSAタンパク質の染色 |
Filter sets
ANS:340–380 nm (Ex), 435–485 nm (Em)
SepaFluor:590–650 nm (Ex), 663–737 nm (Em)
実験例2
クラウディング剤PEG8000を用いたLactoferrinタンパク質の染色
主に静電相互作用で相分離液滴を形成することが知られているLactoferrinタンパク質を用いて実験を行った。PEG8000の濃度を高くすると、Lactoferrinの相分離液滴はゲル化する様子が確認され、その変化をSepaFluorで観察した。
Working solutionの調製
SepaFluor DMSO溶液 1 µlを超純水249 µlで希釈し、working solutionを調製した。
Lactoferrin solutionの調製
Lactoferrin(L4040-100MG:Sigma-Aldrich社)を80 mM HEPES (pH7.4)にて溶解し、80 µmol/l Lactoferrin水溶液を調製した。
PEG8000 solutionの調製
PEG8000をを超純水にて溶解し、10 w/v% および20 w/v% PEG8000溶液を調製した。
- (LL02) LLPS Forming Condition Screening KitのPEG8000を使用。
Lactoferrinの相分離溶液の調製、染色、観察
1. 96穴黒色クリアボトムマイクロプレート (5882-096:AGC Techno Glass社) の各wellにSepaFluor working solutionを 50 µlずつ添加した。
2. 各wellに80 μmol/l Lactoferrin solution 50 µlを添加した。
3. 10 %および 20 % PEG8000 solution 100 µlをそれぞれ添加し、20回ピペッティングを行った。
- PEG8000 solutionは粘度が高いため、リバースピペッティングにてゆっくりと添加してください。
- 電動ピペットでは泡立ちやすいため、ピペッティングは手動ピペットで行ってください。
- PEG solution添加後、ピペッティングせずに長時間放置するとタンパク質が凝集する可能性があるため、添加後速やかにピペッティングしてください。

4. 遮光下、室温で静置し、1時間後に落射型蛍光顕微鏡で観察した。
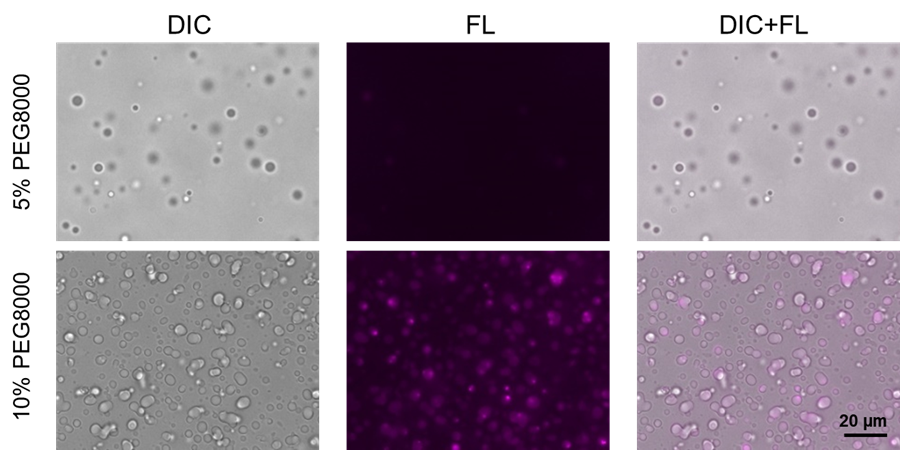 |
| 図 2 クラウディング剤PEG8000を用いたLactoferrinタンパク質の染色 |
Filter sets : 590–650 nm (Ex), 663–737 nm (Em)
実験例3
Heparinを用いたTauタンパク質の凝集体の染色
Tauタンパク質とHeparinを用いて作製したTauタンパク質の凝集体をThioflavin TおよびCongo Redにて染色した。
Working solutionの調製
Thioflavin TおよびCongo Red DMSO溶液 1 µlを超純水99 µlで希釈し、working solutionを調製した。
Heparin solutionの調製
Heparin(081-00136:富士フイルム和光純薬社)を超純水にて溶解し、40 w/v% Heparin溶液を調製した。
Buffer solutionの調製
0.5 mlマイクロチューブに500 mmol/l HEPES Buffer Solution (pH7.4)を 1.5 µl、 2 mol/l Sodium Chloride Solutionを 6.4 µl、超純水を9.2 µl加えて混合した。
- (LL02) LLPS Forming Condition Screening Kitの500 mmol/l HEPES Buffer Solution、2 mol/l Sodium Chloride Solutionを使用。
Tauの凝集体の調製、染色、観察
1. 各0.5 mlマイクロチューブにBuffer solutionを1.71 µlずつ添加した。
2. Thioflavin TおよびCongo Red working solutionを1 µl添加した。
3. 各wellにTau solution(SPR-479B:StressMarq Biosciences社)を 2.29 µlずつ添加した。
4. 各wellに40 % Heparin solution 5 µlを添加し、20回ピペッティングを行った。
- Heparin solutionは粘度が高いため、リバースピペッティングにてゆっくりと添加してください。
- 電動ピペットでは泡立ちやすいため、ピペッティングは手動ピペットで行ってください。
- Heparin solution添加後、ピペッティングせずに長時間放置するとタンパク質が凝集する可能性があるため、添加後速やかにピペッティングしてください。
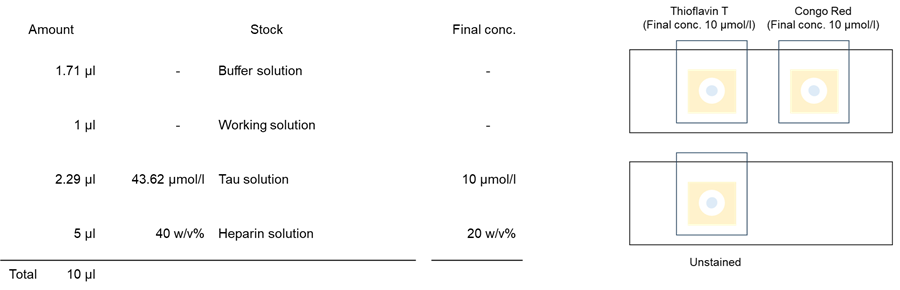
5. サンプル溶液を2 µlを穴の開いた両面テープの付いたスライドガラスに添加し、カバーガラスを被せ、遮光下、37℃で静置した。7日後に共焦点蛍光顕微鏡で観察した。
- スライドガラスやカバーガラス、両面テープは(LL01) LLPS Starter Kitと同一のものを使用。
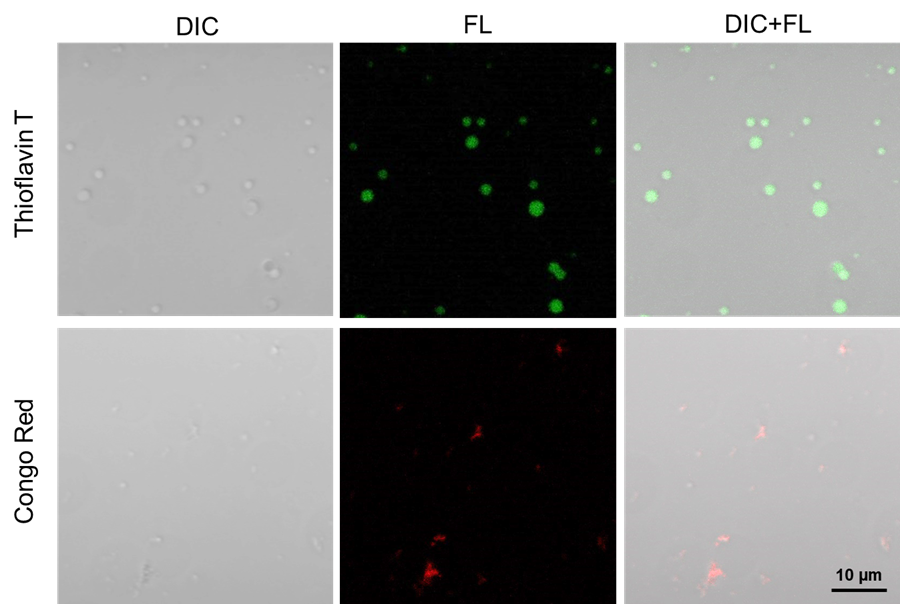 |
| 図 3 Heparinを用いたTauタンパク質の凝集体の染色 |
Filter sets
Thioflavin T:488 nm (Ex), 500–600 nm (Em)
Congo Red:561 nm (Ex), 570–700 nm (Em)
参考文献
- A. Zbinden et al., Dev Cell., 2020, 55, 45-68.
よくある質問/参考文献
LL03: LLPS Characterization-dye Set
Revised Nov., 12, 2024


 を押して省略できます。
を押して省略できます。

