Biofilm Formation Assay Kit

バイオフィルム形成量・形成阻害測定キット
- バイオフィルム形成量および薬剤のバイオフィルム形成阻害を測定できる
- 測定の手間を大幅に低減
- バラツキを抑えることが可能
-
製品コードB601 Biofilm Formation Assay Kit
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 96 tests | ¥18,600 | 340-09573 |
・独自開発の蓋(TestPiece Holder)で、任意の素材をを簡便に測定できます
| 96 tests | ・Crystal Violet Solution ・96-peg lid ・96-well Plate |
22 ml ×1 ×1 ×10 |
|---|
|
令和2年度 九州・沖縄 産業技術オープンイノベーションデーにてポスター発表されました。
|
|
公益財団法人 日本分析化学会 機関紙「ぶんせき」に本技術が掲載されました。 |
性質
バイオフィルムは、微生物とその代謝物である細胞外多糖から構成される集合体で、あらゆる環境に存在しています。近年、バイオフィルム形成阻害能を有する薬剤や、食品成分の探索が注目を集めています。
|
バイオフィルム形成量・形成阻害測定キット(Biofilm Formation Assay Kit)は、バイオフィルム形成から測定にピンプレートを用いた操作を採用し、必要なコンポーネントが1つにまとまっています。また、本キットではクリスタルバイオレット(CV)染色法を採用しています。 |
クリスタルバイオレット(CV)染色法
1982年にPedersenはさまざまなバイオフィルムについて、クリスタルバイオレット色素の吸着量とバイオフィルムの乾燥重量が一次相関することを示しており、クリスタルバイオレット染色法は今日に至るまでバイオフィルム検出に広く用いられています。
参考文献:K. Pedersen,"Method for Studying Microbial Biofilms in Flowing-Water Systems", Appl. Environ. Microbiol., 1982, 43(1), 6.
マニュアル
技術情報
特徴① 測定の手間を大幅に低減
既存法はマイクロプレートの底にバイオフィルムを形成するため、菌の培養に伴う培地交換や、染色工程前後の洗浄作業に多くの手間を要していました。本キットは蓋に固定されたピン上にバイオフィルムを形成させるため、培地交換や染色工程が蓋を移すだけで完了し、操作が非常に簡便です。
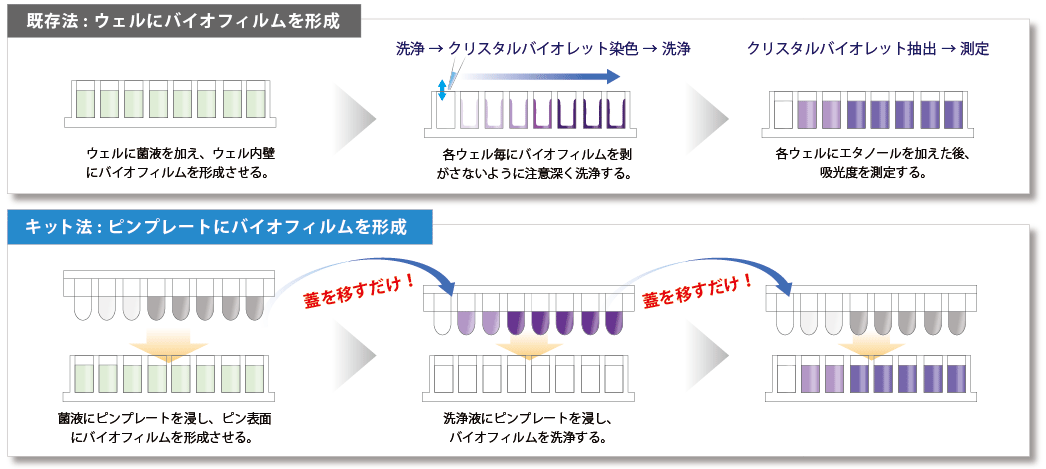 |
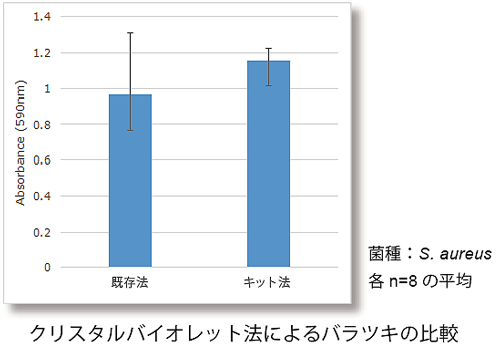
特徴② バラツキを抑えることが可能
既存法はマイクロプレート底面にバイオフィルムを形成するため、洗浄操作等でバイオフィルムが剥離しやすく、測定値のばらつきが課題でした。本キットはピン表面にバイオフィルムを形成させ、一連の操作によるバイオフィルムの剥がれを抑えます。

<ピンプレートが使用された参考文献>
T. Tsukatani, F. Sakata, R. Kuroda, "A rapid and simple measurement method for biofilm formation inhibitory activity using 96‑pin microtiter plate lids", World J. Microbiol. Biotechnol., 2020, doi:10.1007/s11274-020-02964-6.
操作
本キットはクリスタルバイオレット染色法によりバイオフィルム形成量および薬剤のバイオフィルム形成阻害を測定することができます。蓋に固定されたピン(PEG)にバイオフィルムを形成させるため、洗浄・染色操作によりバイオフィルムが剥がれることが無く、多検体を簡便に測定することが可能です。
.png)
目的に応じた2種類のキット
同一の測定手法でバイオフィルムの形成量、またはバイオフィルムに含まれる生菌の代謝活性を測定するキットを取り揃えております。
ご利用の目的に応じてキットをご選択ください。
| バイオフィルム(生菌+死菌+細胞外高分子物質)の総量 |
| バイオフィルム形成量・形成阻害測定キット Biofilm Formation Assay Kit(本製品) |
| Biofilm Formation Assay Kitはクリスタルバイオレット(CV)染色法によりバイオフィルム形成量および薬剤のバイオフィルム形成阻害を測定することができます。 |
 |
| 菌等の増殖活性 |
| バイオフィルム薬剤効果測定キット Biofilm Viability Assay Kit(関連製品) |
| Biofilm Viability Assay Kitはバイオフィルム内の生菌の代謝活性をWST法により測定することで、バイオフィルム内の微生物に対する薬剤の殺菌効果を確認することができます。 |
2種類のキットの選び方
※ バイオフィルムの形成条件は菌種や株によって異なります。まず、形成条件の検討にBiofilm Formation Assay Kit(本製品)をご利用ください。 |
測定例
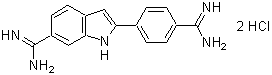
バイオフィルムに対する薬剤の形成阻害や抗菌効果の指標としては、MBIC(minimum biofilm inhibitory concentrations):最小バイオフィルム形成阻害濃度や、MBEC(minimum biofilm eradication concentrations):最小バイオフィルム撲滅濃度が指標として用いられています。S. aureusについて、各キットでMBICならびにMBECを測定しました。
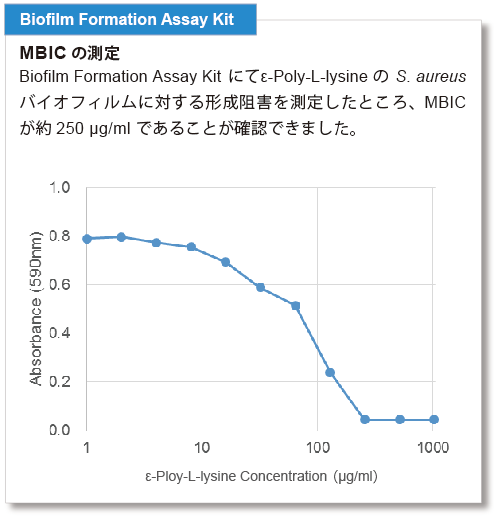
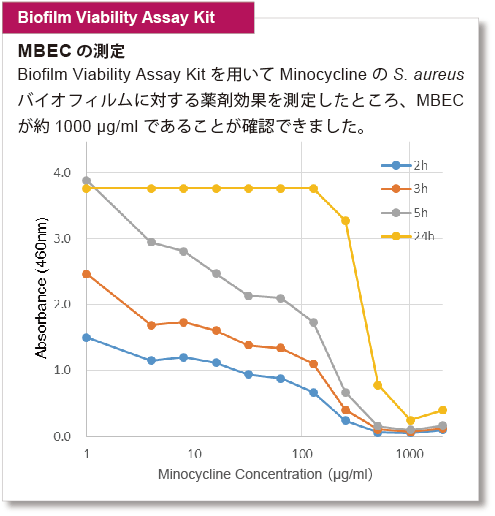
※実験の条件は取扱説明書に記載しておりますので、ご参照ください。
その他ラインナップの紹介
試験片用バイオフィルム形成能測定キット
Biofilm TestPiece Assay Kit (製品コード B606)
様々な素材の試験片を用いて、各素材に対するバイオフィルム形成能を評価する場合に最適なキットです。
本製品は、独自の技術であるTestPiece Holderを用いることで、既存法と比較してデータのバラツキ(再現性の低さ)と測定の手間を大幅に改善することが可能です。


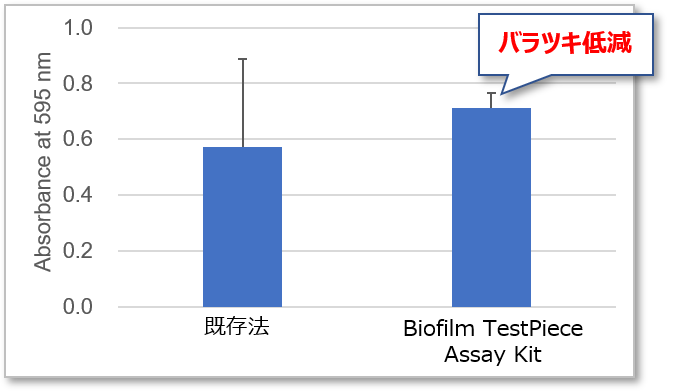
クリスタルバイオレット法によるばらつきの比較
菌種:Staphylococcus aureus NBRC13276
各 n=8の平均
参考文献
| 文献No. | 対象サンプル | 引用(リンク) |
|---|---|---|
| 1) | Streptococcus mutans (ATCC 35668) |
I. Okamoto, H. Miyaji, S. Miyata, K. Shitomi, T. Sugaya, N. Ushijima, T. Akasaka, S. Enya, S. Saita and H. Kawasaki, "Antibacterial and Antibiofilm Photodynamic Activities of Lysozyme-Au Nanoclusters/Rose Bengal Conjugates", ACS Omega, 2021, doi:10.1021/acsomega.1c00838. |
| 2) | A. baumannii (MDRAB) |
Y. Sato, T. Ubagai, S. T.-Nagakawa, Y. Yoshino, Y. Ono, "Effects of colistin and  on multidrug-resistant Acinetobacter baumannii biofilms: advantages and disadvantages of their combination", Sci. Rep., 2021, 11, 11700. doi:10.1038/s41598-021-90732-3. on multidrug-resistant Acinetobacter baumannii biofilms: advantages and disadvantages of their combination", Sci. Rep., 2021, 11, 11700. doi:10.1038/s41598-021-90732-3. |
| 3) | Staphylococcus aureus | S. Zhang, X. Qu, J. Jiao, H. Tang, M. Wang. Y. Wang, H. Yang, W. Yuan and B. Yue, " enhances aminoglycosides efficacy against implant infections caused by methicillin-resistant Staphylococcus aureus, persisters and biofilms", Bioact. Mater., 2021, doi: 10.1016/j.bioactmat.2021.11.019. enhances aminoglycosides efficacy against implant infections caused by methicillin-resistant Staphylococcus aureus, persisters and biofilms", Bioact. Mater., 2021, doi: 10.1016/j.bioactmat.2021.11.019. |
| 4) | Vibrio parahaemolyticus (腸炎ビブリオ) |
M. Billaud, F. Seneca, E. Tambutté and D. Czerucka, "An Increase of Seawater Temperature Upregulates the Expression of Vibrio parahaemolyticus Virulence Factors Implicated in Adhesion and Biofilm Formation", Frontiers in Microbiology, 2022, 13, 840628. |
| 5) | R. capsulatus | T. Shimizu, T. Aritoshi, J. T. Beatty and T. Masuda, "Persulfide-Responsive Transcription Factor SqrR Regulates Gene Transfer and Biofilm Formation via the Metabolic Modulation of Cyclic di-GMP in Rhodobacter capsulatus", 2022, doi:10.3390/microorganisms10050908. |
よくある質問
-
Q
バイオフィルムの形成条件はどのように検討すればいいですか?
-
A
バイオフィルム形成条件の検討項目としては、培地の種類、菌播種濃度、培地の交換回数、培養時間、培養温度などが挙げられます。
そのうち、培地の種類、菌播種濃度、培地の交換回数、培養時間を検討する場合の実験例をご紹介致します。
培養温度を検討される場合には、Biofilm Formation Assay Kit(製品コード:B601)を複数ご用意頂く必要がございます。
---------------------------------------------------------------------------------------------
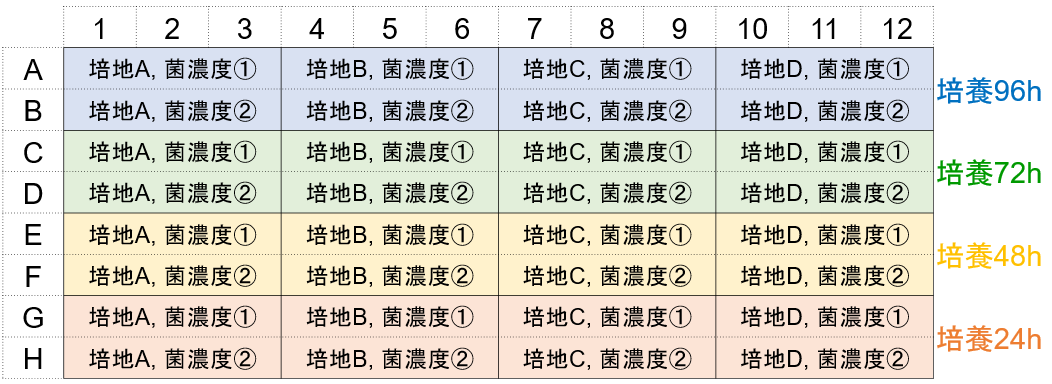
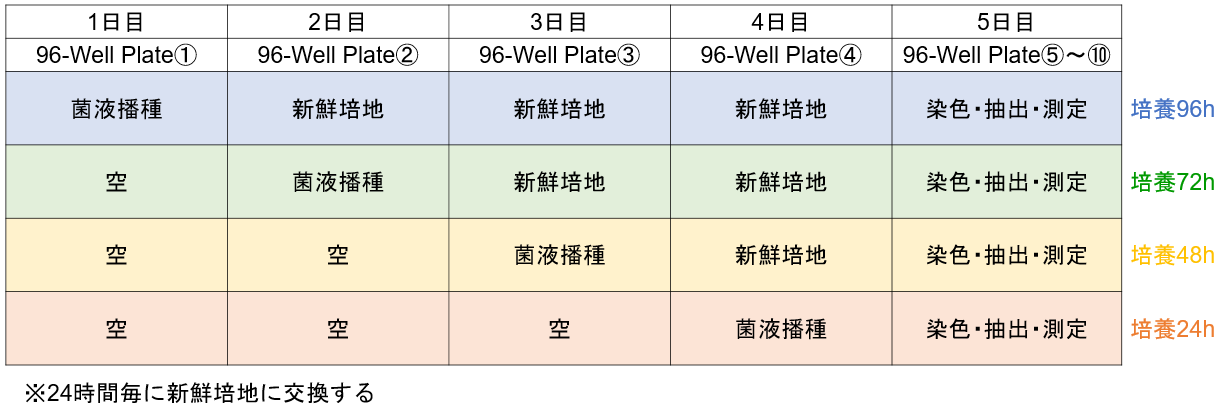
形成量検討例-①
この検討により培地の種類、菌播種濃度、培地交換条件下でのバイオフィルム形成量を確認できます。(プレート配置例)
日程表
手順
1)一日目:96-well plate① A, B行の各ウェルに培地A~Dで調液した菌濃度①, ②の菌液を配置例と同じように180 μl播種する。
C~H行は空のままにする。96-peg Lidを被せ、微生物の成長に適した温度で24時間培養する。
※例:菌濃度①約107CFU/ml、菌濃度②約106CFU/ml
2)二日目:96-well plate② A, B行の各ウェルに菌を含まない培地を配置例と同じように180 μl入れる。
C, D行の各ウェルに培地A~Dで調液した菌濃度①, ②の菌液を配置例と同じように180 μl播種する。E~H行は空のままにする。
手順1)の96-peg Lidを96-well plate②に被せ、微生物の成長に適した温度で引き続き24時間培養する。
3)三日目:96-well plate③ A~D行の各ウェルに菌を含まない培地を配置例と同じように180 μl入れる。
E,F行の各ウェルに培地A~Dで調液した菌濃度①, ②の菌液を配置例と同じように180 μl播種する。G,H行は空のままにする。
手順2)の96-peg Lidを96-well plate③に被せ、微生物の成長に適した温度で引き続き24時間培養する。
4)四日目:96-well plate④ A~F行の各ウェルに菌を含まない培地を配置例と同じように180 μl入れる。
G,H行の各ウェルに培地A~Dで調液した菌濃度①, ②の菌液を配置例と同じように180 μl播種する。
手順3)の96-peg Lidを96-well plate④に被せ、微生物の成長に適した温度で引き続き24時間培養する。
5)取扱説明書のバイオフィルム形成量・バイオフィルム形成阻害測定の手順(2)~(6)を新しい96-well plateを用いて行う。---------------------------------------------------------------------------------------------
形成量検討例-②
この検討により培地の種類、菌播種濃度、培養時間条件下でのバイオフィルム形成量を確認できます。(プレート配置例)

日程表
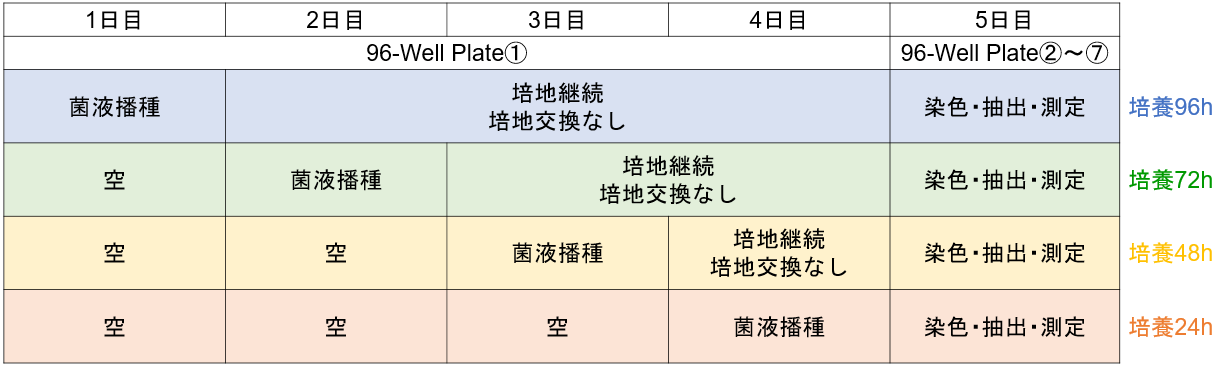
手順
1)一日目:96-well plate① A, B行の各ウェルに培地A~Dで調液した菌濃度①, ②の菌液を配置例と同じように180 μl播種する。
C~H行は空のままにする。96-peg Lidを被せ、微生物の成長に適した温度で24時間培養する。
※例:菌濃度①約107CFU/ml、菌濃度②約106CFU/ml
2)二日目:96-peg Lidを外す。96-well plate①の A, B行は培地を交換せずに培養を継続する。
C,D行の各ウェルに培地A~Dで調液した菌濃度①, ②の菌液を配置例と同じように180 μl播種する。E~H行は空のままにする。
外しておいた96-peg Lidを96-well plate①に被せ、微生物の成長に適した温度で引き続き24時間培養する。
3)三日目:96-peg Lidを外す。96-well plate①の A~D行は培地を交換せずに培養を継続する。
E, F行の各ウェルに培地A~Dで調液した菌濃度①, ②の菌液を配置例と同じように180 μl播種する。G, H行は空のままにする。
外しておいた96-peg Lidを96-well plate①に被せ、微生物の成長に適した温度で引き続き24時間培養する。
4)四日目:96-peg Lidを外す。96-well plate①の96-well plate①の A~F行は培地を交換せずに培養を継続する。
G,H行の各ウェルに培地A~Dで調液した菌濃度①, ②の菌液を配置例と同じように180 μl播種する。
外しておいた96-peg Lidを96-well plate①に被せ、微生物の成長に適した温度で引き続き24時間培養する。
5)取扱説明書のバイオフィルム形成量・バイオフィルム形成阻害測定の手順(2)~(6)を新しい96-well Plateを用いて行う。
-
Q
どのような菌種での測定実績がありますか?
-
A
小社ではBiofilm Formation Assay Kit(本製品)ならびにBiofilm Viability Assay Kit(製品コード:B603)を用いたバイオフィルムの評価において、以下の菌種での評価実績がございます。
・Staphylococcus aureus(黄色ブドウ球菌)
・Pseudomonas aeruginosa(緑膿菌)
・Escherichia coli(大腸菌)
・Streptococcus mutans(虫歯の原因菌のひとつ)
・Porphyromonas gingivalis(歯周病の代表的な原因細菌)上記の細菌を用いた実験例や培養条件等は、取扱説明書をご参照ください。
-
Q
バイオフィルムの形成阻害や薬剤効果を評価するには、どの程度のバイオフィルム形成量が必要ですか?
-
A
Biofilm Formation Assay Kit(製品コード:B601)を利用した場合、測定手順の最後に得られるクリスタルバイオレット(CV)溶液の吸光度として、0.5 以上(590 nm)を目安としています。