低酸素応答 – 生存機構からがん幹細胞ニッチ形成へ
Hypoxic response – from survival mechanism to cancer stem cell niche formation
 |
サンペトラ・オルテア 慶應義塾大学 医学部先端医科学研究所 遺伝子制御研究部門 |
 |
佐谷 秀行 慶應義塾大学 医学部先端医科学研究所 遺伝子制御研究部門 |
Abstract
Oxygen is a vital component of metabolism, energy production, and redox balance in mammalian cells. A robust response to hypoxia is thus essential to tissue homeostasis and survival. At cellular level, transcriptional and epigenetic responses converge to minimize the damage induced by lack of oxygen. However, the same response can be hijacked and used to support uncontrolled growth, as seen in certain types of cancer cells. Here we briefly review the hypoxic response and recent advances in our understanding of hypoxia in cancer.
1. はじめに
私たちの体内において、酸素はエネルギー産生と代謝、酵素反応と酸化還元などの礎となっており、生命維持に不可欠な要素である。したがって、低酸素状態をいち早く感知する機構と酸素不足による損傷を阻止する機構は組織のホメオスタシスを保つために必須である。これら二つの機構が連動することで「低酸素応答」が成立し、低酸素状態への適応が可能となる。低酸素応答の仕組みは長年研究されており、その一部の解明は2019年のノーベル生理学・医学賞の対象となった1)。一方、研究が進むにつれて、新しい課題も浮かび上がってきた。例えば、がん組織における低酸素応答は考えられてきたより複雑で、細胞増殖、浸潤のみならず、がん幹細胞のニッチ形成にも利用されることがある。本稿では低酸素応答について簡潔に述べ、がんにおける最近の知見について概説する。
2. 低酸素状態の発生
酸素の供給と消費のバランスが崩れると体全体、あるいはその一部が低酸素状態に陥る。その具体的な数値は体内部位や状況によって異なるが、例えば、臓器への酸素供給を維持するために、動脈を流れる血液の酸素分圧PaO2が定常状態では80-100mmHg に保たれており、60mmHg以下のPaO2は低酸素血症とみなされる。組織中の酸素濃度は臓器の特性を反映して、ある程度異なっているが、2%以下の酸素濃度では、ほとんどの細胞が低酸素状態に陥ると考えられている2)。
必要とされている酸素と利用可能な酸素の不均衡は発生過程、高地での生活や運動などの生理的な状況でもみられ、虚血、貧血、細菌感染、炎症、線維化、がんなどの病的現象でも起きることが知られている(図1)。しかし、前者では酸素不足を感知する機構及び供給と消費のバランスを修復する機構が正常に働く一方、後者ではどちらか、あるいは両方が破綻していることが多い。低酸素の環境では、電子受容体としても重要な分子状O2自体の不足に加え、ミトコンドリア呼吸、酸化的リン酸化の低下、ATPの減少、代償的な解糖系亢進と乳酸蓄積、そして、一見逆説的な活性酸素の増加3)まで誘導される。
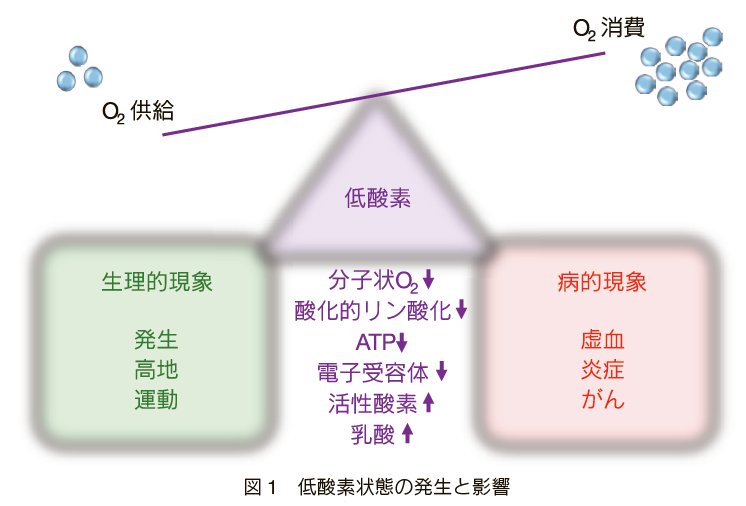 必要な酸素の供給が低下したり、消費が増えたりした場合、低酸素状態が発生する。低酸素状態は生理的な状況でも、病的現象でも誘導されることがある。
必要な酸素の供給が低下したり、消費が増えたりした場合、低酸素状態が発生する。低酸素状態は生理的な状況でも、病的現象でも誘導されることがある。
3.低酸素応答
酸素不足をできるだけ早期に感知するため、体内には複数のセンシング機構が備わっている。一番迅速な反応は秒単位で誘導され、末梢性の化学受容体を介した感知・応答に代表される。血液中の酸素レベルは睡眠から運動までの様々な状況で安定している。急な酸素分圧低下は頸動脈小体や大動脈小体などの化学受容体、酸素感受性イオンチャネルによって感知され、情報が呼吸中枢へと伝達され、呼吸の神経性調節、換気促進へとつながる4),5)(図2)。この低酸素応答は20世紀前半から知られているが、近年では、ミトコンドリア複合体I 由来の活性酸素とK+ チャネルを中心とする緻密な分子基盤も明らかになった6)。
早い全身性の低酸素応答に加え、細胞レベルでは転写因子を介した応答が重要な役割を果たす。その代表的な経路はプロリン水酸化酵素PHD(prolyl hydroxylase domain containing protein)とその基質である低酸素応答誘導因子HIF(hypoxia-inducible factor)を中心とした HIF-PHD経路である。分子状酸素O2が存在する環境においては酸素添加酵素であるPHD がHIF のαサブユニットであるHIFαの一つか両方の特定のプロリン残基を水酸化する。その結果、HIFαがユビキチン化され、プロテアソームにおいて分解されるため、定常状態ではHIF のタンパク発現及び転写因子としての働きが低い。一方、低酸素の環境ではPHDの酵素活性が酸素濃度依存的に低下し、HIFαのプロリン水酸化、分解が抑制される。分解を免れたHIFαがHIF のβ-サブユニットであるHIFβとヘテロダイマーを形成し、hypoxia-responsive element(HRE)を有し、低酸素状態への適応に必要な遺伝子の転写を促進する7),8)。その転写標的としてはすでに2500種類以上同定され1)、酸素運搬や血流上昇などの全身作用につながる遺伝子から、アポトーシス回避、オートファジー、血管新生、上皮間葉転換、解糖経路亢進などのように、局所の適応反応を誘導する現象も含まれている(図2)。そして、近年ではPHD以外の酵素的酸素センサーと、転写を介さない調節機構も次々発見されている。
センサーとしてはチオール酸化酵素9)やヒストン脱メチル化酵素10),11)が報告されている。このような酵素的酸素センサーは、HIF-PHDシステムによって伝達される転写応答よりも短い時間スケールで作用している。例えば、チオール酸化酵素であるADO(cysteamine(2-aminoethanethiol)dioxygenase)は、酸素依存的にGタンパク質シグナリングの制御因子であるRGS4/5や血管新生関連サイトカインであるインターロイキン32などのタンパク安定性を制御し、酸素センサーとしての役割も担っている9)。
また、低酸素時のクロマチン変化を解析した研究では、30分間の短い低酸素曝露ですでにH3K4me3、H3K36me3を含むヒストンH3のメチル化が始まり、その結果、上皮間葉転換、細胞周期や酸化的リン酸化関連遺伝子の発現が調節されることが明らかになった10)。この変化はヒストン脱メチル化酵素のKDM5Aを酸素センサーとしており、HIF非依存性の変化であった。また、興味深いことに、ヒストンのメチル化は可逆的であり、1時間の再酸素化によって元の状態に戻ることも明らかになった。
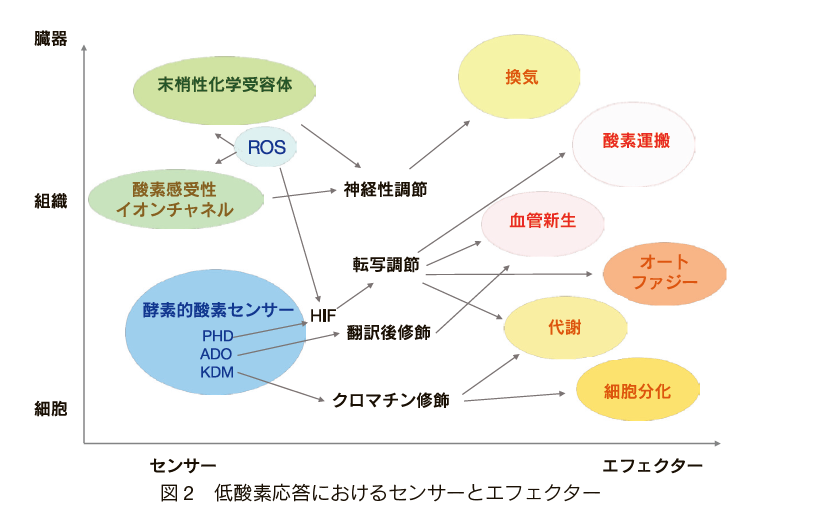 ホメオスタシスを維持するため、酸素不足を感知するセンサーは臓器、組織、細胞レベルで複数存在する。センサーからの情報は転写調節、翻訳後修飾やクロマチン修飾などを介して、細胞生存に必要な現象を誘導する。ROS: reactive oxygen species, HIF: hypoxia-inducible factor, PHD: prolyl hydroxylase domain containing protein, ADO: cysteamine (2-aminoethanethiol) dioxygenase, KDM: histone lysine demethylase.
ホメオスタシスを維持するため、酸素不足を感知するセンサーは臓器、組織、細胞レベルで複数存在する。センサーからの情報は転写調節、翻訳後修飾やクロマチン修飾などを介して、細胞生存に必要な現象を誘導する。ROS: reactive oxygen species, HIF: hypoxia-inducible factor, PHD: prolyl hydroxylase domain containing protein, ADO: cysteamine (2-aminoethanethiol) dioxygenase, KDM: histone lysine demethylase.
4.がんにおける低酸素及び低酸素応答
がん細胞の多くは酸素が存在する状況でも酸化的リン酸化より好気的解糖からエネルギーを得ている。ワールブルグ効果として知られているこの特徴をもつ腫瘍では、腫瘍径が1mmを超えると血管から拡散する酸素が足りなくなり、中心部が低酸素に陥ることが知られている。また、腫瘍細胞が血管の周囲に集積することで血管が破綻し、急な酸素不足につながる現象もがんにおける低酸素領域の発生機序として有名である。
低酸素領域が発生すると、腫瘍細胞は生存、増殖に適した環境を探すために正常の組織に浸潤する。また、分子状の酸素が不足する領域では活性酸素の減少に伴い、放射線治療の効果も減衰する。低酸素はがん細胞が免疫応答を回避する現象にも寄与すると報告されている。さらに、酸素が十分に存在する場合でも、例えば、がん遺伝子の影響で増殖因子産生、PI3KやMAPK経路12)が異常亢進し、HIFの合成が促進されることがある。つまり、がんでは低酸素が感知されない状況でも低酸素応答の一部が常にONとなり、生存、増殖、血管新生などのシグナルが腫瘍増大の冗長につながる。そして、近年では酸素欠乏の新たな発生機序も明らかになってきた。
前述のとおり、多くのがん細胞は好気的解糖を利用する。しかし、最近では膵がん、メラノーマ、脳腫瘍などにおいて、酸化的リン酸化、ミトコンドリア呼吸を利用してエネルギーを産生するがん細胞の存在が示された13),14)。このような細胞は解糖系を利用する細胞より酸素消費が高い結果、腫瘍径が数百μmから酸素欠乏が生じることも分かってきた。
筆者らが確立したマウスの誘導型脳腫瘍幹細胞モデルの解析でも、脳腫瘍を維持する役割を担うグリオーマ幹細胞(Glioma Stem Cell, GSC)には解糖系を利用する分画GSCglyと酸化的リン酸化を利用する分画GSCmit が存在することが分かった15)。両者は同程度の腫瘍形成能を持ち、病理組織像からは区別できない腫瘍を形成する。GSCglyではHIF及びその転写標的である解糖系酵素のHK2やLDHA等の発現が高く、低酸素領域はこのタイプの幹細胞にとってその自己複製能を担保する「ニッチ」と呼ばれる特別な環境に相当する。一方、GSCmitはミトコンドリア複合体の発現が高く、酸素濃度が高い血管近傍をニッチとする。
そして、GSCmitを3次元培養し、スフェアと呼ばれる小さな腫瘍塊を形成させ、低酸素領域を標識すると、前述のとおり、早い段階から酸素不足が進んでいることが明らかになった(図3)。さらに、スフェアに解糖系阻害剤を投与した場合、増殖は抑制されたが、低酸素が発生した一方、ミトコンドリア複合体の阻害剤を投与した場合、低酸素がほとんど生じないことも確認できた。つまり、ミトコンドリア利用タイプのがん細胞を排除するには、HIFの阻害剤とまったく異なる戦略が必要であることが明らかになった。ミトコンドリア複合体阻害剤による低酸素の解消は同時にGSCglyのニッチ形成予防にもつながると考えられ、またその放射線増感効果も期待されている16)。
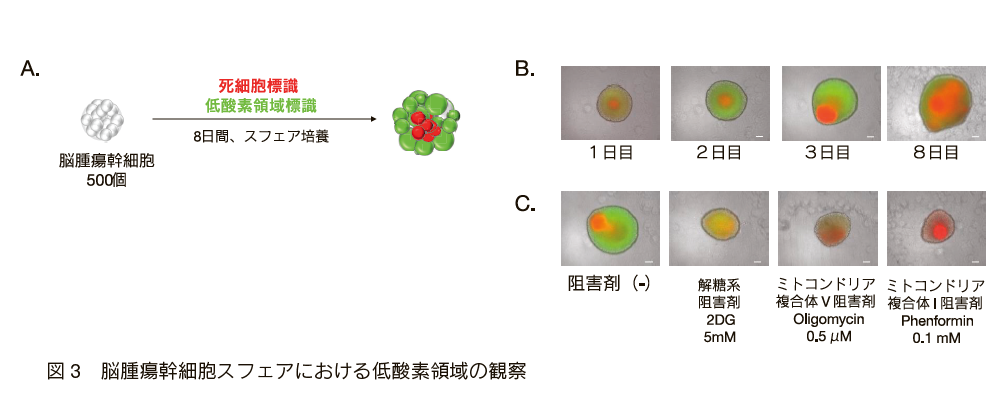 A.酸化的リン酸化を利用する脳腫瘍幹細胞からスフェアを形成させ、8日間培養した。PI(propidium iodide) で死細胞を標識し、低酸素標識プローブを用いて低酸素領域を可視化した。B.スフェア増大に伴い、低酸素領域も死細胞も経時的に増える。C.コントロール群と比べ、解糖系阻害剤投与群では増殖抑制のみ観察されるのに対し、ミトコンドリア複合体阻害剤投与群では増殖に加え、低酸素の発生も抑制されている。スケール、100μm。
A.酸化的リン酸化を利用する脳腫瘍幹細胞からスフェアを形成させ、8日間培養した。PI(propidium iodide) で死細胞を標識し、低酸素標識プローブを用いて低酸素領域を可視化した。B.スフェア増大に伴い、低酸素領域も死細胞も経時的に増える。C.コントロール群と比べ、解糖系阻害剤投与群では増殖抑制のみ観察されるのに対し、ミトコンドリア複合体阻害剤投与群では増殖に加え、低酸素の発生も抑制されている。スケール、100μm。
5. 終わりに
本稿で紹介したように、私たちの体では酸素の濃度が常にモニタリングされている。そして、低下が認められた場合、急性期、慢性期において複数の応答機構が協調的に作動し、ホメオスタシスを維持する。その機構の解明は腎性貧血におけるPHD阻害剤のように、すでに臨床応用につながっている。一方、がんにおいては単剤による低酸素の劇的な改善は難しく、低酸素応答の更なる解明により複数の機構を標的とした併用療法の開発が期待される。
| [ 著者プロフィール ] | |
| 氏名 | サンペトラ オルテア(SAMPETREAN Oltea) |
|---|---|
| 所属 |
慶應義塾大学医学部 先端医科学研究所 遺伝子制御研究部門 〒160-8582 東京都新宿区信濃町35 Tel:03-5363-3983 |
| 出身学校 | 東京医科歯科大学 |
| 学位 | 博士(医学) |
| 専門分野 | 脳腫瘍、腫瘍生物学 |
| 現在の研究テーマ | 脳腫瘍幹細胞の代謝、浸潤、治療抵抗性 |
| [ 著者プロフィール ] | |
| 氏名 | 佐谷 秀行(Hideyuki Saya) |
|---|---|
| 所属 |
慶應義塾大学医学部 先端医科学研究所 遺伝子制御研究部門 〒160-8582 東京都新宿区信濃町35 Tel:03-5363-3983 |
| 出身学校 | 神戸大学 |
| 学位 | 博士(医学) |
| 専門分野 | 腫瘍生物学 |
| 現在の研究テーマ | 治療抵抗性がんの克服 |