�o�C�I�t�B������m��\���W�I�l���o�C�I�t�B�����̕]���\
Let's learn about biofilms �\Evaluation of Legionella biofilm�\
 |
�Ô��@���� ���z��w �����E���Ȋw�� ���� |
Abstract
�@As a preventive measure against Legionella disease, which is a respiratory infection, it is important to take measures against the source of infection. To date, the effectiveness of bactericidal agents, etc. against Legionella pneumophila, which is the causative agent of Legionellosis, has been evaluated via an experimental system in which floating cells come into contact with a chemical agent. However, an evaluation system in an attached state has been anticipated when hypothesizing L. pneumophila's “home”. Therefore, a basic examination was experimentally conducted based on the conditions the biofilm of this bacteria are known to form. In other words, L. pneumophila was allowed to form a biofilm by changing the strain, the material of the carrier, and the reaction temperature in order to compare the amount of biofilm formation by the CV method (crystal violet method). As a result, the optimum conditions for biofilm formation of L. pneumophila were considered to be the use one serogroup strain which is allowed to stand for 7 days on a carrier of silicon and processed at 30��. Furthermore, upon confirming the reaction state, using the Biofilm Viability Assay Kit via the WST method (water-soluble tetrazolium salt method), which was newly developed as an evaluation method after bactericide treatment, it was believed that it could be used to measure the MBEC (minimum biofilm eradication concentration), due to the fact that the WST method enabled the cell activity of L. pneumophila.
1�D �͂��߂�
�@�o�C�I�t�B�����̔����͓���Ȍ��ۂ̂悤�ɍl�����邪�A����͉�X�l�Ԃ̎��_�ł���A���̌��ۂ���������Ԋw�I�ɔ������̎��_�łƂ炦��ƁA�������R�Ȍ��ۂł����āA�o�C�I�t�B������ “�������̂��݂�”�Ƃ�������B�g�߂Ȋ��ɂ����āA����A�̈���킸�A���������݂���ꏊ�ł̓o�C�I�t�B��������������ƍl���ĂقڊԈႢ�Ȃ��B
�@�{�e�ł́A��ʓI�ȃo�C�I�t�B�����ɂ��ĊT�����A����Ƀ��W�I�l���ɂ��o�C�I�t�B�����̕]�����@�ɂ��Ă����y�����B
2�D ���͐g�߂ȃo�C�I�t�B����
�@�ߔN�A���q����H�i�Ȃǂ̐�������ɂ����āu�o�C�I�t�B�����v�Ƃ������t������������@������Ȃ����B����A��w���Â̕���ł͌Â�����o�C�I�t�B���������ǂƂ��Ēm���Ă������A�Պ����҂̑���ɂ�������ǂƂ��ăN���[�Y�A�b�v����Ă��� 1�j�B�܂��A�o�C�I�t�B�����́A�����H�Ƃ�q���H�w�Ȃǂ̓���̕���ł̓X���C���Ə̂���A����Ɉ�ʂɂ̓k�����A�k���k���Ȃǂƌ����Ă���B
�@�����ƊE�ł̃X���C���i�o�C�I�t�B�����j�̔����͌Â�����傫�ȉۑ�ƂȂ��Ă����B1966 �N�i���a 41 �N�j�ɂ͏�J�ƒ��J��ɂ���āu�����H��ɂ�����X���C���ƃX���C���R���g���[���܂ɂ��āv�Ƒ肷��_�������łɔ��\����Ă��� 2�j�B���̘_���̖`���ɂ́A�u�����A�����H��ɂ����Ĕ��������Q�Ƃ��āA���ɃX���C���������Ȃ���Ȃ�Ȃ��قǏd�v�Ȗ��ƂȂ��Ă���B�v�Ƃ����L�q������A���̕���ł͔����I�ȏ���O���炷�łɃX���C���̔�������莋����Ă����̂ł���B
�@����A�Z���ɂ����Ă����Ɏ��x��������������ʏ��A�䏊���̐�����ł̓s���N�F��悷��k���k�������o�C�I�t�B�������ȑO�����莋����Ă��� 3�j�B�l�X�̐��������̌���ɂƂ��Ȃ��A�A���j�e�B�[�A���Ȃ킿�u���K���v�Ƃ����T�O���L�܂�A����ꂽ���Z��Ԃłł��邾���C�����悭�A�����ɐ����������Ƃ̈ӎ������܂��Ă����B�����������Z�҂̈ӎ��ω��f���ċ��Z���Ŕ��������o�C�I�t�B�����̊O�ς⊴�G����s�������A�v�E�{�H�҂�ɑi�ז��ɂ܂Ŕ��W�������������B
3�D �o�C�I�t�B�����̐���
�@�o�C�I�t�B�����́A�ۂ��͂��߁A�^�ہA���ށA���������ȂǑ��푽�l�Ȕ���������\������鍂���\���̂ł��邱�Ƃ��m���Ă��� 4�j�B�} 1 �Ɏ������ʂ�A�o�C�I�t�B�����́A�u�זE�O�����ރ}�g���b�N�X���ɕ����߂�ꂽ�ۂ̃~�N���R���j�[���_�݂��A���̊Ԃ𐅂���r�I���R�ɓ����� water channels ���܂ޖ��x�̒Ⴂ�|���}�[�}�g���b�N�X�����߂Ă���v�Ƃ����o�C�I�t�B�����̎O�����\�������炩�ɂ���Ă��� 5�j�B
�@�������̓o�C�I�t�B�������`�����邱�Ƃɂ���āA�D�܂���������ɑؗ����A���݂����������Ȃ��玩��̖������ʂ����A�l�X�ȊO�I�U������g������Ă���B�Ⴆ�A�o�C�I�t�B�������`�������Δ^�ۂł́A�R�������ɑ���ϐ������V�זE�ɔ�ׂĐ��S�{���㏸���A����Â�����ɂ��Ă��� 6�j�B

�@���V�]�� 7�j�́A���F�u�h�E���ۂ̃o�C�I�t�B��������זE�O�}�g���N�X�iECM�j�^���p�N����P���E���肵���BECM �ɂ́A�����̂� DNA�A�^���p�N���Ȃǂ��܂܂�Ă��邱�Ƃ͒m���Ă������A�ނ�̃Z�����v���e�A�[�[�iEsp�j��p������͂ɂ���āA�� 130 ��ނ̃^���p�N�������݂��邱�Ƃ����炩�ɂ���A���� 64�����זE���^���p�N�ł���A12��������^���p�N���A6�������^���p�N���ł����� 8�j�B
4�D �o�C�I�t�B�����̌`���ߒ�
�@�g�߂Ȋ��ɂ�����o�C�I�t�B�����̌`���́A�����̍ۂ������̏���䏊�̃V���N�Ȃǂ̒S�̂ɕt�����邱�Ƃ���n�܂�A�t�������ۂ͉�����܂Ȃǂ��h�{���ɍ����A�����̏������ŒZ���Ԃɑ��B���A�S�t�������Y��������ɐ��n���Ă������̂ƍl�����Ă��� 9�j�B�������̑��Ɏ��_���ڂ��Ă݂�A�u�t���v�͔������̐����l���̈�ł���A�S�̂ւ̕t���ɑ����o�C�I�t�B�����̌`���͔������ɂƂ��đ�ψ��肵����Ԃł���A�ނ�̐����c��Ɋւ��ďd�v�ȈӖ��������Ă���B
�@�ꌩ�A����ɂ݂��镨���\�ʂł������̗L�@���△�@�����t�����Ă���A������R���f�B�V���j���O�t�B�������`�����Ă���B���̃R���f�B�V���j���O�t�B�����́A�������ɂƂ��ĔZ�k���ꂽ�h�{���ł������łȂ��A�\�ʂ̕������w�I������ω������Ă���B�������������\�ʂɍۂ��t�����邽�߂ɂ́A�܂��ږт���т���ĕ����\�ʂɉt�I�t����ԂƌĂ��悤�Ɋɂ��t������B���̏�Ԃ́A���V��Ԃƕt����Ԃ̒��Ԃ̏�Ԃł���A�ꕔ�̍זE�͍Ăѕ��V��Ԃւƈڍs���邪�A����זE�̓o�C�I�t�B�����`���̑O�i�K�ł���s�t�I�t����Ԃւƈڍs���A�����t������������B���̌�A�t���זE�̑��B��זE�O�|���}�[ (EPS: Extracellular polymeric substances) �̎Y���ɂ��o�C�I�t�B�����̓L�m�R��\�����̏W���̂ւƐ��n���Ă����BEPS �͋ۑ̓��m���݂��Ɍ��т��A�����\�ʂƂ̕t�������łɂ��A�o�C�I�t�B�����̍\�����ێ����铭����S���Ă���B�o�C�I�t�B���������ɂ� EPS ���݂��Ȃ��ג������ώ@����Ă���A���H�̂悤�ȍ\���ɂ��o�C�I�t�B���������̕����z�Ɋ�^���Ă���ƍl�����Ă��� 10�j�i�} 2�j�B
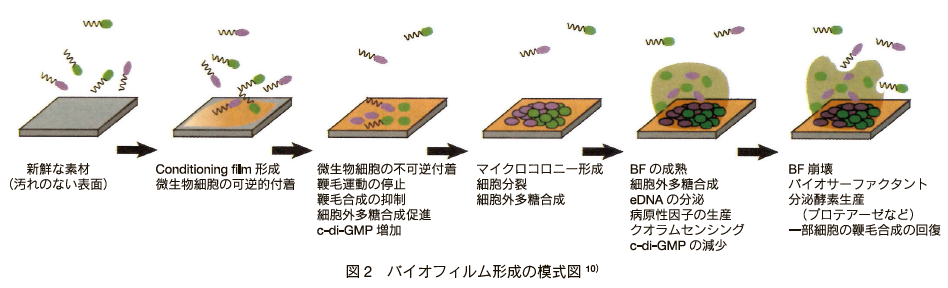
�@���������o�C�I�t�B�����̈�A�̌`���ߒ��ɂ����āA��ɂ����j�~����E����p�������Ă���A�o�C�I�t�B�����̍\���A�g���A�@�\�͕ω��������Ă���B�o�C�I�t�B��������̒E���ɂ́A�O��������̗͂ɂ��u�I�E���v�ƁA�^�����̊������� EPS�̕����ɂ��u�\���I�E���v������B�E���ɂ��o�C�I�t�B�������V�������ւƈړ����ĐV�����o�C�I�t�B�����̌`����ՂƂȂ� 10�j�B
5�D �x���ő́i�S�́j�̍ގ��ƃo�C�I�t�B�����`��
�@�o�C�I�t�B�����`���Ɋւ���זE���x�����邢�͈�`�q���x���ł̃��J�j�Y���ɂ��ẮA���Ȃ藝�����i��ł������A�x���ő̂̍ގ��ƍזE�̏����t����o�C�I�t�B�����`���Ƃ̊W�ɂ��Ă͕s���ȓ_�������B
�@�����̉�� 11�j�ł́A��ʓI�ɔ������זE�\�ʂ͕��ɑѓd�����e�����̕\�ʂŕ����Ă���ƍl�����Ă��邱�Ƃ���A���d�ׂɑѓd�����\�ʂł̓o�C�I�t�B�������`������₷���ƋL�q����Ă���B�������A�������זE�̏����t���ɉe�����y�ڂ��\�ʓ����ɂ́A�\�ʓd�ׂ�\�ʂ̐e�����E�a���������ł͂Ȃ��A�\�ʑe���A�\�ʍd���A�\�ʒ��́A�\�ʎ��R�G�l���M�[�Ȃǂ��֗^���Ă���\�����w�E���Ă���B
�@���V��́A�䏊�r�������番�������ۊ���p���āA�X�e�����X�A�A�N�����A�����r�j���A�|���G�`�����A�V���R���A�K���X�� 6 ��ނ̒S�̂�ΏۂɁA�o�C�I�t�B�����`���ʂ� ATP �l�Ŕ�r���� 12�j�B�o�C�I�t�B�����`���ʂ͋����ۊ��ɂ���ĈقȂ������AKlebsiella pneumoniae ���ł������A�S�̕ʂł̓K���X�A�X�e�����X�A�V���R���̏��ɑ����������A�O�҂ɑ卷�͂Ȃ������B
�@Piao ��́A���W�I�l������ 51 ���ɂ��āA�K���X�A�|���X�`�����A�|���v���s������p���� 25���A37���A42���̉��x�����Ńo�C�I�t�B�����̌`�����r���Ă��� 13�j�B���̌��ʁA�K���X�ƃ|���X�`�����ł́A25������ 37���� 42���̕��� 2 �{���� 7 �{���������B�܂��A�|���v���s�����ł́A37���� 42������ 25���̕��� 2 �{���� 16 �{���������B
�@�X�� 14�j�́A�זE���S�̂ɕt������͂́A�a��������C�I�������A���f�����A���q�ԗ͌����Ȃǂ̕�����p�ł���ƍl�����B���Ȃ킿�A�זE�\�w�̍\����ɐ��Ȃǂ��قȂ�ۂ̎�ނ��ƂɃo�C�I�t�B�������`�����₷���S�̂̍ގ����قȂ�Ɨ\�z�����B�Ƃ��낪�A�����̌��ʁA�\�z�ɔ����čێ���z���ăV���R����|���E���^���A���邢�̓|���G�`������|���v���s�����ō����o�C�I�t�B�����`�����m�F���ꂽ�B�����Ɏg�p���������V�[�g�̃[�[�^�d�ʂ�ڐG�p�𑪒肵�����A�o�C�I�t�B�������`�����₷�������̍ގ��ɋ��ʂ��镨�����w�I�����͔F�߂�ꂸ�A�זE�\�w�Ǝx���ő̕\�ʂƂ̑��ݍ�p�͉𖾂���Ă��Ȃ��B
6�D �ۂ̏��`�B�@�\�i�N�I�����Z���V���O�j
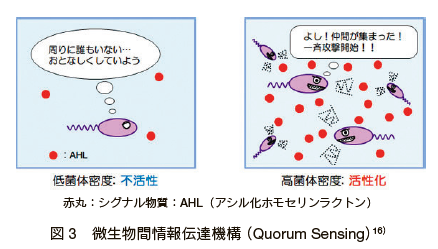
�@�ۂɂƂ��āA���ω��Ɍĉ�������`�q�����̒����́A����̐����c������E����d�v�Ȍ��ۂł���B�����ɂ�����h�{�f�̌��R�A���x�ω��A�}���� pH �ϓ��Ȃǂ֓K�����邱�Ƃ͕K�{�ł���B�ۂ͊��̕ω��A���Ɏ��g�̑��݊��ɂ����閧�x��I�m�Ɋ��m���A���̔Z�x�ω��ɉ����Ĉ�`�q�̔������I���ɐ��䂵�Ă��邱�Ƃ��킩���Ă����B�ߔN�AAutoinducer �ƌĂ��ۂ��Y������z�������l�����i�V�O�i�������j����Ă̏��`�B�@�\�A�N�I�����Z���V���O�iQuorum-sensing�AQS�j�����ڂ���Ă���B���� “quorum” �Ƃ́A��c�Ȃǂ̐����ɕK�v�Ȓ葫���̈Ӗ��ł���A���̓��Ȃǂōۂ�����̐����D�ʂȏɂȂ����Ƃ������Ƃ����m���A�a�����q�Ȃǂ̔�������ĂɊJ�n����V�X�e���Ƃ��ė������邱�Ƃ��ł��� 15�j�i�} 3 16�j�B
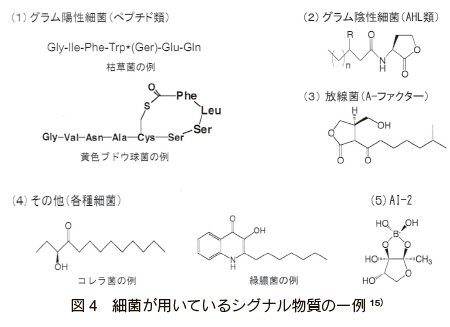
�@�ۂ̎�ނɂ���ĎY�������V�O�i�������̍\���͗l�X�ł���A�O�����A���ۂł̓A�V�����z���Z�������N�g���iAHL�j�� AI-2 ���͂��߂Ƃ��� S-�A�f�m�V�����`�I�j���iSAM�j�U���̂��m���Ă���B�܂��A�O�����z���ۂł̓y�v�`�h���A�����ۂł� A �t�@�N�^�[�Ȃǂ��V�O�i�������Ƃ��ē��肳��Ă��� 15�j�i�} 4�j�B
�@�o�C�I�t�B�������ł͍זE�����W���Ă��邱�Ƃ���A��ӎY���╪�啨�����ł͂Ȃ��A�V�O�i�����������Z�x�ɒ~�ς���ƍl������B�o�C�I�t�B�����͂����ΐ��I�ȗ��̍\�����������A���̍\������ɂ� QS �̊֗^����������Ă���B���̂悤�ɁA�o�C�I�t�B�����`���ƍזE�ԃR�~���j�P�[�V�����̊Ԃɂ͏d�v�Ȋ֘A�����F�߂��邪�A���̉e���͔|�n�Ȃǂ̎��������ɂ���đ傫���قȂ�B�܂��A�����̍ۂ͍זE�ԃR�~���j�P�[�V�����������Ă��Ă��o�C�I�t�B�������`�����邱�Ƃ��m���Ă���A���҂̊֘A���ɂ��Ă͂܂��܂��𖾂���Ă��Ȃ��_�������B
7�D �o�C�I�t�B�����̉�́E�]��
7.1 �o�C�I�t�B�����̍\�����
�@�o�C�I�t�B�����͂��܂��܂ȋ@�\��L�����\���̂ł���A���ɂ���đ��l�Ȑ��Ԃ��������Ƃ��킩���Ă����B�������������̓o�C�I�t�B�����̉�͋Z�p�̔��W�ɔ������̂ł���A�o�C�I�t�B������͋Z�p�̊J���E���ǂ͔��ɏd�v�ł��� 14�j�B
�@�o�C�I�t�B�����͔��ׂȍ\���������������̂ł���A���̍\����m�邽�߂ɑ����^�d�q��������p�����ώ@���Â�����s���Ă����B�������A�����������@�ł͐�������Ԃ̃o�C�I�t�B�������ώ@���邱�Ƃ��ł��Ȃ��������߁A�ߔN�A����ɑ��苤�œ_���[�U�[�����^�d�q��������p������͎�@���L�����p�����悤�ɂȂ����B���̕��@��p���邱�Ƃɂ��A�o�C�I�t�B�������������Ȃǂɉ����āA�}�b�V�����[����̗��̍\���ɂȂ邱�Ƃ�o�C�I�t�B���������ɐ��H��̍\�������݂��邱�ƂȂǂ����炩�ɂȂ��� 5�j�i�} 1�j�B
�@����ɁA�u���^���p�N����p�������œ_���[�U�[�����^�d�q�������ɂ���͂�����ɍs����悤�ɂȂ�A�o�C�I�t�B�������t���A���n�A�E���̃T�C�N���������ƂȂǂ����炩�ɂ���A�o�C�I�t�B�����̌`���ߒ��̌o���I��͂��i�i�} 2�j�B�����ŏd�v�Ȗ������ʂ������̂��t���[�Z���@�ł��� 17�j�B�t���[�Z���@�́A���Ɏ����悤�ȃ}�C�N���v���[�g�@�̂悤�ɑ��������r����ꍇ�ɂ͓K���Ȃ����A�o�C�I�t�B�����̗��̍\���ɂ��Čo���I�ȉ�͂��s���ɂ͗D�ꂽ��@�ł������B
�@����ɋߔN�ł́A���ˌ������@����b�Ƃ��� Continuous-optimizing confocal reflection microscopy�iCOCRM�j���J������ 18�j�A���̂���̔��ˌ����V�O�i���Ƃ��ė��p����_�������ł���A�ۑ̂̌`���]������F���s�킸�� 3 �����\�����������邱�Ƃ��ł��A���̃o�C�I�}�X�ʂ��ʂ��邱�Ƃ��\�ɂȂ��� 9�j�B
7.2 �o�C�I�t�B�����̒�ʉ��
�@�}�C�N���v���[�g��p���ăo�C�I�t�B�����������I�ɐ��������A���F�@�i CV �@�j�ɂ��o�C�I�t�B�����`���ʂ��ʓI�ɕ]��������@�́A�ȑO����L���s���Ă��� 17�j�B���̕��@�͔�r�I��Z���ȒP�ł���A�l�X�ȏ������ɔ�r���₷�����ʁA�o�C�I�t�B�����̌`���i�K�Ōo���I�Ɍ�������ɂ͓K�����A�܂������ȕ�������p��������@�ł������B
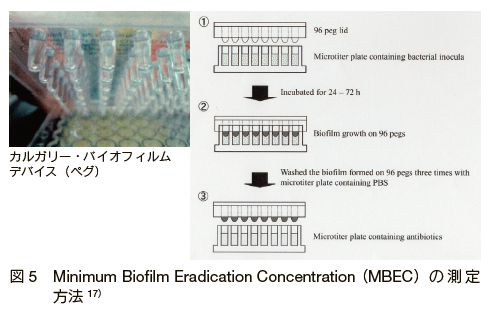
�@����A�ߔN�A�����̂̃o�C�I�t�B�����������悭�쐬���A�R�ۖ����Ŗ�̍�p��]���ł���}�C�N���v���[�g�@�����p�����f�o�C�X���J������A�J���K���[�E�o�C�I�t�B�����f�o�C�X�@�Ƃ����� 19�j�B���̕��@�́A�y�O�ƌĂ��ˋN��������}�C�N���v���[�g�̊W�𗘗p���A���̃y�O�Ƀo�C�I�t�B�����������Ă���A���ɂ��̃y�O�����������ɓ���Ĕ��������A���̌��ʂ肷����̂ł��� 17�j�i�} 5�j�B�����������@�ɂ��ۂ��t��������Ԃł̍R�ۊ������𑪒肷�邱�Ƃ��\�ɂȂ�A�u�ŏ��o�C�I�t�B���������Z�x�AMBEC�v�Ƃ��Ē�ʓI�ɕ]�����邱�Ƃ��ł���B���̕��@�𗘗p���Ė�܊������ł̍R�ۊ����𑪒肵�����݂��� 20, 21�j�B�܂��A�y�O�̍ގ���ς��ăo�C�I�t�B�����������ACV �@�ɂ�苟���ۂ̕t���������������邱�Ƃ��e�Ղł���B����ɁA�W�����O�����X�̃y�O�ɂ��đ����^�d�q�������⋤�œ_���[�U�[�������ɂ��o�C�I�t�B�����\���̉�͂��ł��� 22�j�B������� 96 ���̃v���[�g���Ŏ����ł��邱�Ƃ���A�|�n���ܓ��̏�����ς��Čo���I�Ƀo�C�I�t�B�����\���̊ώ@��ې��̒�ʂ��\�ł���B
7.3 ���W�I�l�����ۂ̎����I�o�C�I�t�B�����`������
�@�ߔN�A�������Ȃǂ������Ƃ��Čċz��n�̓��a�������ǂł��郌�W�I�l���ǂ̔������e�n�ŕ���A4 �ފ����ǂł���{�����ǂ̕����͔N�� 1,500 �����Ă���A���Ґ��͖��N�����X���ł��� 23�j�B
�@���W�I�l�����ۂ́A�����A�y�뒆�ɐ������Ă���Ƃ����A����炪�l�H�I�Ȑ����ɐN�����A�����ő��B�������W�I�l�����ۂ��q�g�֔j�����i��C�����j����ƍl�����Ă��� 24�j�B�����������W�I�l���ǂ̊����o�H����A���̊������ƂȂ鐅���̏��ł��d�v�ł���ƍl�����Ă���B�������A���������̏��ł����ł͈ꎞ�I�Ȃ��̂ɉ߂����A���{�I�ȑ�ɂ͂Ȃ�Ȃ��B�����ŁA“���W�I�l�����ۂ̂��݂�”�ƂȂ�o�C�I�t�B�������������邱�Ƃ����W�I�l���Ǒ�Ƃ��ĕK�{�ł��� 25�j�B
�@����܂� Legionella pneumophila �ɑ���E�ۍܓ��̌��ʂ�]������ɂ́A�זE�V��������Ԃł̐ڐG�ɂ������n���p�����Ă��� 26�j�A�t����Ԃł̕]���n�͊m������Ă��Ȃ������B�����ŁAL. pneumophila ��S�̂ɕt���������܂܂̏�ԂŎE�ی��ʂ�]�����邱�Ƃ��ŏI�ړI�Ƃ��āA���ȗ̈�Ȃǂ̌����ŗp�����Ă��� Calgary Biofilm Device 19�j��p���� MBEC �i�ŏ��o�C�I�t�B���������Z�x�jassay �ɒ��ڂ��A�{�ۂ̃o�C�I�t�B�������`�������邽�߂̏����ɂ��Ċ�b�I�������s���� 27�j�B�܂��A�������̕]�����@�Ƃ��āA�]���͐��ې��̑����d�q�������ɂ��t����Ԃ̔�r�ł��������A����́A�����m���w�������ɂ���ĊJ�����ꂽ WST �@ 28, 29�j�ɂ�� Biofilm Viability Assay Kit ���g�p���A���̔�����Ԃ��m�F�����B
7.3.1 �����ޗ�
1�j�ۊ��F�������R�� L. pneumophila �����Q 1 �Q����� 3 �Q�̊e 1 ��
2�j���۔|�n�FBCYEα �t�̔|�n�i������������w�������j
3�j�y�O�t���W�FNunc-TSP�ANo. 445497
4�j�}�C�N���v���[�g�F96F Without Lid Si Microwell Plate�ANo. 269787�AThermo Fisher Scientific�ENunc A/S
5�j�������莎��FBiofilm Viability Assay Kit�iB603�j�i�����m���w�������j
7.3.2 �������@
1�j �o�C�I�t�B�����`�������@���ۊ��� BCYEα �t�̔|�n�� 37���A5 ���Ԕ|�{��A�}�C�N���v���[�g�̊e���� 200 μl �����������B����Ƀy�O�t���W������ 30���� 3 ���ԕt���������B�Ȃ��A���̎��̃y�O�͔������{���̃|���X�`�����A�����̓V���R�����H�������̂��g�p�����i�����m���w�������j�B���̌�A�V���� BCYEα �t�̔|�n�Ƀy�O�t���W���ړ������� 30�����邢�� 37���� 7 ���ԐÒu�����B
2�j �o�C�I�t�B�����Y���ʂ̑���iCrystal violet: CV �@�j��@�ɂ��o�C�I�t�B������ 0.5���N���X�^���o�C�I���b�g�t�Ő��F���A�ŋۏ������� 2 ���X���Ă��� 95���G�^�m�[���ŐF�f��n�o�����A�g�� 570 nm �� OD �l�𑪒肵���B
3�j �����������̑���iWater-soluble tetrazolium salt: WST �@�j L. pneumophila �����Q 1 �Q�̔|�{�ۉt����߂��� 2 ���̃}�C�N���v���[�g�� 200 μl �����������B���ɁA�d�l���ɏ������Ē������������ 20 μl ���Y�������B������ 30���� 37���ɂ��ꂼ����u���A2�A4�A6�A8�A24 ����� 48 ���Ԍ�ɔg�� 450 nm ��OD �l�𑪒肵���B
7.3.3 ���т���эl�@
1�j�o�C�I�t�B�����`���ʂ̔�r�i n �� 12�j
�@�ۊ��F
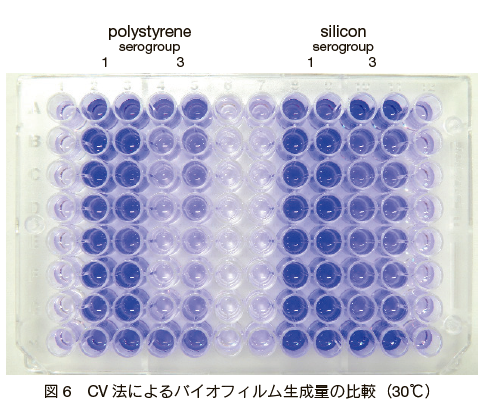
�V���R�����H�̒S�̂� 30���Ō`���������ꍇ�A1 �Q�� 2.043 ± 0.336 �ł��������A3 �Q�� 0.417 ± 0.155 �ƒႭ�A�� 5 �{�̍����������i�} 6�j�B���̂��Ƃ́A 1 �Q�� 3 �Q�ł͑��B���x�ɍ�������A�O�҂̕������B���x���������� BF �Y���ʂɔ��f�������̂ƍl����ꂽ�B
�A�S�́F
1 �Q�� 30���Ń|���X�`�����ƃV���R���Ɍ`���������ꍇ�A�O�҂ł� 1.458 ± 0.183 �ł��������A��҂ł� 2.043 ± 0.336 �ƌ�҂̕����ǍD�ł������i�} 6�j�B���̍����������邽�߂ɁA���S�̂̕\�ʂ𑖍��^�d�q�������Ŋm�F�����Ƃ���A�V���R���̕����X���[�X�ȕ\�ʂł������B�܂��A���f���͂̌��ʂł́A�|���X�`�����͒Y�f�݂̂ł������̂ɑ��A�V���R���͒Y�f�i45.7 Mass���j�A�_�f�i24.1 Mass���j�A�V���J�i11.3 Mass���j �Ȃǂ̕����ł���A�����������Ⴊ�S�̂ւ̕t���ɉe���������̂ƍl����ꂽ�B
�B�|�{���x�F
1 �Q���V���R�����H�Ŏ��������ꍇ�A37���ł� 0.999 ± 0.501 �ł��������A30���ł� 2.043 ± 0.336 �Ɩ� 2 �{�̋z���x�ł������B�ʏ�� L. pneumophila �̌����ł́A�|�{���x�� 37���ɐݒ肵�čs�����A���R���ł� 30���O��Ő������Ă��邱�Ƃ������A�����������x�ɑ��銴�� BF �Y���ʂ̑����ɊW�������̂Ɛ��@���ꂽ�B
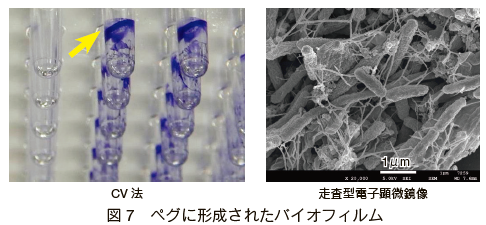
�@�ȏ�̌��ʂ���AL. pneumophila �̃o�C�I�t�B�����`���ɂ́A�����Q 1 �Q����p���A�V���R���̒S�̂� 30���A7 ���ԐÒu���邱�Ƃ��œK�����ƍl����ꂽ�B���̏����Ńy�O�Ɍ`�������{�ۂ̃o�C�I�t�B������ CV �@�Ƒ����^�d�q�������ɂ��m�F�����Ƃ���A�} 7 �̂悤�ɗǍD�ȕt����Ԃł���A����̎E�ۍܓ��̕]�������ɏ\���ɗ��p�ł�����̂ł������B
2�j�����������in �� 16�j
�@�} 8 �Ɏ������悤�ɁA1010 CFU/well �̋ۗʂŔ�r����ƁA 30���ł� 6 ���Ԍ�ōō��� 1.825 ± 0.031 �ɒB���A���̌�AOD �l�͏��X�Ɍ��������B����A37���ł́A8 ���Ԍ�ōō��� 2.227 ± 0.095 �ƂȂ�A30���̏ꍇ���킸���ɍ����z���x�ł������B���̂悤�ɁA L. pneumophila �̍זE������ WST �@�ŕ]�����邱�Ƃ��\�ł���A MBEC �̑���ɗ��p���邱�Ƃ��ł���Ɣ��f�����B�Ȃ��A�����̌��ʂ���A����� OD �l�̑���� 37���� 6 ���Ԍ�� 24 ���Ԍ�� 2 ����{���邱�Ƃ���{�Ƃ����B

8�D �o�C�I�t�B�����̌`���h�~�E����
�@����A�o�C�I�t�B�����̔����h�~�̃|�C���g�́A�ȉ��� 3 �_�ł��� 30�j�B��́A�ۂ̒S�̂ւ̕t���h�~�ł���B�o�C�I�t�B�����̌`���́A�ۂ��S�̂ɕt�����邱�Ƃ���X�^�[�g���邽�߁A�����h�~���邱�Ƃ͗��ɂ��Ȃ��Ă���B�������A�ۂ̕t���͒S�̂̕\�ʍ\���݂̂Ȃ炸�A�ۂƒS�̂Ƃ̕������w�I���݊W�Ȃǂɂ���ċN���邽�߁A�ۂ̊������~���A�t����j�~���邱�Ƃ͊ȒP�ł͂Ȃ��B��ڂ́A�t���͗e�F�����Ƃ��āA���B�����Ȃ����Ƃł���B�ۂ��R���f�B�V���j���O�t�B�����ɕt�����������ł̓o�C�I�t�B�����͌`������Ȃ����A���B���ă}�C�N���R���j�[���`�����邱�ƂŐi�W����B�����ŁA�ۂ̑��B��}�����邽�߂ɁA�S�̕\�ʂ̐������c���Ȃ��������̔��z��A�S�̂ɍR�ې����������� 31�j���̍��邪�A�Ȃ��Ȃ������Ȃ��̂͂Ȃ��B�����ĎO�ڂ́A�o�C�I�t�B���������n���A�F�������O�̒i�K�ŕ����I�ɏ������邱�Ƃł��� 31�j�B�܂��ɐ��|�ł���B���|��ɎE�ۍܓ����g�p���Ď��̃}�C�N���R���j�[�̌`�����ł��邾���x�点�邱�Ƃ�����ł̓���ł��낤�B
�@2018 �N 3 ���ɔ��s���ꂽ���o�T�C�G���X�ɂ����āA�u�o�C�I�t�B������ގ�����A The War on Slime�v�Ƒ肷��L�����f�ڂ���Ă��� 32�j�B���̋L���́A�j���[���[�N�B����w�� Sauer �����������ꂽ���̂ł���A�ޏ��́A�r���K���g���E�o�C�I�t�B���������Z���^�[�ŕ������߁A���N�ɂ킽��o�C�I�t�B�����̌`����E���A�R�ۖ�ϐ��̃��J�j�Y���ɂ��Č������Ă���B���e�́A�����ɂ��ăo�C�I�t�B�������U�����邩�A���̐�p�ɂ��Ă܂Ƃ߂�ꂽ���̂ł���B�ޏ��͍Ō�Ɂu�����d�v�Ȗ��́A�o�C�I�t�B�������݂ȓ����ł͂Ȃ��_���v�Ǝw�E���A�o�C�I�t�B������̏d�v���ƁA��������S�ɐ��䂷�邱�Ƃ̓���Ɍ��y���Ă���B
8.1 �N�I�����Z���V���O�ɂ��o�C�I�t�B�����̌`���}��
�@�g�s�b�N�X�Ƃ��āA�r�c�Ə����ɂ��Љ��Ă��� Quorum-sensing ����Ɋ�Â��o�C�I�t�B�����`���}���ɂ��Ăӂ�� 33�j�B QS �͊��q�����Ƃ���A�זE�ԏ��`�B�@�\�ł��邪�A���ꂪ�o�C�I�t�B�����̌`���Ɋ֗^���Ă��邱�Ƃ����炩�ɂ���Ă����B�����ŁA���� QS �𐧌䂷�邱�Ƃɂ��o�C�I�t�B�����̌`����}�����悤�Ƃ����V������@�̊J���ł���B�ނ�́AQS �̃V�O�i�������� 1 ��ł���A�V�����z���Z�������N�g���iAHL�j�����y�f�ɂ��o�C�I�t�B�����̌`���j�Q�� AHL �\���ގ��̂ɂ��o�C�I�t�B�����̌`���j�Q�ɂ��Č������Ă��� 33�j�B
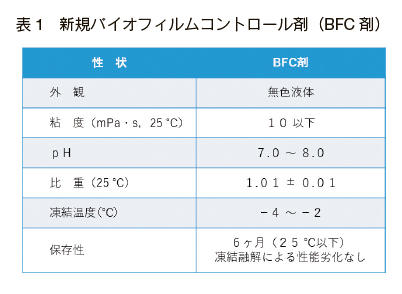
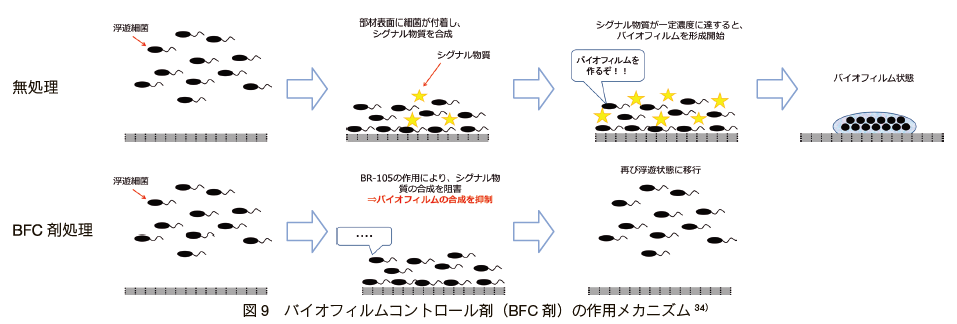
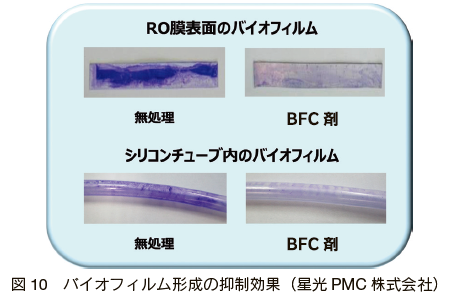
�@�܂��A�v�ۂƌ\���̉�� 34�j�ł́A�ۂ̍זE�ԃV�O�i���`�B������o�C�I�t�B�����`����j�Q��������Ŏ��p�I�ȕ����𗘗p�����V�K�o�C�I�t�B�����`���}���E�����܁i�o�C�I�t�B�����R���g���[���܁F BFC �܁j���J�����i�\ 1�j �ARO ���̃o�C�I�t�@�E�����O�̗}���ɂ��Č������Ă���B���� BFC �܂́A QS ��j�Q���ăo�C�I�t�B�����̌`����}�����镨���ƊE�ʊ����܂���Ƃ����o�C�I�t�B�����̔����ɗL���ȕ����̕����܂ł���B���̍�p�@�����} 9 �Ɏ������B���Ƃ��A����� RO ���ɗp����ƃo�C�I�t�@�E�����O��}�����i�} 10�j�A�����W���[���̐�������p�x��}���邱�Ƃ��ł����Ƃ��Ă��� 34�j�B
8.2 Legionella pneumophila �̃o�C�I�t�B������ɂ�����d���������f�_���ɂ�� 1 ��
�@�O�q�̂悤�ɁACalgary Biofilm Device ��p���Ď����I�Ƀ��W�I�l���ǂ̌����ۂł��� L. pneumophila �̃o�C�I�t�B�������`�������邱�Ƃ��ł����B�����ŁA���̎����n�ɂ��{�ۂ̃o�C�I�t�B�����ɑ���d���������f�_���̌`���j�Q�ƕs�����ɂ��Č������� 35�j�B
8.2.1 �����ޗ�
�@�d���������f�_���i�ȉ��A�d���������A���{�w���V�[�V�X�e������j����юs�̂̔��_���d�𐅁i���_���j��p���A�ΏƂƂ��Ď������f�_�i�g���E���n�t�i�ȉ��A�������A�x�m�t�C�����a������j���g�p�����B
8.2.2 �������@
1�j�o�C�I�t�B�����`���j�Q�����@
�@�������R�� L. pneumophila 1 �Q�̃o�C�I�t�B�����`���r���ɂ����āA�������ō܂� 30 ���ԐڐG�������̂��A�o�C�I�t�B�����`���ʂ� CV �@�ɂ�葪�肵���B
2�j �o�C�I�t�B�����s��������
�@�o�C�I�t�B�����`����ɋ������ō܂� 60 ���ԐڐG�������̂��AWST �@�ɂ������������𑪒肵���B
8.2.3 ����
1�j�o�C�I�t�B�����`���j�Q�in �� 24�j
�@�e OD �l�́A�d���������i13.2 mg/l�j�� 0.145 ± 0.064�A�������i11.8 mg/l�j�� 0.150 ± 0.065�A���_���d�𐅁i10.1 mg/l�j�� 0.451 ± 0.375 �̏��ł������B�Ȃ��A�������i�ΏƁj�� OD �l�́A2.579 ± 0.429 �ł������B
2�j�o�C�I�t�B�����ɂ�����s�����in �� 24�j
�@�e OD �l�́A�d���������i11.4 mg/l�j�� 0.563 ± 0.158�A���_���d�𐅁i10.3 mg/l�j�� 0.590 ± 0.129�A�������i12.0 mg/l�j�� 0.631 ± 0.215 �̏��ł������B�Ȃ��A�������i�ΏƁj�� OD �l�́A0.708 ± 0.253 �ł������B
�@���̂悤�ɁA�d���������� L. pneumophila �̃o�C�I�t�B�����ɑ��Č`���j�Q����ѕs�����ɗL�p�ł���ƍl����ꂽ�B
9�D ������
�@2019 �N 2 ������V�������W�I�l���ǂ̐f�f��u���{�e�X�g�@���W�I�l���v���s�̂���A�ی��_�����t�^���ꂽ�B����A���W�I�l���ǂ̓͏o�����͂���ɑ���������̂Ɨ\�z�����B�܂��A����ɔ����A����ł̃��W�I�l�����ۑ�w���߂��邱�ƂɂȂ�B�����ŏd�v�Ȃ��Ƃ́A�]���̐����ɕ��V���郌�W�I�l�����ۂ������E�ہE���ł���̂ł͕s�\���ł���A���́u���݂��v�ƂȂ�o�C�I�t�B�����K�{�ƂȂ�B
�@�T���āA�o�C�I�t�B�����̔����h�~�ɑ��������͂Ȃ��B���q�����Ƃ���A�o�C�I�t�B�����̓��C�t�T�C�N���ɂ���Č`������邽�߁A�����ł����̌`����摗�肷�邽�߂̓w�͂��K�v�ł���B���肪�l�X�Ȕ������̏W���̂ł��邾���Ƀo�C�I�t�B�����̔����𐧌䂷�邱�Ƃ͗e�Ղł͂Ȃ��A�������Ɛl�ԂƂ̉i���̉ۑ肩������Ȃ��B
�@�Ȃ��A�{�e�̓��e�́A�� 46 �z�����q���Ǘ��S�����̃V���|�W�E���ł̍u�����e�ɉ��M�������̂ł���B�܂��A���e�̈ꕔ�́A���łɓ��{�h�ۖhꀊw��� 45 ��N�����i�����j����ё� 35 ����{�������w���E�w�p�W��i�_�ސ�j�ɂ����Ĕ��\�����B
| [ ���҃v���t�B�[�� ] | |
| ���� | ���@�����@�iFURUHATA Katsunori�j |
|---|---|
| ���� | ���z��w�@�����E���Ȋw�� ��252-5201�@�_�ސ쌧���͌��s�����散��� 1-17-71 Tel �F 042-754-6215 Fax �F 042-754-6215 |
| �o�g�w�Z | �}�g��w��w�@�C�m�ے����Ȋw������ |
| �w�� | ���m�i�b��w�j |
| ��啪�� | ���������w�A���������Ԋw�A����������w |
| ���݂̌����e�[�} | �o�C�I�t�B������W�I�l���Ɋւ��錤�� |

