
マイトファジー:損傷ミトコンドリアの選択的分解
Mitophagy: Selective degradation of damaged mitochondria
 |
山野 晃史 公益財団法人 東京都医学総合研究所 生体分子先端研究分野 |
Abstract
The quality and quantity of mitochondria, the essential organelles that produce ATP and regulate many metabolic pathways, should be monitored to keep cell homeostasis. The two gene products mutated in the genetic recessive Parkinson's disease, Parkin and PINK1, have been identified as essential proteins to selectively degrade unhealthy mitochondria. Since this clearance process depends on both ubiquitin and autophagy, it is called ubiquitin-mediated mitophagy. In this review, I focus on a decade of significant progress how the mitochondrial kinase PINK1 and the E3 ligase Parkin work cooperatively to selectively mark and eliminate damaged mitochondria, and highlight the molecular crosstalk between ubiquitin and autophagy.
1. はじめに
ミトコンドリアは細胞のエネルギー通貨である ATP を合成するオルガネラとして知られているが、その他にも脂質代謝、アミノ酸合成、鉄硫黄クラスターの生合成も担っている。さらに細胞に必須のオルガネラとして、カルシウム貯蔵、アポトーシス誘導、ウイルス感染応答などのプラットフォームにもなっている。その一方で、ミトコンドリアは常にストレスに曝された危険なオルガネラであるとも言える。酸化的リン酸化の際に発生する活性酸素種(ROS)は、その代表例であるが、 ROS は DNA、脂質、タンパク質を攻撃するため、一度 ROS により損傷を受けたミトコンドリアは「不良」となり、酸化的リン酸化の悪循環を介した、更なる ROS の発生を招くなどして、細胞全体の恒常性を乱すと考えられる。 近年、このような細胞にとって有害となる不良ミトコンドリアは選択的に排除されることが分かってきた。 本稿では、細胞内の二大分解システムであるユビキチンとオートファジーが協調して働く、ミトコンドリア品質管理機構について、この 10 年あまりで明らかになったことを概説したい。
2. パーキンソン病(PD)
ミトコンドリアの多彩な機能のため、ミトコンドリアに対する品質管理機構の破綻は様々な病気の原因となりうる。特に本稿で取り上げる「オートファジーによる損傷ミトコンドリアの選択的分解」はパーキンソン病(PD)との関連が深いと考えられているため、まずパーキンソン病について簡単に説明したい。
パーキンソン病(PD)は、中脳・黒質のドーパミン作動性ニューロンが変性・脱落することで引き起こされる神経変性疾患である。 日本の人口の 1-2% に見られ、年齢とともに罹患率が高くなるため、超高齢化社会をむかえる我が国にとっては、その病態の理解と根本的な治療法の開発が急務となっている。 PD の主な症状は、静止時振戦、筋強剛、運動緩慢、姿勢保持障害などの運動障害であり、孤発性と家族性(遺伝性)に大別される。遺伝性の場合、正しくはパーキンソン症候群とするべきであるが、わかりやすさを優先して、本稿では遺伝性 PD と記述したい。孤発性 PD(PD 全体の 90%)と遺伝性 PD はその症状が完全に一致するわけではない。 しかし、それらの病因には共通項が存在すると考えられること、また遺伝性 PD は特定の遺伝子異常に由来することから、近年では遺伝性 PD から病因に迫ろうとする研究が盛んに行われている。
3. ミトコンドリア障害と PD の関係
Parkin と PINK1 は遺伝性 PD の原因遺伝子として同定された 1),2)。 どちらも遺伝性潜性の遺伝子であるため、その遺伝子産物である Parkin と PINK1 の機能破綻によって、PD を発症すると考えられる。 Parkin あるいは PINK1 をノックアウトしたショウジョウバエでは、精子細胞や飛翔筋のミトコンドリアに異常が見られた 3),4)。 そのため、 PD 発症とミトコンドリア機能には何らかの関連があると推測されていた。 また、合成麻薬の副産物である MPTP がミトコンドリア呼吸鎖を阻害し、急性 PD 様の症状を引き起こすこと、孤発性 PD の患者由来の細胞でもミトコンドリアの呼吸能の低下が認められた。 さらにミトコンドリア DNA の変異やその複製を担うポリメラーゼの変異も PD の発症リスクを高めることが知られていた。 これらの報告から、(遺伝性 PD の中でも特に) Parkin と PINK1 の機能破綻によって、ミトコンドリアは何らかの障害をきたし、それが原因となって、 PD を発症すると考えられる。しかし、長らくの間、 Parkin あるいは PINK1 がどのようにミトコンドリア障害とリンクしているか、分子レベルでの実体は不明であった。
4. Parkin と PINK1 によるマイトファジーの誘導
2008 年、アメリカ NIH の Richard Youle らのグループは、 Parkin を過剰発現させた培養細胞に CCCP(ミトコンドリアの膜電位を消失させるプロトンイオノフォア)を添加すると、24-48 時間後に、ほぼすべてのミトコンドリアがオートファジー依存的に分解されることを報告した 5)。この報告は、 1) Parkin は不良ミトコンドリアを選択的に分解することで、細胞の恒常性を維持していること、そして 2) Parkin の機能阻害により、不良ミトコンドリアが細胞に蓄積することが 、 PD 発症の本質であることを示唆していた。 実際のヒトの神経細胞で、ほとんどのミトコンドリアの膜電位が瞬時に消失して、オートファジーにより分解されるという極端な現象が起きているとは考えにくいが、非常に簡便な方法でマイトファジーを観察できることがわかった。 そのため、この報告をきっかけに、世界中の研究者がこの分野に参入し、 Parkin 依存性のマイトファジーの分子機構の理解は飛躍的に進んだ。実際、 2010 年には PINK1 が Parkin の上流で機能するマイトファジー必須因子であること 6-9)、 2013 年に Parkin の全長の X 線構造が解かれ 10)、 2014 年に PINK1 がユビキチンをリン酸化するキナーゼであること 11-13)、その後も損傷ミトコンドリアとオートファジーを橋渡しする分子の同定 14) など、マイトファジーに関連する論文の報告は後を絶たない。 では以下に、この 10 年あまりで明らかにされた Parkin と PINK1 の分子機構とマイトファジーの研究結果をまとめたい。 これらのほとんどは複数の研究グループからの報告であり、結論や解釈にも一定のコンセンサスが得られている。
まず PINK1 は、その N 末端にミトコンドリア移行シグナルを有するセリン・スレオニンのキナーゼである。そのため、サイトゾルのリボソームで合成されると、速やかにミトコンドリアに移行する(図 1A)。 そして、ミトコンドリアの外膜と内膜に存在する膜透過装置(TOM および TIM23 複合体)の孔を通過して、内膜に到達する。 そこで、マトリクスおよび内膜に局在するプロテアーゼ(MPP と PARL)によって切断をうける 15-17)。 そして、切断をうけた PINK1 はサイトゾルに逆行輸送され、プロテアソームで分解される 18)。この分解は N 末端則とよばれる極めて半減期の短いシステムで制御されている。 そのため、通常の細胞では PINK1 は合成されても、キナーゼとして機能するまえに、分解されてしまう。ウエスタンブロッティングでも検出困難なレベルにまで発現が抑制されている。
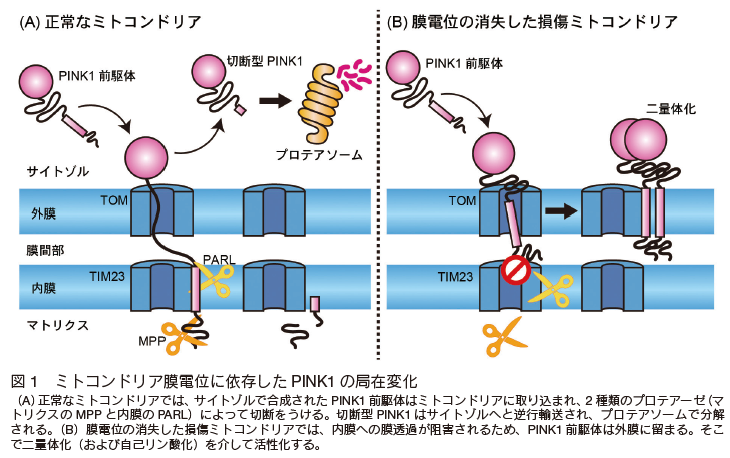
一方、 Parkin は通常、サイトゾルに局在する E3 ユビキチンリガーゼである。 一般的に E3 は、基質となるタンパク質にユビキチンを付加するユビキチン化反応の最終酵素であり、ユビキチンが付加されたタンパク質はプロテアソーム(あるいはオートファジー)で分解される。 つまり、 Parkin は基質タンパク質を分解へと誘導する実行因子であると言える。 しかし、培養細胞に Parkin を過剰発現させても、リガーゼ活性がオフの状態でサイトゾルに一様に局在し、ミトコンドリアとの関連は見出すことができない。
しかし、これらの状況はミトコンドリアの膜電位を消失させることで一変する。 まず、ミトコンドリアの膜電位が消失すると PINK1 はミトコンドリアの外膜に蓄積する(図 1B)。 ミトコンドリアタンパク質の(マトリクスおよび内膜への)輸送は、膜電位を駆動力としている。 つまり、膜電位の消失した損傷ミトコンドリアでは PINK1 は内膜へと到達できず、PARL による切断をうけない。 このため、サイトゾルへの逆行輸送もプロテアソームによる分解も阻害される。 その代わりに PINK1 はその局在を外膜へと変化させる。 さらに PINK1 は外膜上で二量体化し、自己リン酸化を介して活性化することもわかっている 19-21)。したがって、外膜上で活性化した PINK1 は、ミトコンドリアの「不良」を Parkin に伝えるセンサー分子として機能する。
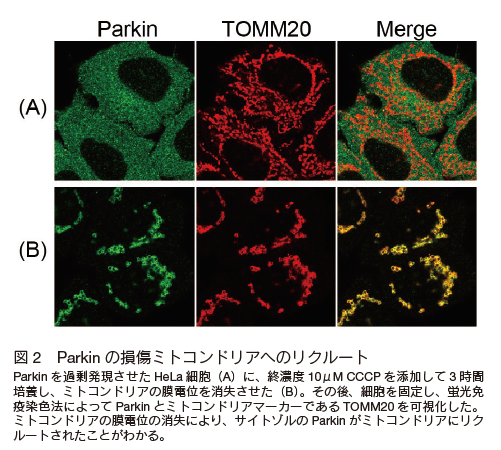
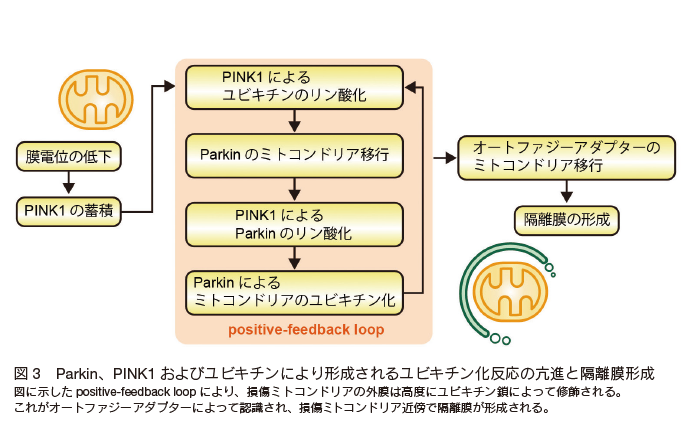
サイトゾルに局在している Parkin はミトコンドリア膜電位の消失に伴い、そこへリクルートする(図 2)。顕微鏡で観察するとダイナミックな Parkin の局在変化に驚かされる。なぜ Parkin が膜電位の消失したミトコンドリアにのみ選択的にリクルートするか?についても精力的に研究が展開されてきた。 まず、 Parkin のミトコンドリアへのリクルートは PINK1 のノックアウト細胞で完全に阻害される。 そのため、 PINK1 キナーゼの基質が Parkin のミトコンドリア移行の鍵を握っていると考えられた。 2010 年以降、世界中のグループが Parkin のミトコンドリア移行に必須となる PINK1 の基質を探索した。そして 2012 年から 2014 年にかけて、その基質が Parkin 自身 22-24) とユビキチン 11-13) であることが判明した。 Parkin の N 末端にはユビキチンに類似したドメインが存在し 、PINK1 はそのドメインの 65 番目のセリンをリン酸化する。 さらにユビキチンにも 65 番目のセリンは保存されており、やはり PINK1 によってリン酸化される。特にユビキチンのリン酸化に関しては、マイトファジーの研究分野を超えて、分子細胞学全般に大きなインパクトを与えた。 本来、ユビキチンはタンパク質性の翻訳後修飾因子であるが、それ自体がリン酸化という翻訳後修飾を受けること、つまり「翻訳後修飾因子の翻訳後修飾」というシグナルの多様性が判明したためである。 現在では、生化学および構造生物学による解析から、 PINK1 によってリン酸化されたユビキチン(リン酸化ユビキチン)は Parkin のミトコンドリア移行へのレセプター分子として機能し 25)、 Parkin のユビキチン様ドメインが PINK1 によってリン酸化されると、 Parkin のリガーゼ活性が劇的に上昇すること 26-28) が証明されている。したがって、ミトコンドリアの膜電位が消失すると、 PINK1、 Parkin およびユビキチンが、損傷ミトコンドリア上で正のフィードバックループを形成し 29)、そこに大量のユビキチン鎖が形成される(図 3)30)。
5. オートファジーの誘導と隔離膜形成
マイトファジーを誘導すると、その近傍で隔離膜と呼ばれる膜構造が出現する。 隔離膜は損傷ミトコンドリアに沿って伸長し、最終的にオートファゴソームと呼ばれる閉じた膜構造となり損傷ミトコンドリアは特異的に包囲される。 その後、オートファゴソームは、分解専用のオルガネラであるリソソームと融合し、損傷ミトコンドリアは分解される。オートファジーに必須のタンパク質は、酵母からヒトまで進化的によく保存されている。 それらはいくつかの機能ユニットに分けられるが、本稿では ATG8 ファミリーについて紹介したい。 ATG8 はそれ自体が隔離膜の脂質分子であるホスファチジルエタノールアミンと共有結合するため 、ATG8 は隔離膜にも完成したオートファゴソームにも常在するオートファジータンパク質である。 そして、 ATG8 と相互作用するタンパク質(あるいはオルガネラ)は、より効率的にオートファゴソームに包囲される分解基質となるはずである。ほ乳類には酵母 ATG8 のホモログが 6 種類あるため、基質認識の多様性が生み出されているのかもしれない。
前述のように、損傷ミトコンドリアには、 Parkin によって大量のユビキチン鎖が付加される。 ATG8 は直接ユビキチン鎖と相互作用できないが、オートファジーアダプターとよばれる分子群がオートファジーとユビキチン鎖を橋渡しする役割をもっている。ほ乳類には 5 種類のオートファジーアダプターが同定されているが、それらはすべて分子内にユビキチン結合ドメインと ATG8 結合領域を有している。 このような作用機序によって、ユビキチン鎖で修飾された損傷ミトコンドリアはオートファジーアダプターを介してオートファゴソームに選択的に取り込まれる。
これまでユビキチン鎖は、その基質をプロテアソーム分解へと導く目印であると考えられてきたが、オルガネラに大量にユビキチン鎖が付加された場合、オートファジー膜形成場の目印にもなっていることは注目すべきことである。
6. おわりに
Parkin 依存性のマイトファジーは膜電位の低下したミトコンドリアを「不良」と見なし、それを選択的に分解する巧妙な品質管理機構である。 Parkin および PINK1 は遺伝性 PD の原因遺伝子産物であるため、マイトファジーは神経科学や臨床医学からも注目されている。 このような競争的背景もあり、マイトファジーはこの 10 年あまりで、その理解が飛躍的に進み、今や一つの研究分野となりつつある。本稿では生化学・細胞生物学から得られた知見を中心に紹介させていただいたが、動物個体を用いた生理学的意義解明の研究も盛んに行なわれている。 スペースの都合上、動物個体を含む多くの重要なトピックについて本稿で紹介できなかったことをお詫びしたい。 また、マイトファジーについて詳細に知りたい方は、より専門的な英文総説を参照されたい 31-32)。
| [ 著者プロフィール ] | |
| 氏名 | 山野 晃史(Koji Yamano) |
|---|---|
| 所属 | 公益財団法人 東京都医学総合研究所 生体分子先端研究分野 〒 156-8506 東京都世田谷区上北沢 2-1-6 Tel : 03-5316-3123 |
| 出身学校 | 名古屋大学大学院理学研究科 |
| 学位 | 博士(理学) |
| 専門分野 | 細胞生物学、ミトコンドリア学 |
| 現在の研究テーマ | ユビキチン、オートファジーを介したミトコンドリア品質管理機構の解明 |

