|
| トップページ > 自己組織化単分子膜作製用試薬 |
 |
||||||||||||||||||||||||||||||||||||||||
自己組織化単分子膜作製用試薬
|
| 品名 | 容量 | 希望納入価格(¥) | メーカーコード |
|---|---|---|---|
| 10-CDPA | 10 mg 100 mg |
11,000 30,000 |
C490 |
| FHPA | 10 mg 100 mg |
9,800 28,000 |
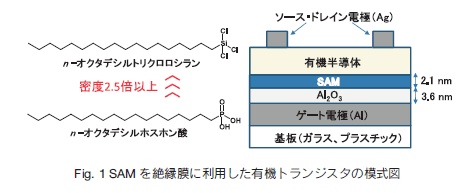
F340 |
| FOPA | 10 mg 100 mg |
9,800 28,000 |
F329 |
| FDPA | 10 mg 100 mg |
13,000 36,000 |
F330 |
| 11-HUPA | 10 mg 100 mg |
11,000 30,000 |
H399 |
| 11-NUPA | 10 mg 100 mg |
11,000 30,000 |
N468 |
| M-EG3-UPA | 10 mg 100 mg |
13,800 38,200 |
M457 |
| ODPA | 10 mg 100 mg |
11,000 30,000 |
O407 |
| 11-PIUPA | 10 mg 100 mg |
11,000 30,000 |
P463 |
参考文献
1) (a)T. A. Lewington, M. R. Alexander, G. E. Thompson and E. McAlpine, Surf. Eng., 2002, 18(3), 228. (b)T. Hauffman, O. Blajiev, J. Snauwaert, C. van Haesendonck, A. Hubin and H. Terryn, Langmuir, 2008, 24(23), 13450.
2) (a)B. M. Silverman, K. A. Wieghaus and J. Schwartz, Langmuir, 2005, 21(1), 225. (b)G. Zorn, I. Gotman, E. Y. Gutmanas, R. Adadi, G. Salitra and C. N. Sukenik, Chem. Mater., 2005, 17(16), 4218. (c)E. S. Gawalt, G. Lu, S. L. Bernasek and J. Schwartz, Langmuir, 1999, 15(26), 8929.
3) W. Gao and L. Reven, Langmuir, 1995, 11(6), 1860.
4) (a)E. L. Hanson, J. Schwartz, B. Nickel, N. Koch and M. F. Danisman, J. Am. Chem. Soc., 2003, 125(51), 16074. (b)M. Dubey, I. Gouzman, S. L. Bernasek and J. Schwartz, Langmuir, 2006, 22(10), 4649. (c)I. Gouzman, M. Dubey, M. D. Carolus, J. Schwartz and S. L. Bernasek, Surf. Sci., 2006, 600(4), 773.
5) J. T. Woodward, A. Ulman and D. K. Schwartz, Langmuir, 1996, 12(15), 3626.
6) A. Raman, M. Dubey, I. Gouzman and E. S. Gawalt, Langmuir, 2006, 22, 6469.
7) R. Quinones and E. S. Gawalt, Langmuir, 2008, 24, 10858.
8) S. C. D'Andrea and Al. Y. Fadeev, Langmuir, 2003, 19, 7904.
9) Y. T. Tao, C. Y. Huang, D. R. Chiou and L. J. Chens, Langmuir, 2002, 18, 8400.
10) B. Zhang, T. Kong, W. Xu, R. Su, Y. Gao and G. Cheng, Langmuir, 2010, 26(6), 4514.
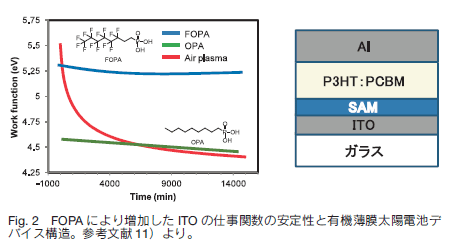
11) A. Sharma, B. Kippelen, P. J. Hotchkiss and S. R. Marder, Appl. Phys. Lett., 2008, 93, 163308.
12) A. Pulsipher, N. P. Westcott, W. Luo and M. N. Yousaf, J. Am. Chem. Soc., 2009, 131(22), 7626.
13) a)H. Klauk, U. Zschieschang, J. Pflaum and M. Halik, Nature, 2007, 445, 745. b)T. Sekitani, Y. Noguchi, U. Zschieschang, H. Klauk and T. Someya, Proc. Natl. Acad. Sci. USA, 2008, 105, 4976.
14) C. A. Traina, A. Christopher and J. Schwartz, Langmuir, 2007, 23(18), 9158.
| Copyright(c) 1996-2012 DOJINDO LABORATORIES, ALL Rights Reserved. |