�����͊w�Ö@�Ŕ��������d���_�f�̎��o���̂��߂̌u���v���[�u Si-DMA �̊J��
Development of Si-DMA as the Fluorescence Probe to Visualize Singlet Oxygen during Photodynamic Therapy
 |
���@���� ����w�Y�ƉȊw������ ��N���q���w���� ���C���� |
 |
���ˁ@�� ����w�Y�ƉȊw������ ��N���q���w���� ����w��w�@�H�w������ �y���� |
 |
�^���@�N�N ����w�Y�ƉȊw������ ��N���q���w���� ����w��w�@�H�w������ ���� |
Abstract
�@Photodynamic therapy (PDT) is a therapeutic treatment using light and photosensitizer, which generates cytotoxic substances by light irradiation. Singlet oxygen (1O2), a reactive oxygen species generated by photosensitizer in thet riplet excited state, plays a key role in cytotoxicity of PDT. Thus, understanding the behavior of intracellular 1O2 is important in order to elucidate molecular mechanism and improve therapeutic efficacy of PDT. In this review, how to develop a fluorescence probe for visualization of intracellular 1O2 during PDT is illustrated with a brief introduction of photoinduced electron transfer (PET).
1�D �͂��߂�
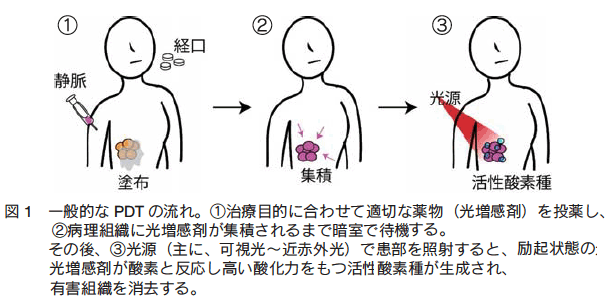
�@�����͊w�Ö@�iPhotodynamic therapy�APDT�j�́A����N�ɂ���Ċ����_�f�������i���������܁j�𓊗^���A����̂悤�ȑ̓��̗L�Q�g�D����ъ����ǁA�畆�a�Ȃǂ̎��a�����Â�����@�ł���i�} 1�j�B���𗘗p����l�X�Ȏ��Ö@�ɔ�ׁA�_�f���݉��ŗ�N��Ԃ̌������܂��������銈���_�f�킪�A�������\������זE�̍זE���������炷�Ƃ������Ë@�\�� PDT �̓����ł��� 1)�B�������܂Ƃ��āA��d���_�f�iSinglet oxygen�A1O2 �j������L�@�������i��A�|���t�B�����U���̂ȂǁA�} 2�j��_�f���W�J�������閳�@�ޗ��i��ATiO2�Ȃǂ̔����́A��N�Ɏ��O�����K�v�ł���ꍇ�������A��Ɍ��E�ۂɎg�p�j�Ȃǂ��g���Ă���B
�@PDT�́A���Ë@�\�ɂ���ă^�C�v�T�ƇU�ɕ��ނ����B���̒�`�́A��������ɂ���đ����قȂ邪 2�C3)�A��ʓI�ɁA�������܂ɂ���čŏ��ɐ�������銈���_�f�킪�_�f���W�J���� 1O2 ���ɂ���āA�O�҂��^�C�v �T�A��҂��^�C�v �U �ƌĂ��B�܂��A���̕��q���W�J�������������ꍇ������A�^�C�v �T �ɕ��ނ����B ���݁AFDA�i�A�����J�H�i���i�ǁj�ɂ���Č�����Ă��� Photofrin�iPorfimer sodium�j�A5- �A�~�m���u�����_�i5-ALA�A�} 2c�j�Ȃǂ̖̑����́A�|���t�B�����U���̂��������܂Ƃ��ē����Ă���B���������āA��Ì���ł͊����_�f�킪 1O2 �ł���^�C�v �U �Ɋ�Â��� PDT ���嗬�ł���B
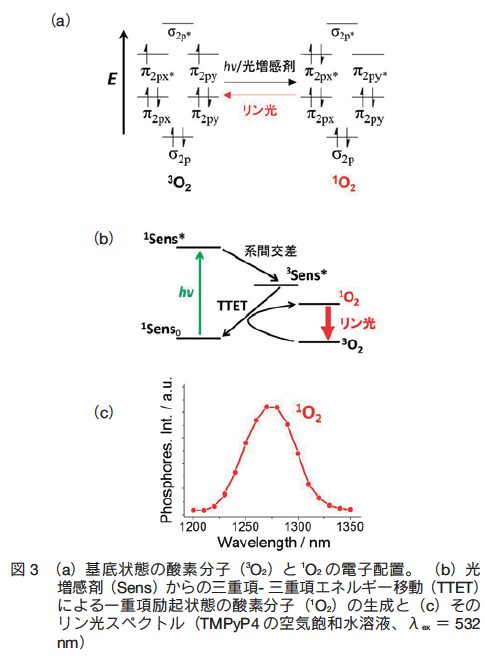
�@��X�́A�^�C�v �U �̎��Ë@�\�ɂ����čł��d�v�Ȗ������ʂ��� 1O2 �ɒ��ڂ����B 1O2 �Ƃ́A���O�̒ʂ��d����Ԃ̃X�s����L�����N��Ԃ̎_�f���q�ł���A���ӕ��q�̎_��������U�N���邱�Ƃ��ł���i�} 3a�j3)�B�X�[�p�[�I�L�V�h�iO2 �E�|�j�A�q�h���L�V���W�J���i�EOH�j�̂悤�Ȏ_�f���W�J�����d�q�ړ������ɂ���Ĕ�������̂ɑ��A1O2 �͎O�d����N��Ԃ̌������܂ƎO�d������Ԃ̎_�f���q�Ԃ̃G�l���M�[�ړ��i�O�d���|�O�d���G�l���M�[�ړ������ATriplet-triplet energy transfer�ATTET�j���甭������i�} 3b�j�B����A�����_�f��Ԃ̘A�������iHaber-Weiss �����AH2O2�{O2 �E�| �� 1O2 �{�EOH�{ �| OH�j�ɂ���� 1O2 ����������\��������B�������A�l�X�Ȑ��̕��q�����݂����Ă���זE�����ŁA���̂悤�Ȋ����_�f��Ԃ̓�������Ĕ������� 1O2 �͋ɂ߂ď��ʂł���ƍl������B
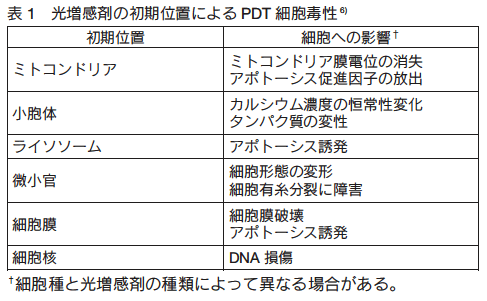
�@1O2 �͐����ŒZ�������i�� 3 ��s�j�������AEinstein ���A�� x2���� 2Dt�ix�AD�At �͂��ꂼ�ꕨ���̊g�U�����A�g�U�W���A�g�U���镨���̎����j����A���S nm ���x�܂Ŋg�U���邱�Ƃ��\�z����� 4)�B����ɁALinker ������́A�n�}�ɂ��1O2 �̎������x�������قǁA�g�U�ɂ�鎩�R���������A1O2 �����ӕ��q�Ƃ̎_���������N�����m�����������邱�Ƃ𖾂炩�ɂ��� 5�j�B�܂�A1O2 ���}���Ɏ������鐅���ikd�� 3.2 �~ 105s �| 1�j�ł́AEinstein ���Ōv�Z�����ő�g�U�����i1O2 �̎������z���l�����A�� 100 �` 300 nm�j���͂邩�ɋ߂��ɑ��݂��鐶�̕��q�i���\ nm �͈̔́j�̂�1O2 �Ǝ_���������N���邱�Ƃ���������B����āA�������܂̏����ʒu�� PDT �̍זE���ߒ��ɂ����čł��d�v�ł���ƍl������i�\ 1�j 6)�B
�@�������Ȃ���A���\�`���S nm ���x�g�U���Č������� 1O2 ���A���ӂ̐��̕��q�ɑ��Ăǂ̂悤�ȉ��w������U�N���A�� 20 ��m �ɒB����זE�S�̂ɕω����y�ڂ��̂��ɂ��Ă͂܂��𖾂���Ă��Ȃ��B���ɁA1O2 ���U�N���鏉���̐��̕��q�̎_���������𖾂��邽�߂ɂ́A�זE�� 1O2 �̐�������ъg�U�������Ԏ��o������Z�p���K�v�s���ł���B
�@�@�@2�D 1O2 �̌��o���@
�@�ł����ړI�� 1O2 �̓��I�������ϑ�������@�́A1O2 �̎��ԕ�������������ł���i�} 3c�j 7�j�B�������A�ߐԊO���̈�ł��� 1270 nm �t�߂� 1O2 �̃��������ϑ����邽�߂ɂ́A�����ȍ����x�ԊO���̈挟�o�킪�K�v�ł���B����ɁA���� 1O2 �������̋��x�͔��Ɏア���߁A���̐����� 2 �������Ƃ��Ċϑ�����ہA���������x������H�v�����Ȃ���Ȃ�Ȃ��B�Ⴆ�A�����������������Ȃ�d���̔|�{�����ŁA5 �b�̘I�����Ԃ���� 1 �זE���x���� 1O2 ���������o�������Ⴊ����8�j�B�������A�d���œ���ꂽ���ʂɊ�Â��Đ��̌��ۂ��𖾂��邱�Ƃ͍���ł���B�܂��A�זE���ł� 1O2 �̋����𗝉����邽�߂ɂ́A0.1 s �ȉ��ŁA�����튯���x���̎���ԕ���\�ł� 1O2 �̎��o�����K�v�ł���B
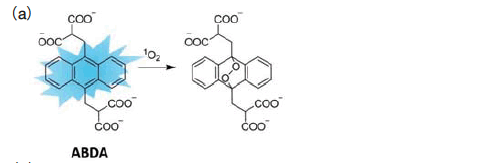
�@ ���ȕւ� 1O2 �����o���邽�߁A1O2 �ƑI��I�ɔ������鉻�������g�p������@������i�} 4�j�B 1O2 �́ASchenck-ene �����A�t���������Ȃǂ̓Ɠ��Ȏ_��������U�N���邽�߁A�A���g���Z���i�} 5a�j�A�x���]�t�����i�} 5 b�j�Ȃǂ� 1O2 ��I��I�ɕߑ����鉻�����Ƃ��Ēm���Ă���B�����̖F�������q�̋z���x����ьu�����x�́A1O2 �Ƃ̔����ɂ���Č������i�} 4a�j�A���̕ω��ʂ��� 1O2 �����ʂ�����ʓI�ɑ��肷�邱�Ƃ��\�ł���B�܂��A1O2 �Ƃ̔����ɂ���ă��W�J����ɂȂ鉻�����i2,2,6,6-tetramethylpiperidine�ATEMP�A�} 5c�j���g�p���A�d�q�X�s�����@�iElectron spin resonance�AESR�j��p���Č��o������@������B
�@�@
�@1999 �N�A�u���F�f�Ə����܂�g�ݍ��킹�� 1O2 �u���v���[�u�������w�����Ȃ̒��싳����ɂ���Ē�Ă��ꂽ�i�} 5d�j 9�j�B�u���F�f�Ƃ��ăt���I���Z�C���A�����܂Ƃ��ăA���g���Z���U���̂�p���A�ΐF���Ńt���I���Z�C����I��I�Ɍ���N����ƁA�A���g���Z�����ʂ���t���I���Z�C���ւ̓d�q�ړ����N����A�u�������������B�]���̗L�@���q�v���[�u�Ɣ�ׂĐi�������_�́A1O2 �̌��o�ɂ���Ču�����x����������̂ł͂Ȃ��A�u�����x�̑������B���ł������Ƃł���i�} 4b�j�B���̂悤�Ȍu���I���^�̃v���[�u�̏ꍇ�A��菭�ʂ̃^�[�Q�b�g�����̌��o���\�ł���B���͂ł��̌u���v���[�u�̋쓮�����ƂȂ���U�N�d�q�ړ��ɂ��ĊȒP�ɏЉ��B�@
�@�@�R�D���U�N�d�q�ړ� �iPhotoinduced electron transfer�APET�j
�@PET �Ƃ́A����N�ɂ���ėU�N�����d�q�ړ������ł��� 10�j�B����N�̑ΏۂƂȂ锭�F�c������N����ƁA��̓d�q�������G�l���M�[�̕��q�O���ɑJ�ڂ�����N��ԂɂȂ�B�����Ŕ��F�c�́A���q�Ԃ̃G�l���M�[���ʂƂ̊W�ɂ��d�q�A�N�Z�v�^�[�i��d�q�_���܁j�ɂȂ邱�Ƃ�����i�} 6a�j�A�܂��A�d�q�h�i�[�i��d�q�Ҍ��܁j�ɂȂ邱�Ƃ�����i�} 6b�j�BPET ���N���锽�����x�́A�}�[�J�X���_�ɏ]���A�d�q�ړ������̎��R�G�l���M�[�ω��i��G�j�ɑ傫���ˑ�����B PET ����G �� Rehm-Weller ���A��G �� ED/D�{ �| EA/A�|�| E0,0 �| Ec�iED/D�{�AEA/A�|�AE0,0�AEc �͂��ꂼ��h�i�[�̎_���d�ʁA�A�N�Z�v�^�[�̊Ҍ��d�ʁA��N����锭�F�c�̗�N��Ԃ̃G�l���M�[�A�N�[�����G�l���M�[�j����v�Z�ł��A�d�q�h�i�[�Ɠd�q�A�N�Z�v�^�[�̎_���Ҍ��d�ʂ̍��A���ӗn�}�̋ɐ��A�d�q�h�i�[�ƃA�N�Z�v�^�[�Ƃ̊Ԃ̋����Ȃǂ� PET �̔������x�����߂�d�v�Ȉ��q�ł���B
�@�u���v���[�u�̃I���I�t���傫�����邽�߁A�I����Ԃ̌u���ʎq�����iФfl�j���ő�ɁA�܂��́A�I�t��Ԃ� Фfl
���ŏ��ɂ��邱�Ƃ��K�v�ł���B�����ŁAФfl�� kfl /�ikfl�{ knr�j�ikfl�Aknr �͂��ꂼ���t�ˑJ�ځi�u���j���x�A���t�ˑJ�ڑ��x�j����l���Ă݂�ƁA��ʓI�Ȍu���F�f�̌u�������iτfl�� 1/ �ikfl�{ knr�j�j�ł��鐔�i�m�b���������Ȗ��t�ˎ����ߒ��ł��镪�q�� PET ���N����ƁA���Â��I�t��Ԃ̃v���[�u��v�ł���B
DMAX �̏ꍇ�i�} 5d�j�A�u���F�f��ΐF���ŗ�N����ƁA�d�q�A�N�Z�v�^�[���̍����t���I���Z�C���̈�d����N��Ԃ��������A�A���g���Z���� HOMO�iHighest occupied molecular orbital�j����t���I���Z�C���� HOMO �ɕ��q�� PET ���N����i�} 6a�j�B���������āA�t���I���Z�C���̈�d����N��Ԃ͌u�������ɂ���Ď������ꂸ�A�A���g���Z������̓d�q�ړ��ɂ��d�ו�����Ԃ̐����ɂ�荂���Ɏ������� 11�j�B����A�A���g���Z���� 1O2 �Ɣ������G���h�y���I�L�V�h������ƁA���̓d�q�h�i�[�����ቺ���A��d����N��Ԃ̃t���I���Z�C���ւ̓d�q�ړ����N����Ȃ��B���̂��߁A1O2 �����݂���ہADMAX �� Фfl ���� 0.02 ���� 0.81 �ɑ�������Ɛ�������Ă��� 9�j�B
�S�D�P�C�f���[�_�~��-�A���g���Z���_�C�A�h��p�����זE�� 1O2 �u���v���[�u�̕��q�v
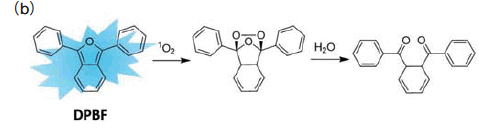
�@1O2 �̌��o�̂��߂Ɏg���邱���̉������i�} 5�j�́A�זE�����̗p�r�ŊJ������Ă�����̂ł͂Ȃ����߁A�זE���ߐ���L���Ȃ��A�܂��́A�זE���Ŕ����ȏꏊ����F���邱�Ƃ��m���Ă���B���������āA��X�� PDT ���Ŕ������� 1O2 ���זE���Ŏ��o���ł���u���v���[�u�̊J���ɒ��肵���B���̕��q�v�ɂ����āA���Ȍu�������Ȃ����ԐF�`�ߐԊO���ŗ�N�\�ȐF�f�A�D�ꂽ�זE���ߐ���L���镪�q�\���A1O2 �ƑI��I�ɔ�������ߑ����ʂ̓����� 3 �_���l�������B
�@���̃C���[�W���O�ɂ����Đ`�ΐF�̗�N������莋����Ă��闝�R�́A�זE�̓��������F�c�i��A�|���t�B�����A�t���r���A�ꕔ�̃A�~�m�_�Ȃǁj����̎��Ȍu����U�N���邽�߂ł���B���Ȍu������������ꍇ�A�u���v���[�u����̐M���Ƃ̋�ʂ�����ł���B����āA�זE���튯���x���� 1O2 �����̎��o�����������邽�߂ɂ́A���������F�c����̎��Ȍu�����}�������ԐF�`�ߐԊO�̈�ɋz���т����u���v���[�u�𗘗p���邱�Ƃ��K�v�ł���B�ԐF�`�ߐԊO�����z������є�������L�@�u���F�f�Ƃ��� Cy5�ACy7�A�e�L�T�X���b�h�A���[�_�~�� 800�AAza-BODIPY �Ȃǂ��g�p����Ă���B����ɁAФfl �̑傫���ikfl ���傫���Aknr ���������j�u���F�f���v���[�u�ɗp����ƁA��荂���������̃I����Ԃ̃v���[�u���v�ł���B����A�n�Ԍ������o�Ď��犈���_�f�������u���F�f��A���Ȏ_������ސF���₷���u���F�f�́A�����_�f��̌u���v���[�u�̔��F�c�Ƃ��đ��������Ȃ��B
�@��X�́A�F�f�̌����萫�A���w�I�����A�F�f���q�̑傫���i��ʓI�ɁAπ �d�q�����n���傫���Ȃ�قNjz���т����g���V�t�g���邪�A�זE���ߐ��Ɛ��n�����ቺ����j�Ȃǂ̗v�f���l�����A�P�C�f���[�_�~���iSiR�j��I�BSiR�Ƃ́A���[�_�~���F�f�̎_�f���W���`���V�����ɒu�����ꂽ���[�_�~���U���̂̂��i�} 7a�j�A���������������@�Ain vivo �C���[�W���O�Ȃǂ̌u���F�f�Ƃ��Ă悭�g���Ă��� 12�j�BSi �̒Ⴂ LUMO�iLowest unoccupied molecular orbital�j�G�l���M�[���ʂɂ��A�ގ��̉��w�\����L����e�g�����`�����[�_�~���ɔ�ׂĖ� 100 nm ���g���V�t�g�����z���т������i�\ 2�j�B����ɁA���[�_�~���n�̐F�f�� �{ 1 �̐����d�ׂƓK�x�̎��n���������Ă��邽�߁A�זE���̃~�g�R���h���A��I��I�ɐ��F�ł���Ƃ��������_������B
�@�A���g���Z���U���̂� 1O2 ��I��I�ɕߑ����邱�Ƃ𗘗p���ASiR �ɃA���g�����t�F�j�����iAn�j���������ꂽ SiR-An �����������i�} 7a�j13�j�B���̋z���X�y�N�g������ASiR �� An ���������Ă��邱�Ƃ��m�F���i�} 7b�j�A����Фfl �̓P�C�f���[�_�~���U���� Si-Me ���� 6 �{�Ⴂ 0.05 �ł������i�\ 2�j�B�������ASiR-An �� Фfl �� 0.05 �́A���q�� PET �����s�R�b�`���\�s�R�b�̎��ԑтŋN���邱�Ƃ���\�z����� Фfl �� 0.01 �ɔ�r���đ傫���B�����ŁA�A���g���Z���� SiR �̊Ԃɖ{���� PET ���N���邩�ɂ��āA���[�U�[�t���b�V���t�H�g���V�X����уp���X���W�I���V�X��p���Ċm�F�����B�����ߓx�z�������@�́A�p���X���[�U�[���邢�͓d�q���p���X�������ɏƎ˂��A���������l�X�ȉߓn��̋z���X�y�N�g�������ԕ��𑪒肷����@�ł���B SiR-An �ɂ����āASiR �̑I��I����N�ɂ���ĕ��q�� PET ���N����Ȃ�A SiR �̈�d����N��ԁi1SiR*�j�����Ƃقړ����ɁASiR �� An �̃��W�J���C�I���i�d�ו�����ԁj�̉ߓn�z�����ϑ��ł���Ɨ\�z�����B
�@�܂� Si-Me ��p���ASiR ���ʂ̈�d����N��ԁi1Si-Me*�j����у��W�J���C�I���iSi-Me�E�|�ASi-Me�E�{�j�̉ߓn�z���X�y�N�g���𑪒肵���i�} 8a�j14�j�B���� SiR-An �̃t�F���g�b���[�U�[�t���b�V���t�H�g���V�X�ɂ����āA���[�U�[�Ǝˌ� 1Si-Me* �݂̂��ϑ�����A���q�� PET ���N����Ȃ����Ƃ������i�} 8b�j�B����ASiR- �W���`���A���g���Z���_�C�A�h�i5. Si-DMA �Q�l�j�̏ꍇ�A1Si-Me* �ƃ��W�J���A�j�I���iSi-Me�E�|�j�������Ɋϑ�����APET �ɂ��d�ו�����ԁiSiR�E�| �� An�E�{�A���F��҂� SiR �̊���Ԃ̋z���X�y�N�g���Ɠ����g���̈�ɋz���������߁A���m�Ɋϑ��ł��Ȃ��j���������邱�Ƃ��킩�����i�} 8c�j14,15�j�B
�@�����̎�����ʂ��āA���̂悤�� SiR-An �̓�������� 1O2 �u���v���[�u�̊J���ւ̉ۑ�_�����炩�ɂȂ����B
�P�DSi-Me �ɔ�ׂ� SiR-An ��Фfl ���� 6 �{�ȏ㌸�������B����́ASiR �ƃt�F�j�����̊Ԃ̎��R��]�ɂ���āA��N�G�l���M�[���u���ł͂Ȃ��A�M�Ƃ��ėn�}���q�ɔ��U��������ł���i���t�ˑJ�ځj�B
�Q�DSiR-An �ɂ����ẮASiR �� An �̊Ԃł� PET ���N����Ȃ��B����́A�i1�j 1SiR* �̊Ҍ��d�ʂ� An �̎_���d�ʂ̊W����APET �́|��G ���\���ɑ傫���Ȃ��A�i2�j SiR �ƃA���g���Z����Ƃ̊ԂɃt�F�j��������݂��邽�߁A�h�i�[�iSiR�j�ƃA�N�Z�v�^�[�i�A���g���Z����j�Ƃ̋����������Ȃ�APET ���t�ˑJ�ځi�u���j���x�����ƂɋN������ƍl������B���Ȃ킿�APET �����p�����u���v���[�u�q�v����ɂ́A�u���F�f�Ə����܂����ڌ������Ă��镪�q�\�����D�܂����B
�R�D SiR-An �́A�זE�̃~�g�R���h���A�ɏW�ς����i�} 9�j13�j�B�܂�ASiR-An �Ɠ����x�̕��q�̑傫���Ǝ��n���������Ȃ���A�J�`�I������ SiR �F�f�𗘗p�����u���v���[�u���J������A PDT �ɂ����ďd�v�ȃ^�[�Q�b�g�ł���~�g�R���h���A�Ŕ������� 1O2 �����o�ł���Ɨ\�z�����B
�S�DSiR-An �́A1O2 �Ƃ̔������x�����ɒx���A�����ɂ��u���������m�F�ł��Ȃ������B����́A���q�� PET ���N����Ȃ��A���A���d�q�܂� 1O2 �� SiR-An �̃A���g���Z����Ɨe�Ղɔ������Ȃ����Ƃ���������B���������āA1O2 �Ƃ̔����������߂邽�߂ɂ́A�A���g���Z���� 9, 10 �ʂɓd�q���^������A�d�q���x�������邱�Ƃ��K�v�ł���B
�T�DSi-DMA �ɂ��זE��1O2 �̎��o��
�@SiR-An �̌��ʂɊ�Â��āA9,10- �W���`���A���g���Z���� SiR �ڌ������� Si-DMA �̊J���ɐ��������i�} 10a�j15�j�B 1O2 �����݂��Ȃ����ł� Si-DMA �� Фfl �͖� 0.01 �ł���ASi-Me�i�\ 2�j�� Фfl ���� 32 �{���������i�} 10a�j�B����A1O2 �����������ƁASi-DMA �̌u�����x���ő� 18 �{�������邱�Ƃ��m�F�����i�} 10b�j�B���������āA�A���g���Z���� 9,10 �ʂɓd�q���^��ł��郁�`��������邱�Ƃɂ���� 1O2 �Ƃ̔��������������邱�Ƃ��������ꂽ�B
�@�����ŁASi-Me �ɔ�r���ASi-DMA �� Фfl �̖� 32 �{�̌����� PET �ɋN������̂����m�F���邽�߂ɁAФfl �̗n�}�ˑ����̌����Ɖߓn�z������i�} 8c�j���s�����B���̌��ʁA�n�}�̗U�d�����������Ȃ�ق� Si-DMA �� Фfl ���傫���Ȃ邱�Ƃ��m�F���APET �̓d�q�ړ����x���n�}�̗U�d���ɔ���Ⴗ������ƈ�v�����B�܂��ASi-DMA �� 650 nm �t�F���g�b���[�U�[�t���b�V���t�H�g���V�X�ɂ����āi�} 8c�j�A1SiR* �i1Si-Me*�j�ƂƂ��� SiR�E�|�iSi-Me�E�|�j�̐������ϑ����ꂽ�B����āASi-DMA �͕��q�� PET �ɂ���Ču����������邱�Ƃ����� 14�j�BPET �Ɋւ��āASi-DMA �� SiR-An �Ƃ̍��ق́ASi-DMA �̏ꍇ�A�i1�j�d�q�h�i�[�ƃA�N�Z�v�^�[�Ƃ̊Ԃ̋������߂��A�i2�j 9,10-�W���`���A���g���Z���iEox�� 1.05 V vs. SCE�j���A���g���Z���iEox�� 1.19 V vs. SCE�j���_������₷���̂ŁA PET �́|��G ���\���ɑ傫���APET���x�������Ȃ�A�d�ו�����Ԃ��������Ő������邱�ƂɋN������ƍl������B
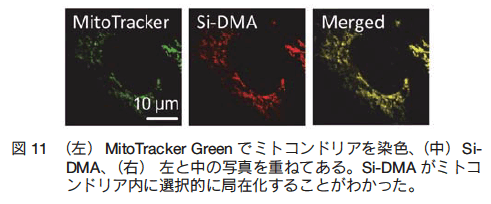
�@���ɍזE���g�p�����������s���A�� 100 nM �ȉ��̔Z�x�� Si-DMA �� 30 ���ԃC���L���x�[�V��������ƁA�~�g�R���h���A�ɏW�ς���邱�Ƃ��m�F�����i�} 11�j15�j�B Si-DMA ��p���ă~�g�R���h���A�Ő����� 1O2 �����o�����邽�߂ɂ́A���̓����� 1O2 ���ł���������܂����邱�Ƃ��K�v�ł���B��X�́A�s�̂� PDT ��܂ł��� 5-ALA ���g�p�����B 5-ALA �̓w���̑O��̂ł���A����זE���ł͓��ٓI�Ƀm���w���|���t�B�����iPpIX�j���~�g�R���h���A�ɒ~�ς�������\������i�} 2c�j�B�{�����ł́AHeLa �זE�� 5-ALA ������ 3 ���ԃC���L���x�[�V�������A�~�g�R���h���A�� PpIX ������������A20 �` 100 nM Si-DMA ������ 30 ���ԃC���L���x�[�V���������B�����ŁA�ԐF���[�U�[�i��ex �� 640 nm�j��p���� PpIX �� Si-DMA ���ɗ�N�������ʁA�� 20 �b�ȓ��� Si-DMA �̌u���������l�̖� 2 �{�ɑ��������i�} 12a�j 15�j�B
�@����A���̍זE���튯�i���C�\�\�[���j�ɋǍ݉����� TMPyP4 �̌�������p�ɂ���Đ������� 1O2 �i�} 12b�j�A�~�g�R���h���A���ɑ��݂���������^���p�N���iKillerRed�j�����������_�f���W�J���i�} 12c�j�A�܂��́A�זE�̎_���o�[�X�g�ߒ��Ő������ꂽ�_�f���W�J���ɂ���ẮA�~�g�R���h���A���� Si-DMA �̌u�������͊ϑ�����Ȃ������B�����̎������ʂ���A1O2 �̍זE���g�U�����́A���_�ʂ萔�\�`���S nm �ɉ߂��Ȃ����ƁA�܂��A�_�f���W�J���̓����iHaber-Weiss �����Ȃǁj�ɂ�� 1O2 �̐����ʂ͖����ł�����x�i���זE���ɉe�����Ȃ����x�j�ł��邱�Ƃ��킩�����B���̂悤�Ȍ��ʂ͉ߋ������̕Ƃ���v�� 6, 16�j�ASi-DMA �� PDT ���ɔ������� 1O2 �����o���ł���u���v���[�u�ł��邱�Ƃ𗧏����B�Ȃ��A�{�����ŊJ�����ꂽ Si-DMA �͍����O�����o����o��19�j�A2016 �N 2 �������琢�E���Ŕ̔��J�n����Ă���i���m���w����������ѕč��@�l Dojindo Molecular Technologies, Inc.�ASi-DMA for Mitochondrial Singlet Oxygen Imaging�j�B
6�D������
�@�ȏ�̂悤�ɁA�זE�� 1O2 �̎��o���̂��߂ɕK�v�Ȍu���v���[�u Si-DMA ���J�����A�ߓn�z�������@�Ȃǂ�p���Ă��̐����ׂ��BPET �̌�������ՂƂ����u���v���[�u�́A���q�� PET �̑��x���ő��ɂ��邱�Ƃɂ���čł��Â��I�t��Ԃ�v�ł��A103 �{�ȏ�̃I���I�t���B�����邱�Ƃ��ł���B�������A�n�t���œ���ꂽ�I���I�t�䂪�זE���ł͑啝�ɒቺ����ꍇ�������A�u���v���[�u�̍זE���̎g�p�ɂ����āA�\�����ӂ��Ȃ���Ȃ�Ȃ��B����́A�n�t���Ƃ͈قȂ�זE���̗l�X�Ȋ��v���i�U�d���A�ɐ��A�S�x�A���q�N���E�f�B���O�Ȃǁj�� PET �ߒ��ɉe����^�������߂ł���ƍl������B
�@���������āA�זE���ł̍����I���I�t��������u���v���[�u���J�����邽�߂ɂ́A�u�����G�l���M�[�ړ��iFörster resonance energy transfer�AFRET�j�A�� �W �U �N �� �� �� ���iAggregation induced emission enhancement�AAIEE�j 18�j�A�ߐԊO����N���\�ȃA�b�v�R���o�[�W�����i�m���q����ѓ���q�z�������̂Ȃǂ̗l�X�Ȍ����w�I�Ȍ������v���[�u�̕��q�v�ɍ̗p���邱�Ƃ��K�v�ł���B�܂��A1 �זE���ł� 1O2 �������ϑ����邽�߁A�����v���[�u�݂̂Ȃ炸�A1O2 �Ƃ̔����ɂ��F�ω��i���z���X�y�N�g���ω��j19�j�A���}���U���X�y�N�g���ω��̑���A�܂��́A�v���Y�������ʂ𗘗p���� 1O2 ���������x�̑���20�j����������Ă���B����A����Ȃ� 1O2 �����x��ʌ��o�@�̐i�W�ɂ��APDT �ɂ����Đ������� 1O2 �̎��o�����������A�����ʓI�Ȏ��Â̊m�����]�܂��B
| ���҃v���t�B�[�� | |
| ���� | ���@�����iSooyeon Kim�j |
|---|---|
| ���� | ����w�Y�ƉȊw�������@��N���q���w����@���C���� |
| �A���� | ��567-0047�@���{��؎s���䃖�u 8-1 TEL�F 06-6879-8496�@FAX�F 06-6879-8499 E-mail �F kimsooyeon45@sanken.osaka-u.ac.jp |
| �o�g�w�Z | ����w�H�w������ |
| �w�� | ���m�i�H�w�j |
| ��啪�� | �����w�A�������w |
| ���� | ���ˁ@��iMamoru Fujitsuka�j |
| ���� | ����w�Y�ƉȊw�������@��N���q���w���� ����w��w�@�H�w�����ȁ@�y���� |
| �A���� | ��567-0047�@���{��؎s���䃖�u 8-1 TEL�F 06-6879-8496�@FAX�F 06-6879-8499 E-mail �F fuji@sanken.oaska-u.ac.jp |
| �o�g�w�Z | ���s��w�H�w������ |
| �w�� | ���m�i�H�w�j |
| ��啪�� | �����w�A���ː����w |
| ���� | �^���@�N�N�iTetsuro Majima�j |
| ���� | ����w�Y�ƉȊw�������@��N���q���w���� ����w��w�@�H�w�����ȁ@���� |
| �A���� | ��567-0047�@���{��؎s���䃖�u 8-1 TEL�F 06-6879-8495�@FAX�F 06-6879-8499 E-mail �F majima@sanken.oaska-u.ac.jp |
| �o�g�w�Z | ����w�H�w������ |
| �w�� | ���m�i�H�w�j |
| ��啪�� | �����w�A���ː����w |