|
| トップページ > siRNA 選択性蛍光プローブを用いた細胞内デリバリーイメージング解析 |
 |
||||||||||||||||||||||||||||
siRNA 選択性蛍光プローブを用いた細胞内デリバリーイメージング解析
|
||||||||||||||||||||||||||||
 |
佐藤 貴哉 東北大学大学院理学研究科化学専攻 |
 |
西澤 精一 東北大学大学院理学研究科化学専攻 教授 |
Summary
Small interfering RNA (siRNA) has been gaining much attention as a next-generation therapeutics for targeting previously ‘undruggable' diseases such as cancer and viral infection. However, the practical implementation is hindered mainly by the development of efficient and safe delivery carriers. For the successful development of such delivery carriers, useful analytical methods including fluorescence imaging are strongly required to facilitate the assessment of siRNA delivery process at the molecular level in living cells. Here, we briefly review conventional imaging methods for cellular siRNA delivery, and then we present a new imaging method using siRNA-selective fluorescent probe that we have recently developed.
1. はじめに
1998年に A. Fire, C. C. Mello らによって発見された RNA 干渉(RNAi: RNA interference)1)、ならびに RNAi を誘起することが示された小分子 RNA 二重鎖(siRNA: small interfering RNA)2,3)は、ここ 15 年あまりの生化学分野の飛躍的な進歩を支えている。今現在、 siRNA は遺伝子発現パターンを制御し得る強力なツールとして、その有用性が広く認められており、特に最近では、がんやウイルス感染症、神経疾患といったこれまでの難治性疾患に対し、遺伝子レベルでの治療方法を開発する次世代型核酸医薬品としてもますます研究・臨床試験が活発化している4)。しかし siRNA 医薬開発が始まってから 15 年近くたった現在、承認に至ったものはない(2016 年 4 月現在)。実用化の課題とされているのが siRNA を標的組織・細胞へ輸送するデリバリーシステムの構築であり、これと同時に必要な情報(導入効率、局在、細胞内半減期など)を分析する手法の開発が必要となる。最近、我々は siRNA 選択的な結合機能を有する蛍光プローブを開発し、これに基づく独自の siRNA デリバリー過程のイメージング解析法を提案している。ここでは siRNA の特徴と既存のイメージング解析法について化学的視点から簡潔に概観した後、我々が開発したイメージング手法を紹介する。
2.siRNA の構造的特徴
siRNA は一般に 19-21 塩基長の RNA 二重鎖(dsRNA)である。細胞内に長い dsRNA が導入されると、細胞質に存在する dsRNA 切断酵素(Dicer: RNase Ⅲ の一種)により切断されて siRNA が生成する 5)。この際 3’ 末端に 2 塩基飛び出したオーバーハング構造が生成する。 siRNA は RNAi 機構の中核を担う Argonaute タンパク質などと RISC(RNA-induced Silencing Complex)複合体を形成し、配列特異的な標的 RNA 切断を誘発するが、この RISC 複合体は Argonaute タンパク質の PAZ ドメインへオーバーハング塩基が入り込むことで安定化している 6)。通常、化学合成される siRNA には、こうした構造を模して 3’ 末端に dTdT(デオキシリボチミン)オーバーハング 2 塩基を付与する。 PAZ ドメインは疎水性のアミノ酸が保存されたポケットであるため、どんな組み合わせのオーバーハング塩基でもよいが、合成コストを抑えるために dTdT が汎用されている 3)。また、オーバーハング塩基はオーバーハングのない単純な dsRNA と比較して、ヌクレアーゼ分解耐性の向上にも寄与する。
3.siRNA 医薬の実用化に向けた課題
核酸医薬開発にあたっては、その酵素耐性の低さおよび細胞膜透過性の低さが大きな課題となる。酵素耐性の低さは RNA では特に顕著であり、たとえば天然の RNA 分子は血中での半減期が 2-6 分と極めて短い 4)。また、 RNA は親水性のポリアニオンであるため、負に帯電した細胞膜(脂質二重膜)を貫通することはできない。これらの課題を克服するため、 siRNA の化学修飾やキャリアによる輸送技術が活用されている。化学修飾は siRNA の酵素分解耐性の向上 4)や免疫システムによる認識の回避 7)に寄与し、 RNAi 効果を向上させることも可能である 8)。これまで承認された核酸医薬 3 例(Vitravene, Macugen, Kynamuro)はいずれも化学修飾を施されたものであったことからも、その必要性がうかがえる。これに加えて患部への直接注射を用いない、経口薬として siRNA 医薬を開発する場合、キャリアの利用がほぼ必須である。
4.実用化の要であるデリバリーキャリア
デリバリーキャリアの多くは siRNA と静電相互作用を介して siRNA/キャリア複合体を形成し、 RNase からの分解を阻害し、血中の動態を調節する役割を果たす。 siRNA 医薬の実用化において、優れた輸送能力を持つキャリアの開発が律速段階と考えられている。これまでに多くのキャリアが開発されているが、その中で最も実用化に近いと言われているのが、カチオン性脂質ベースのキャリアであり、それに続くのがポリマーベースのキャリアである9)。キャリア設計にあたっては、内包した siRNA を患部へ輸送し、必要な時に必要量の siRNA を放出し続ける能力(徐放性)が求められる。そのためには、キャリアの高度かつ精密な分子設計と、その輸送能力を生きた細胞内で分子レベルで評価することが必要である。
5.デリバリー過程の生細胞内イメージング解析
細胞内へのデリバリー過程は、蛍光イメージング技術を利用することで高感度にかつリアルタイムで解析可能である。デリバリー過程には、 siRNA の取り込み(uptake)、細胞内輸送(trafficking)、 siRNA 放出(releasing)といった多くの注目すべき段階がある。同時に siRNA 導入による RNAi 活性の評価や細胞毒性評価も行わなければならない。 siRNA 自身は無蛍光であるため、解析には蛍光色素を siRNA やキャリアに修飾する必要がある。下記にまとめたラベル化法にはそれぞれの特徴・欠点があり、デリバリー過程の中でも解析可能な段階が異なる。
5-1.キャリアのラベル化
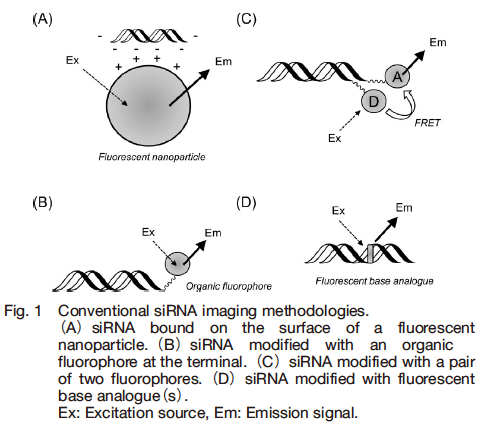
量子ドットをはじめとする蛍光性ナノ粒子は、その粒径や分光特性の調節が容易で、表面修飾を施しやすい機能性ナノマテリアルである。この表面に siRNA を共有結合あるいは静電相互作用を介して修飾することで、ナノ粒子がデリバリーマテリアルとして機能することが報告されている(Fig. 1A) 10)。一般に、有機色素と比べると輝度が大きく退色しにくい優れた分光特性を有しており、蛍光性ナノ粒子をキャリアとして用いれば、 siRNA/ナノ粒子複合体の取り込みや輸送を追跡することが可能である。しかしナノ粒子のコアを形成するカドミウムなどの元素の毒性が懸念されている。また広く用いられる脂質やポリマーベースのキャリアは無蛍光性であり、有機合成で色素を修飾することは必ずしも容易ではない。そのためイメージング解析に適用可能なキャリアには制限がある。
5-2.siRNA のラベル化
蛍光イメージング法の多くは siRNA へ有機蛍光色素を共有結合で修飾する手法を用いている。この方法では市販の蛍光色素を siRNA の末端に修飾し、任意のキャリアを用いてトランスフェクションを行うことで、 siRNA の取り込み・細胞内局在を直接追跡することが可能である(Fig. 1B)11)。特に適当な 2 種類の色素を同一 siRNA 分子に修飾することで、その FRET(Fluorescence Resonance Energy Transfer)シグナルを解析に用いることができる12)。 FRET は色素同士が近接した時にのみ得られるため、そのシグナルは二重鎖状態の siRNA に由来する点で特徴的である。個々の色素のシグナルを追えば、センス鎖とアンチセンス鎖を区別してそれぞれの鎖の挙動を別々に調べることもできる(Fig. 1C)。また蛍光性の擬塩基を用いた解析法も提案されている(Fig. 1D)。蛍光性シトシン類縁体 PhenylpyrroloC 13)やシアニン色素であるチアゾールオレンジ(TO: Thiazole Orange) 14)を siRNA に組み込むことで、 siRNA の細胞内取り込みや局在だけでなく、 RISC 複合体を可視化14)できることが報告されている。
一般に、蛍光色素の修飾は siRNA と RISC タンパク質との相互作用を阻害して、 RNAi 活性の減少を引き起こしてしまうことが課題で、修飾部位として、センス鎖の 5’ 末端を選ぶと siRNA のサイレンシング活性の減少が最小限に抑えられることが知られている 15)。また、トランスフェクションする siRNA の内の数%のみを色素修飾 siRNA に置換することもしばしば行われる。しかし、通常の蛍光色素は比較的疎水性が高く、ミトコンドリアなどの細胞内小器官やタンパク質へ非特異吸着してしまうことによる局在パターンの変化に注意が必要である。さらに多くの色素は常に蛍光シグナルを発しているため、 siRNA が分解されたのちに遊離する色素からのシグナルは、 siRNA の挙動を反映していない擬陽性シグナルとなる点も解析上注意すべき点である。
6.siRNA 結合性蛍光プローブによるアフィニティーラベル化法の開発
従来のイメージング技術により、 siRNA の細胞内デリバリー過程の理解は格段に進んできた。しかし広く用いられている siRNA の色素修飾体はいわば「siRNA mimic」であることに注意しなければならない。特に分子量がそれほど大きくない siRNA に対し蛍光色素を共有結合で連結することは、 RNAi 活性の減少といった上記の問題を引き起こす原因であり、またコストやアッセイの利便性の面でも決して最善の手法とはならないであろう。つまり医薬としての本来の姿・機能を持った siRNA を用いてデリバリー解析できることが望ましい。そこで我々は、 siRNA に選択的に結合する蛍光性プローブを用いたアフィニティーラベル化法を着想した。すなわち非共有結合で標的 siRNA をラベル化することができれば siRNA 自身への色素修飾が不要となり、色素がもたらしうる RNAi 活性の低下や擬陽性シグナルといった問題への新しい解決策になると考えた。同時に分析コスト、操作性、汎用性の面でも優れた分析法となることも期待できる。
6-1.siRNA 選択性蛍光プローブの設計と結合能評価
細胞内では多種多様な高次構造をとる RNA が大量に存在している。そうした環境内で siRNA への選択的な結合を達成するために、その 3’ 末端オーバーハング構造とその近傍の二重鎖部位を結合部位として着目した(Fig. 2) 16)。オーバーハング 2 塩基認識部位として、それと相補的な 2 塩基ペプチド核酸(PNA: Peptide Nucleic Acid)を基本骨格として用い、この C 末端へ二重鎖認識部位として light-up 型インターカレータであるチアゾールオレンジ(TO)を連結した。さらに、 N 末端にはピレン(Py: Pyrene)を連結することで、プローブ Py-AA-TO を得た。
Fig. 3 にプローブの TO 部位由来の典型的な蛍光スペクトルを示す。一連の実験はホタルルシフェラーゼ GL2 遺伝子を狙った siRNA 配列(siGL2)を用いた。プローブ単体では TO 部位が励起状態でねじれることによる無輻射失活によりほぼ無蛍光である。ここへ等量の dTdT オーバーハングを有する標的 siGL2 を添加すると、 40 倍以上の蛍光量子収率増大を示した。これに対し一本鎖に対する応答は 10 分の 1 程度と非常に小さかったことから、 TO 部位は二重鎖の塩基対間へ結合していることが示唆される。塩基対間へのインターカレーションにより TO 部位の回転が抑制され、明瞭な light-up 応答が観測されたものと考えられる。また、 dAdA オーバーハングを有するミスマッチ siRNA やオーバーハングのないフルマッチ dsRNA に対しても蛍光強度は 3 分の 1 程度に抑えられていた。このことからプローブの PNA 部位がオーバーハング構造、ならびにその塩基を識別していることが示唆された。こうした選択的蛍光応答は RNA が過剰(~ 5 倍)に存在した条件下でも維持されていた(Fig. 3, inset)。一方、 Py 部位を持たないプローブ(AA-TO)を用いた場合、 RNA が等量以上存在すると siRNA 選択的な蛍光応答は見られなかったことから、 Py 部位が選択的結合において重要な役割を果たしている。すなわち、スタッキング能力の高い Py を導入することにより、プローブは TO 部位と Py 部位で分子内スタッキングした初期構造をとるため(Fig. 2 参照)、 TO 部位単体の非選択的な結合(二重鎖部位への結合)を抑制し、 siRNA 選択性が向上したと考えている。これに加えて、結合時には末端の PNA- オーバーハング塩基対へ覆いかぶさることで 2 塩基の塩基対形成を促進する「分子キャップ」として機能していると推測している(Fig. 2 参照)。
本プローブの解離定数(Kd)を蛍光滴定実験から算出したところ(Fig. 3, inset)、 1.3 μM と求まり、これは単純な RNA 二重鎖に対する値(7.0 μM)よりも 5 倍以上小さいことが分かった。さらに、 dGdG オーバーハング塩基に対しては、シトシン塩基を組み込んだプローブを用いることで同様の選択性が得られたことから、汎用性のある分子設計であると言える。
6-2.siRNA デリバリー解析
続いて Py-AA-TO を siRNA のアフィニティーラベル化剤(非共有結合に基づくラベル化剤)として利用し、デリバリー解析を試みた 16, 17)。 siGL2 と等量の Py-AA-TO を混合した緩衝溶液中にポリマーベースのキャリア(jetPRIME(R), polyplus)を添加することで、キャリアに Py-AA-TO と siRNA の錯体が内包された(Fig. 4A)。こうして生成した siRNA/キャリア複合体の平均粒径は 238 nm で、プローブを添加しなかった場合(227 nm)と同程度であった。この複合体の溶液を HeLa(ヒト子宮頸がん)細胞の培地へ添加し、 3 時間後蛍光顕微鏡で観察したところ、細胞質に Py-AA-TO の蛍光シグナルが輝点状に観測された(Fig. 4B)。これはエンドサイトーシスで取り込まれた複合体がエンドソーム内にトラップされた状態であると考えられる。この小胞は時間が経つと酸性化が進み、やがてリソソームへ融合する。実際にリソソーム染色剤との共染色実験から、確かにプローブのシグナルの大部分がリソソームと重なっていた(Fig. 5)。ここで重要なことは、プローブのシグナルは今回の濃度条件では細胞質全体には見られず、複合体に選択的であったことである。 Alexa647 を修飾した siRNA を用いて対照実験を行うと、 Alexa のシグナルは細胞質全体に観測されたことから、 siRNA の一部はこの時間スケールでは既に細胞内全体に放出されていることが分かった。一方、プローブのシグナルは変わらず複合体に由来する点状構造を示した。これらの結果から、我々のプローブは siRNA/キャリア複合体(複合体状態の siRNA)を選択的に可視化していることが分かった。これは脂質ベースのキャリア(Lipofectamine2000(R), invitrogen)を用いても同様であった。
この性質は、細胞内取り込みや放出を定量する際に極めて有用で、色素修飾した siRNA を利用する従来法では困難な解析が可能となる。例えば、汎用されるフローサイトメトリーを用いて、 siRNA/キャリア複合体を取り込んだ細胞数をプローブの蛍光シグナルを検出することで評価すると、培地添加後 1 時間で 76 %と見積もられ、これは Alexa-siRNA を用いた従来法で得られた 83 %という値とほぼ同程度であった(Fig. 6)。このことは細胞内取り込みの初期段階においては、複合体状態の siRNA の取り込みを定量的に評価できることを示唆している。さらに、培地添加後 4 時間で培地を交換し、 20 時間まで培養時間を伸ばしてみると、プローブのシグナルが観測される細胞数は徐々に減少していくことが分かった(Fig. 6)。この結果は複合体が解消するにしたがってプローブが siRNA から解離し、蛍光シグナルがオフになったためであると考えられる。実際、プローブのシグナル減少の半減期はおよそ 1-2 時間と見積もられ、類似のキャリアで報告されている値 18)に近い。従って、本プローブを用いれば、 siRNA の細胞内取り込みだけでなく、その放出(あるいは複合体の解消)も簡便に解析することが可能である。一方、 Alexa のシグナルは 4 時間での 93 %という値のまま 20 時間後も変化が見られなかった(Fig. 6)。これは、色素を修飾した場合では色素が複合体から放出された後も、siRNA の状態にかかわらず光り続けているためで、 siRNA の細胞内取り込みは解析できるものの、その後の siRNA 放出過程を評価することはできないことになる。
6-3. RNAi 活性への影響
デュアルルシフェラーゼアッセイにより、 siRNA のサイレンシング活性を評価した。本プローブでアフィニティーラベル化した siGL2 を導入した時の活性は、 siGL2 単体の活性と同程度で、約 80 %であった(Fig. 7)。これは siRNA がキャリアから放出されるとプローブが速やかに解離した結果、インタクトな siRNA が細胞内に輸送されたためと考えられ、本プローブによるラベル化は RNAi 活性に影響を与えないことが示唆された。また今回の濃度条件ではプローブ導入による細胞毒性は見られなかった。
以上のように、本プローブを用いた解析では、本来の siRNA 活性を殆ど損なうことなく一連の細胞内デリバリー過程を可視化・評価することができる。共有結合を介した蛍光色素のラベル化に基づく従来のイメージング手法とは異なり、医薬として本来の構造と機能を維持した siRNA のデリバリー過程を可視化できる点に、本手法の本質的な価値がある。
7.おわりに
主に化学の観点から siRNA デリバリーのイメージング解析について概観し、我々が提案している新しいイメージング法について述べた。 siRNA 選択性蛍光プローブを利用した siRNA イメージング法は、キャリアに内包された siRNA を選択的に可視化する点に特徴があり、複合体の取り込み・輸送から解消過程までを明瞭に可視化することが可能である。また、キャリアにも蛍光色素を修飾する必要がないため、実用化の要となるキャリア分子そのものの物性を評価し、かつ siRNA の活性との相関をより正確に評価し得る点も優れた特徴となる。さらに低コストかつ操作性の高い点も分析法として大きな利点となる。
一方、分子レベルでの挙動に加え、個体レベルでの siRNA/キャリア複合体の薬物動態や RNAi 活性との相関を調べることも重要である。こうした分野では、自家蛍光や光散乱の影響を大きく受けやすい蛍光イメージングよりも、陽電子放出断層撮影(PET: Positron Emission Tomography)や単一光子放射断層撮影(SPECT: Single Photon Emission Computed Tomography)、核磁気共鳴画像法(MRI: Magnetic Resonance Imaging)、近赤外光などを用いたいわゆる「in vivo イメージング」が近年急速に発展している19)。適切なモダリティを利用することで、イメージング技術は siRNA 医薬の実現に向けた研究開発において強力な分析手法になると考えられる。
| 著者プロフィール | |
| 氏名 | 佐藤 貴哉 (Takaya SATO) |
|---|---|
| 所属 | 東北大学大学院理学研究科化学専攻 |
| 連絡先 | 〒980-8578 仙台市青葉区荒巻字青葉 6-3 TEL: 022-795-6551、FAX: 022-795-6551 E-mail: takaya.sato.p6@dc.tohoku.ac.jp |
| 出身学校 | 東北大学理学部 |
| 学位 | 修士(理学) |
| 現在の研究テーマ | 細胞内 RNA 高次構造を検出する蛍光プローブの開発 |
| 氏名 | 西澤 精一 (Seiichi NISHIZAWA) |
| 所属 | 東北大学大学院理学研究科化学専攻 |
| 連絡先 | 〒980-8578 仙台市青葉区荒巻字青葉 6-3 TEL: 022-795-6549、FAX: 022-795-6552 E-mail: nishi@m.tohoku.ac.jp |
| 出身学校 | 北海道大学理学部 |
| 学位 | 博士(理学) |
| 現在の研究テーマ | RNA 結合リガンドの開発と応用 |
| Copyright(c) 1996-2016 DOJINDO LABORATORIES, ALL Rights Reserved. |