 |
| トップページ > ミトコンドリアに局在化する過酸化物感受性蛍光プローブ |
 |
||||||||||||||||||
ミトコンドリアに局在化する過酸化物感受性蛍光プローブ
Abstract Mitochondria are functionally important subcellular organelles fou our life. Reactive oxygen species (ROS) are produced without interruption in mitochondria. Some enzyme can be quenching of ROS in normal cells. Once the redox balance has broken down, ROS produced in mitochondria turn into intrinsic weapon. Thus, mitochondria are major source of ROS in mammalian cells and are major target of oxidative damage. Types of damages caused by ROS to mitochondrial components include lipid peroxidation, protein oxidation, and mitochondrial DNA mutation. In order to detect oxidative damage in living cells, some fluorescence probes have been developed. A new type of fluorescence probe, diphenylpyrenylphosphine-conjugated alkyltriphenylphosphonium iodide (MitoDPPP) which was accumulated in mitochondria, has been synthesized. This probe was detected peroxide in living cell. Comparison of the reactivity toward several peroxide indicated that the probe was existed in mitochondrial membrane. Using this probe, generation of peroxide in mitochondria of living cell was successfully visualized.
1. はじめに活性酸素種(ROS)とは、スーパーオキシドアニオンラジカル (O2・−)、ヒドロキシルラジカル(OH・)、一重項酸素(1O2)および過酸化水素 H2O2 の総称で生物の生存に必須のエネルギー獲得機能そのものに含まれる酸化的化学因子(ラジカル)あるいは加齢、紫外線・放射線、大気汚染、薬物の長期服用、煙草の有害成分の吸入などにより生じる。それらは、高反応活性で脂質過酸化、遺伝子の損傷やタンパク質の酸化等を引き起こし、動脈硬化、アルツハイマー病などの疾病の引き金になる。高齢化が加速する我が国において活性酸素やそれらの化学種により引き起こされる生体内での酸化を分析する手段を構築し、それらの分子病態解析を深化することが急務である。 1.生体内での活性酸素種発生機構生体内でのエネルギー生成機構に重要な役割を果たしているのがミトコンドリア内の電子伝達系であり、それらはミトコンドリア内膜に存在するタンパク質複合体で構成されている。その複合体を通して、ミトコンドリア膜間スペースにプロトンを放出し、そのプロトンを駆動力として ATP を合成している。細胞内に取り込まれた酸素分子の多くはミトコンドリア内に運ばれ、そこで電子を受け渡しされることで活性酸素種へと変換される(図 1)1) 。  すなわちミトコンドリアは、このエネルギー生成過程(電子伝達系)で、様々な活性酸素種を生成し続ける生体内の活性酸素種発生源となっている。生成した活性酸素種は、スーパーオキシドジスムターゼ(SOD)、カタラーゼ、グルタチオンペルオキシダーゼなど、様々な酵素がそれらを除去することで細胞の営みは正常に保たれている2)。しかしながら、ひとたびこの発生と除去機構のバランスが崩れると、ミトコンドリアで発生した活性酸素種は、更なる強力な酸化力をもつ化学種を生み出す 3- 5) 。この過程で発生する OH・は、タンパク質、脂質、DNA などを酸化し、生体に酸化的損傷(酸化ストレス)を与え、ガン、脳卒中、アルツハイマー病などの引き金となる6) 。多くの活性酸素種はミトコンドリアで発生することから、ミトコンドリアは生体内で最も酸化ストレスを受けやすい細胞内微小器官であるといえる7-9) 。  ミトコンドリア内での酸化ストレスは膜中に存在する不飽和脂質の連鎖的脂質過酸化反応として現れる(図 2)。この反応は、ミトコンドリア膜を構成する不飽和脂肪酸が、 OH・により酸化を受け脂質ラジカルを形成し、更に酸化を受け脂質ペルオキシドラジカルを経て、脂質過酸化物を与える反応である。不飽和脂肪酸が酸化を受けると、連鎖的に反応が進行し、脂質過酸化物を蓄積させる。この脂質過酸化物の蓄積もまた、老化、動脈硬化やガンなどの病気を引き起こすことから、酸化ストレスの指標となる10) 。この脂質過酸化の検出には、従来ヨウ素滴定法やチオバルビツール酸(TBARS)法が用いられていたが、これらの測定法は破壊的分析であり生細胞中での観測ではない。また TBARS 法は、試料中のマロンジアルデヒドを検出する測定法で、これは脂質過酸化物の二次的物質であるため、選択的に脂質過酸化物を検出しているわけではない11) 。 2.細胞膜透過性蛍光プローブ細胞膜を透過し細胞内に導入することができる蛍光プローブがいくつか報告されている。ジクロロフルオレセインジアセテート(DCF-DA)や Peroxyfluor-1(PF1)12) は細胞膜を比較的容易に透過し細胞質に集積される(図 3)。特に DCF-DA は、アセチル基が細胞内の加水分解酵素により加水分解を受け、細胞内滞留性が高くなる。しかし、この蛍光プローブは生細胞中で細胞質に産生される活性酸素種や高活性ラジカル種を捕捉するが、化学種への選択性を持たない。 PF1 は、プローブ自身に立体的かさ高さを持たせることで小さな化学種にのみ反応するように選択性を持たせている。しかしながら、脂質過酸化物のように立体的にかさ高い化学種とは反応せず、その産生を細胞中で検出することは困難である。このようにかさ高い化学種にのみ反応するような選択性を持たせることは蛍光プローブの分子設計だけでは踏破することができない。  3.細胞内微小器官局在化蛍光プローブ先にも記したように、ミトコンドリアは、活性酸素種産生と密接な関係をもつことから、ミトコンドリアに特異的に局在化する蛍光プローブの開発も進んでいる。図 4に示すジヒドロローダミン 123 や MitoAR はローダミンを基本骨格にもつ活性酸素種感受性蛍光プローブである。ミトコンドリアは、 ATP 合成の際に膜間スペースにプロトンを蓄積させるため、内膜と外膜との間に電位差が生じ、その電位差は細胞形質膜よりも高い。その特質に応答してローダミンはミトコンドリアに局在化する。ジヒドロローダミン 123 や MitoAR は細胞内微小器官に局在化する特性は持つものの脂質過酸化物に対する選択性がない13) 。トリフェニルホスホニウム塩のような脂溶性カチオンは細胞内へ取り込まれると、電位差が高いミトコンドリアへ局在化することが近年 Murphy らにより報告されている14-17) 。そのトリフェニルホスホニウム塩を PF1 に結合させた MitoPF1 が過酸化水素特異的な感受性をもつ蛍光プローブとして開発された。 MitoPF1 は、PF1 の特性をそのまま受け継いだミトコンドリアに局在化する蛍光プローブで、立体的にかさ高い活性種との反応性に乏しい。このように細胞内で OH・、O2・−、 H2O2 など、多くの活性酸素種が存在する中、ミトコンドリア内脂質過酸化物を選択的に識別し可視化するような蛍光プローブは、ミトコンドリア内での酸化ストレスの度合を推し量るために必要となる。  4.トリアリールホスフィンを用いた過酸化物捕捉剤3 価リン化合物であるトリアリールホスフィンを蛍光プローブとして利用した報告例がいくつかある(図 5))18, 19) 。蛍光発光する原子団であるピレンやペリレンを置換基としてもつジフェニルピレニルホスフィン(DPPP)や 3- ペリレニルジフェニルホスフィン(3- PeDPP)は還元状態であるホスフィンではリン原子上の孤立電子対を介した分子内光電子移動反応により蛍光団を消光する。  ところがひとたび酸化を受けホスフィンオキシドになるとその消光は解消され蛍光団の強い蛍光発光が見られるようになる。すなわち、過酸化物により酸化されることで、相当するホスフィンオキシドとなり、蛍光強度が増大する特徴を DPPP や 3- PeDPP はもつ(図 6)。このようなトリアリールホスフィン誘導体は、脂溶性が高く、細胞内導入が困難である。近年、Soh らにより報告された Spy-LHP は脂溶性の高さを利用し、さらにアルキル鎖を導入することで細胞形質膜に局在化する過酸化物捕捉蛍光プローブに特化した優れた蛍光プローブであるといえる20) 。  5.ミトコンドリアに局在化する脂質過酸化物感受性蛍光プローブミトコンドリアに局在化し過酸化物を捕捉する蛍光プローブとして、我々はトリフェニルホスホニウム塩を DPPP に結合させた MitoDPPP を開発した(図 7)。 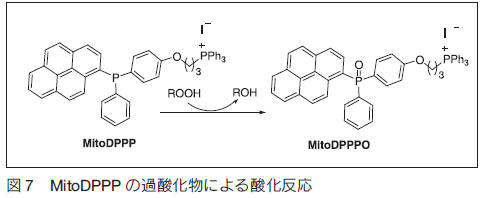 この蛍光プローブは、351 nm の光で励起すると 380 nm に蛍光発光を示し、酸化されて MitoDPPPO になると光誘起電子移動反応による消光が解消され、その蛍光強度は約 35 倍増大する。また、 MitoDPPP は、容易に細胞内導入され、ミトコンドリアに局在化する。Methyl linoleate hydroperoxide(MeLOOH)、Cumene hydroperoxide(CumOOH)、tert-Butyl hydroperoxide(t-BHP)および過酸化水素との反応性を検討したところ、均一溶媒中では若干の違いは見られるが、どの過酸化物によっても一様に酸化され過酸化水素との反応においても他の脂溶性の過酸化物とほぼ同等の反応性が見られた(図 8)。  一方、リポソーム中においては、脂溶性の過酸化物を用いた反応に比べると、過酸化水素のそれは遅くなることが明らかとなった(図 9)。  さらにヒト肝がん由来の HepG2 細胞中で種々の過酸化物との反応性を比較すると、脂溶性の過酸化物によって速やかに酸化を受けるが、過酸化水素での酸化は極めて遅いことが明らかとなった(図 10)。 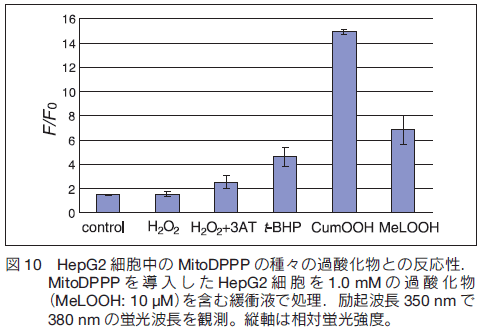
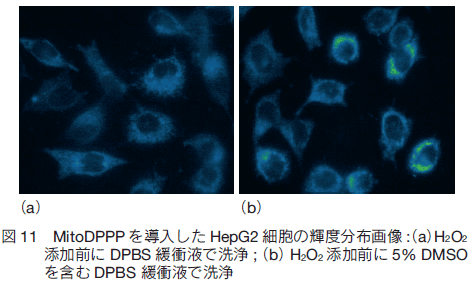
しかしながら、この蛍光プローブは、蛍光団としてピレン基を用いていることから、共雑自家蛍光の影響とその励起光の細胞への光毒性が危惧されるため蛍光顕微鏡の連続測定には適していない。この課題を克服するには、蛍光波長を長波長側に有する蛍光プローブの開発が求められる。蛍光、励起波長ともピレン基よりも長波長側に有するペリレニル基に換えた蛍光プローブ MitoPeDPP はこの課題を克服したプローブである(図 12)26) 。  おわりに今回、細胞内微小器官に局在化し、細胞内のシグナル物質を検出する蛍光プローブをいくつか紹介した。部位特異的かつシグナル特異的な種々の蛍光プローブを複数組み合わせることで細胞内の微小器官近傍におけるシグナル物質の局所的な動態を観測できることから、今まで見ることのできなかった事実の発見につながるであろう。また、これらのプローブを利用した抗酸化剤の探索・開発にも期待がもてる。 |
||||||||||||||||||
|
||||||||||||||||||
| Copyright(c) 1996-2015 DOJINDO LABORATORIES, ALL Rights Reserved. |
