XI. 抗体への酵素標識
1. キットを用いた標識方法
操作上の注意点など詳細については、取り扱い説明書をご参照いただきたい。なお、キットの取り扱い説明書は小社HPからダウンロードが可能である。
2. キットを用いPeroxidaseを標識した抗体の使用例
1) ミトコンドリアの染色例
使用製品: Ab-10 Rapid Peroxidase Labeling Kit (Code:LK33)
抗ミトコンドリア抗体をAb-10 Rapid Peroxidase Labeling Kitを用いてPeroxidase標識後、 固定化後のHeLa細胞に添加し免疫反応後、DAB[code: D006]添加によりミトコンドリアを染色した。
本製品の標識操作により、抗体中のアミノ基に標識体が結合します。そのため抗体によっては抗原認識能が失われる場合があります。ご不明な点がありましたら小社カスタマーサポートへお問合せ下さい。
|
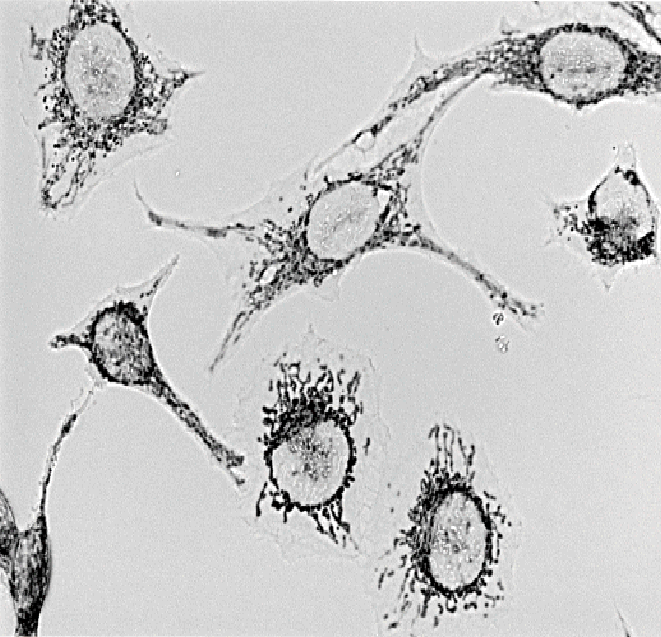
図26 Ab-10 Rapid Peroxidase Labeling Kitを用いたミトコンドリアの染色例
|
2) EIA(Enzyme Immunoassay)への応用例
使用製品: Peroxidase Labeling Kit-NH2 (Code: LK11)
EIAへの応用例として、ELISA及びウエスタンブロッティングでの使用例を紹介する。Peroxidase Labeling Kit-NH2(Code: LK11)で標識した一次抗体を用いた直接法と、一次抗体と市販のHRP標識二次抗体を用いた間接法をそれぞれ比較した。図27はビオチン化BSAをプレートに固定し、HRP標識抗ビオチン抗体を結合後、TMB発色したELISAの結果である。抗ビオチン抗体とHRP標識二次抗体を用いた間接法と比較すると、HRP標識一次抗体を用いた直接法はほぼ同等の感度を示した。図28はリン酸化チロシンBSAのウエスタンブロッティングを同様に直接法と間接法で検出した結果である。間接法に比べ、直接法は同等以上の感度を示した。一般的に、二次抗体を用いた間接法は直接法の10倍感度が高いと言われているが3)、本キットで作製した標識一次抗体を用いた直接法は間接法と同等以上の感度を示し、その有用性が示唆される。
|
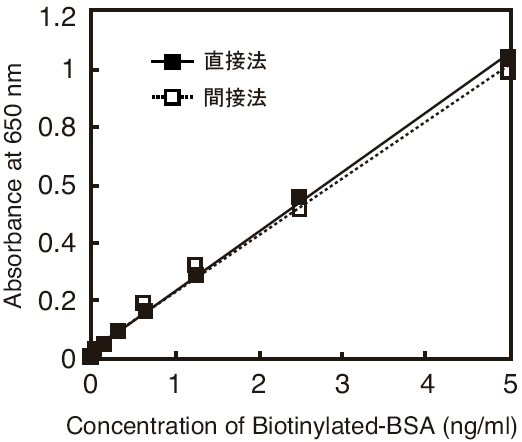
図27 直接法及び間接法によるELISAの感度比較
|
|
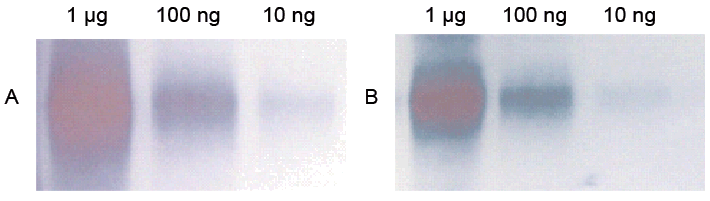
図28 リン酸化チロシンBSAのウエスタンブロッティング(TMB発色)
A:直接法(HRP標識抗リン酸化チロシン抗体で検出)
B:間接法(抗リン酸化チロシン抗体とHRP標識二次抗体で検出)
|
3) 関連技術紹介
発色基質調製方法
A. DAB溶液調製法
|
・
|
9 mgのDAB(Code: D006)を1 ml PBSに溶解し、100X DAB溶液を調製する。
|
|
・
|
30% 過酸化水素5 μlを1 ml PBSで希釈し、200X過酸化水素溶液を調製する。
|
|
・
|
10 μlの100X DAB溶液と5 μlの200X 過酸化水素溶液を1 ml PBSで希釈し、染色溶液とする(染色溶液は保存できないので、用時調製すること)。
|
B. TMB溶液調製法
|
・
|
6 mgのTMBZ(Code: T022)を1 ml DMSOに溶解し、100X TMBZ溶液を調製する。
|
|
・
|
30% 過酸化水素5 μlを1 ml PBSで希釈し、200X 過酸化水素溶液を調製する。
|
|
・
|
10 μlの100X TMBZ溶液と5 μlの200X 過酸化水素溶液を1 ml PBSで希釈し、TMB溶液とする。
|
HRP標識抗体の精製方法
酵素標識された抗体を用いて免疫染色を行った際など、未反応のペルオキシダーゼが非特異吸着の要因となることがある。その際は、小社IgG精製キット(Code: AP01, AP02)を用いてHRP標識抗体を精製することによって、バックグラウンドの上昇を抑えることが期待できる。図29に、小社IgG Purification Kitを用いて、精製したペルオキシダーゼ-IgGのHPLCチャートを示した。未反応のペルオキシダーゼが標識抗体溶液から分離されたことが確認できる。
ただし、本方法は安定な酵素であるペルオキシダーゼに対し可能な方法である。比較的安定性が低い酵素であるアルカリホスファターゼを標識した抗体や蛍光タンパクを標識した抗体では、アフィニティ精製時に使用される酸性溶離液の影響を受け、酵素や蛍光タンパク質が失活するので、適応できない。また、SH標識の場合は、還元操作によって抗体のFc部が還元の影響を受けている可能性が高く、適応は難しいと思われる。
|
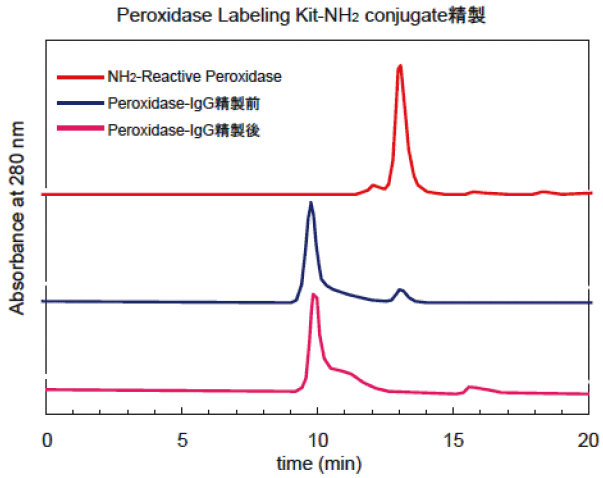
|
図29 精製前後のPeroxidase-IgGのHPLCチャート
<HPLC条件>
カラム:TSKgel G3000PWXL φ78×300 mm,
溶離液:100 mmol/l リン酸緩衝液, pH 6.8,
流 速:0.5 ml/min
|
3. キットを用いAlkaline Phosphataseを標識した抗体の使用例
操作上の注意点など詳細については、取り扱い説明書をご参照いただきたい。なお、キットの取り扱い説明書は小社HPからダウンロードが可能である。
1) ELISAによる感度比較
ELISAプレートに固定化したビオチン標識BSAを、各種方法で標識した抗ビオチン抗体を用いて検出感度を比較した(図30)。Alkaline Phosphatase Labeling Kit-SH(Code: LK13)を用いて標識した抗体は、アミノ基を対象に標識した抗体や他社キットを用いて作製したALP標識抗ビオチン抗体と比較しても、より高感度の検出が可能であることが分かる。
アミノ基標識よりSH標識の方がより高感度の検出が可能である理由としては、ALPの分子量が大きいので抗体認識部位近くのアミノ基に標識されたALPが抗体認識機能に阻害を起こしているためと考えられる。
|
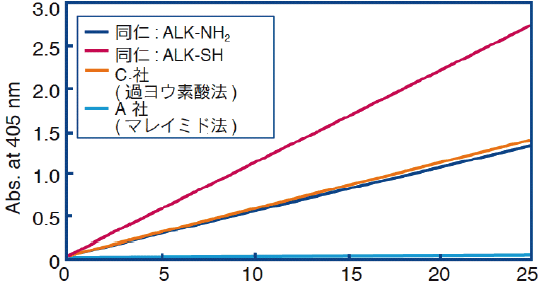
図30 ELISA 実験例
|
XII. Fab'ヘのアルカリホスファターゼ標識方法
1. Fab’フラグメントの利用について
ウサギなどのIgGをペプシンで消化すると、Fc部分が消化されて、多くの場合抗体活性が損なわれないままF(ab')2が得られる。F(ab')2は還元すると2つのFab'に切り離される。EIAにおいて、Fab'を酵素で標識したものは、疎水性の強いFc部が切り離されているので、IgGと比べて非特異吸着が低く抑えられ、かつ分子量も小さいので組織切片などにも浸透しやすいといった利点がある。このような理由から、非特異吸着を低く抑えたい実験系では、Fab’フラグメントはIgGより好んで用いられる。Fab'は抗原結合部位の反対側のヒンジ部分にSH基を持っているので、このSH基を用いて酵素を標識することが可能である。
|
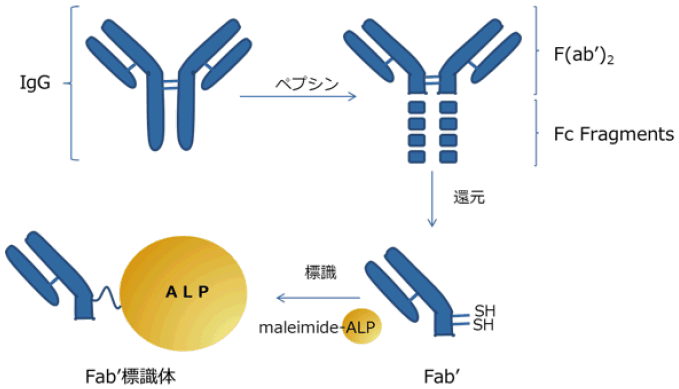
図31 Fab'標識体への酵素標識
|
2. Fab'フラグメントを利用したアルカリホスファターゼ標識法
1) F(ab')2の調製5)
A. 試薬( 緩衝液については緩衝液一覧を参照)
|
・
|
lgG
|
|
・
|
ブタ胃ペプシン
|
|
・
|
緩衝液A、緩衝液B
|
|
・
|
Sephacryl S-200HR(GE ヘルスケア社製)
|
B. 操作
|
(1)
|
lgG 5 mg/0.5 ml を緩衝液A で透析する。
|
|
(2)
|
透析後の試料液にブタ胃ペプシン0.1 ~ 0.2 mg を溶解し、37℃で15~ 20 時間インキュベートする。
|
|
(3)
|
pHを7 に調整して、Sephacryl S-200HR で、緩衝液B を溶離液にして、流速0.35 ml/min でゲル濾過する。
|
|
(4)
|
F(ab')2 画分をとり、濃縮する。280 nm における吸光度を測定し、100 mg/ml のアジ化ナトリウムを1%(v/v)添加して保存する。
|
|
(5)
|
MW=92,000、 ε280 nm=1.48 g-1・L・cm-1を用いて濃度を算出する。タンパク質濃度(mg/ml)={A280 nm/(1.48×MW)}×MW=A280 nm/1.48 またはモル濃度(mol/l)= A280 nm/(1.48×MW) に基づ いて計算する。
|
| ※ |
IgG のペプシンによる消化時間は、動物種によリ異なる。例えば、ウサギIgG では6 時間であるが、ヤギでは1~2 日である。ラット・マウスのlgG 2b は15~30分で完全に減成され、免疫反応性は全く残らない3)。 |
2) Fab' の調製2,5)
A. 試薬( 緩衝液については緩衝液一覧を参照)
|
・
|
F(ab')2
|
|
・
|
緩衝液C、緩衝液D
|
|
・
|
0.1 mol/l 2-メルカプトエチルアミン溶液(11.36 mg の2-メルカプトエチルアミン塩酸塩を緩衝液D 1 ml に溶解する。
|
B. 操作
|
(1)
|
0.1 ~ 3 mg のF(ab')2 を含む緩衝液C 0.45 ml に、2-メルカプトエチルアミン溶液50 μl を添加する。
|
|
(2)
|
37℃で90 分間インキュベートする。
|
|
(3)
|
Ultrogel AcA44 カラムで、緩衝液D を用いて流速0.35 ml/min でゲル濾過する。
|
| (4) |
Fab' 画分をとり280 nm の吸光度を測定し、MW=46,000、ε280 nm=1.48 g-1・L・cm-1 に基づいて濃度を算出する。
|
3) Fab'ヘのアルカリホスファターゼ標識4)
3) -1. 仔ウシ小腸由来アルカリホスファターゼへのマレイミドの導入
A. 試薬( 緩衝液については緩衝液一覧を参照)
B. 操作
|
(1)
|
アルカリホスファターゼ(2 mg)/ 緩衝液E 0.5 ml を同じ緩衝液E を外液にして透析する。
|
|
(2)
|
試料液にEMCS(0.17 mg)/DMF 10 μl を添加して、30℃で30 分間インキュベ-トする。
|
|
(3)
|
Sephadex G-25 カラム(1×45 cm) で、緩衝液F を溶離液にしてゲル濾過し、濃縮する。
|
| (4) |
マレイミド量とアルカリホスファターゼ活性を測定する。
|
3)-2. マレイミド導入アルカリホスファターゼのFab' への標識
A. 試薬( 緩衝液については緩衝液一覧を参照)
|
・
|
マレイミド導入アルカリホスファターゼ
|
|
・
|
Fab'
|
|
・
|
緩衝液D, 緩衝液G, 緩衝液F
|
|
・
|
10 mmol/l 2-メルカプトエチルアミン(緩衝液D 溶液)
|
|
・
|
アジ化ナトリウム
|
B. 操作
|
(1)
|
マレイミド導入アルカリホスファターゼ1 mg(10 nmol) を緩衝液F 0.25 ml に溶解し、Fab' 2.3 mg (50 nmol)/ 緩衝液D 溶液0.25 ml を混合する。
|
|
(2)
|
4℃で20 時間インキュベートする。
|
|
(3)
|
10 mmol/l 2- メルカプトエチルアミン溶液10 μl を添加し、Ultrogel AcA44 カラムでゲルろ過する。溶離液には緩衝液G を用い、流速0.35 ml/min で溶離する。
|
| (4) |
アルカリホスファターゼ活性(3)-4.) を測定し、100 mg/ml BSA と100 mg/ml のアジ化ナトリウムをそれぞれ1%(v/v)添加し保存する。
|
3)-3. マレイミドの定量法5)
EMCS (Code: E018) や GMBS(Code: G005) によりアルカリホスファターゼに導入されたマレイミドの導入数は、以下の方法で算出する。
A. 試薬( 緩衝液については緩衝液一覧を参照)
|
・
|
マレイミド導入アルカリホスファターゼ
|
|
・
|
緩衝液C
|
|
・
|
0.5 mmol/l 2-メルカプトエチルアミン溶液
(0.1 mol/l の2-メルカプトエチルアミン塩酸塩溶液10 μl と50 mmol/l EDTA (pH6.0) 2 ml を混合し調製する。
50 mmol/l EDTA 溶液100 ml 調製には小社2NA(Code: N001) 1.86 g を溶解し1 mol/l NaOHでpH6.0 に調整する。)
|
|
・
|
5 mmol/l 4-PDS 溶液(4-PDS (Code: P017)1.1 mgを緩衝液B 1mlに溶解する)
|
B. 操作
|
(1)
|
マレイミドを導入したアルカリホスファターゼ( 約10 μmol/l)/ 緩衝液C 0.45 ml に、0.5 mmol/l 2- メルカプトエチルアミン溶液50 μl を添加する。コントロール(全発色)として、緩衝液C 0.45 mlに0.5 mmol/l 2-メルカプトエチルアミン溶液50 μlを添加したものを用意し、同様に以下の操作を行う。
|
|
(2)
|
30℃で20 分間インキュベートする。
|
|
(3)
|
5 mmol/l の4-PDS 溶液20 μl 加え、30℃で10 分インキュベートし、324 nmの吸光度を測定する。残存チオール量に相当した4-チオピリドン量(ε324 nm=19,800 M-1・cm-1)が生成されるため、コントロールとの吸光度差が導入されたマレイミド基量に相当する
|
3)-4. アルカリホスファターゼ活性の測定
比色法及び蛍光法があるが、ここでは最も一般的な比色法として、pNPP(4- ニトロフェニルリン酸) による方法を紹介する2)。
A. 試薬( 緩衝液については緩衝液一覧を参照)
|
・
|
緩衝液H
|
|
・
|
5.5 mmol/l pNPP/ 緩衝液H
|
|
・
|
1 mol/l NaOH
|
B. 操作
|
(1)
|
酵素溶液を、緩衝液H で希釈する。
|
|
(2)
|
酵素希釈溶液0.5 ml を30 ~ 37℃で5 分間インキュベートする。
|
|
(3)
|
5.5 mmol/l pNPP/ 緩衝液H 0.5 ml を添加する。
|
|
(4)
|
30 ~ 37℃で10 ~ 100 分間インキュベートする。
|
|
(5)
|
1 mol/l NaOH 0.5 ml を加えて、反応を停止させ、405 nmの吸光度を測定する。予め既知濃度のアルカリホスファターゼを用いて同一法で活性を測定し、作製しておいた酵素濃度- 吸光度の検量線から定量する。また、酵素量は、280 nmの吸光度より、ε280=0.99 cm2・mg-1 とMW=100,000 よリ算出する。
タンパク質濃度(mg/ml)={A280 / (0.99×MW)}×MW=A280/ 0.99 またはモル濃度(mol/l)=A280 / (0.99×MW) に基づいて計算する。
|
<緩衝液一覧>
緩衝液の組成の一覧を下記に示す。
|
緩衝液A :
|
0.1 mol/l 酢酸ナトリウム緩衝液(pH4.5、0.1 mol/lNaCl を含む)
|
|
緩衝液B :
|
0.1 mol/l リン酸ナトリウム緩衝液(pH7.0)
|
|
緩衝液C :
|
0.1 mol/l リン酸ナトリウム緩衝液(pH6.0)
|
|
緩衝液D :
|
0.1 mol/l リン酸ナトリウム緩衝液(pH6.0, 5 mmol/lEDTA を含む) (EDTA-2Na 塩を緩衝液作製途中で終濃度が5 mmol/l となるよう加え、希釈してリン酸濃度が0.1 mol/l にする。すなわち100 ml 調製には小社2NA(Code: N001) を186 mg 用いる)
|
|
緩衝液E :
|
50 mmol/l ホウ酸ナトリウム緩衝液(pH7.6、1mmol/l MgCl2、0.1 mmol/l ZnCl2 を含む)
|
|
緩衝液F :
|
0.1 mol/l Tris-HCl 緩衝液(pH7.0、1 mmol/l MgCl2、0.1 mmol/l ZnCl2 を含む)
|
|
緩衝液G :
|
10 mmol/l Tris-HCl 緩衝液(pH6.8、0.1 mol/l NaCl、1 mmol/l MgCl2、0.1 mmol/l ZnCl2 を含む)
|
|
緩衝液H :
|
0.1 mol/l グリシン-NaOH 緩衝液(pH10.3、1 mmol/l MgCl2、0.25 g/l 卵白アルブミンを含む)
|
XIII. 関連技術紹介
1.標識前の抗体精製法
市販の抗体には、不純物混入や失活を予防するため、安定化剤が含まれていることがある。代表的な安定化剤は、アジ化ナトリウムやBSA, ゼラチンなどである。小社の標識キットでは、低分子のアジ化ナトリウムは、取扱説明書にある最初のフィルトレーションチューブ上の洗浄工程で除去が可能である。しかし、BSAやゼラチンといった高分子は、最初のフィルトレーションチューブ上の洗浄工程で除くことはできない。このような安定化剤が含まれる抗体標品を標識する場合、抗体への標識を阻害するので、予め安定化剤を除去する必要がある(BSA含量が1%程度でも、除去する必要がある)。
1) BSAの除去方法
(1)試薬
IgG Purification Kit-A(もしくはG) (Code: AP01もしくはAP02)
市販の抗体 200 μg
(2)精製方法
IgG Purification Kit 添付の取扱説明書に従って、精製を行う。
2) ゼラチンの除去方法
A, Bいずれかの方法で除去する。
A.コラーゲナーゼ(Collagenase)によるゼラチン分解
 |
(1) 試薬
|
・
|
コラーゲナーゼ(Sigma, #C7826) 3.5 CDU/ml 希釈溶液
|
|
・
|
IgG Purification Kit-A(もしくはG) (Code: AP01もしくはAP02)
|
|
・
|
市販の抗体 200 μg
|
(2)精製方法
|
・
|
0.2% ゼラチンを含む200 μg/ml IgG溶液 1 mlに酵素処理用緩衝液 (100 mmol/l HEPES, pH7.4, 0.36 mmol/l CaCl2含有) 420 μlと酵素処理用緩衝液で調製した 3.5 CDU/ml コラーゲナーゼ希釈溶液 80 μlを加えて混合する。
|
|
・
|
37℃、3時間インキュベートした後、IgG Purification Kit-A(もしくはG)を用いてIgGを単離する。
|
|
※
|
IgG Purification Kitでは、抗体を固定化担体に保持させる際の抗体溶液量を一回当たり200 μlとしている。しかし、上記操作でコラーゲナーゼ処理した抗体溶液量は、約1.5 mlとなるため、IgGを担体に保持させる操作を8回(200 μl×7, 100 μl×1)に分けて行う。
|
|
※
|
上記の方法で得られる抗体の回収率:45~50%
|
|
|
図32 ゼラチン除去精製前後のSDS-PAGE
1: ゼラチン含有IgG溶液
2: 精製後のIgG溶液
|
B. 300K 限外ろ過チューブを用いたゼラチン除去
 |
(1) 試薬
|
・
|
300K フィルトレーションチューブ(Pall社 ナノセップ遠心ろ過デバイス(製品コード:OD300C33)
|
|
・
|
IgG Purification Kit-A(もしくはG) (Code: AP01もしくはAP02)
|
|
・
|
市販の抗体 200 μg
|
(2)精製方法
|
・
|
0.1% ゼラチンを含む200 μg/ml IgG溶液 1 mlを300K フィルトレーションチューブ 2本に分けて限外ろ過を行う(200 μl×2, 100 μl×1, 13,500 x g)。
|
|
・
|
その後、回収溶液500 μlをIgG Purification Kit-A(もしくはG)を用いてIgGを単離する。
|
|
※
|
回収溶液500 μlに対し、IgG Purification KitのWashing Buffer 50 μlを添加し、精製を行う。 ゲルへの吸着操作は5回繰り返す。
|
|
※
|
上記の方法で得られる抗体の回収率:35~45%
|
|
|
図33 ゼラチン除去精製前後のSDS-PAGE
1: IgG
2: ゼラチン含有IgG溶液
3: 300K限外濾過のみのIgG溶液
4: 300K限外濾過+ IgG Purification Kit - Gで精製後のIgG溶液
|
XIV. 関連製品
※ Ab-10シリーズを含むアミノ基への標識試薬/キットの注意点
標識操作により、抗体中のアミノ基に標識体が結合します。そのため抗体によっては抗原認識能が失われる場合があります。
ご不明な点は、小社カスタマーサポートへお問合せ下さい。
|
製品名
|
対象酵素
|
品コード
|
備考
|
| DAB |
HRP
|
D006
|
過酸化水素、HRP存在下で免疫染色など
に使用。
|
| TMBZ |
T022
|
TMBと同一構造。水溶性は低い。過酸化
水素、HRP存在下で青緑色に発色。
|
| TMBZ・HCl |
T039
|
TMBZの塩酸塩タイプ。水溶性は高い。 |
| SAT-3 |
S302
|
水溶性が高く、TMBと同様に使用すること
ができる。
|
※1 小社では他にもスペーサー長の異なるマレイミド導入試薬をご用意している。詳しくはHPをご参照いただきたい。




