はじめに
脂肪酸は、生体がエネルギーを得るために重要な物質です。脂肪酸取り込み能は肥満や糖尿病などの疾患に関わるだけでなく、がん細胞における代謝指標の 1 つでもあります。細胞増殖が活発ながん細胞は多くの脂質を必要とするため、細胞内における脂肪酸合成や細胞外からの脂肪酸取り込みが活発に行われています。そのため、がん細胞の脂肪酸代謝経路をターゲットとした多くの薬剤が開発されています。1)
本キットに含まれるFatty acid analogは脂肪酸トランスポーターを介して細胞内に取り込まれるため、蛍光顕微鏡やフローサイトメーター、プレートリーダーなどの蛍光測定法により、細胞の脂肪酸取り込み能力を測定することが可能です。また、細胞内に取り込まれなかったFatty acid analogの蛍光を消去する試薬も組み込まれているため、細胞の洗浄操作を行うことが難しい場合でも簡便に測定することができます。
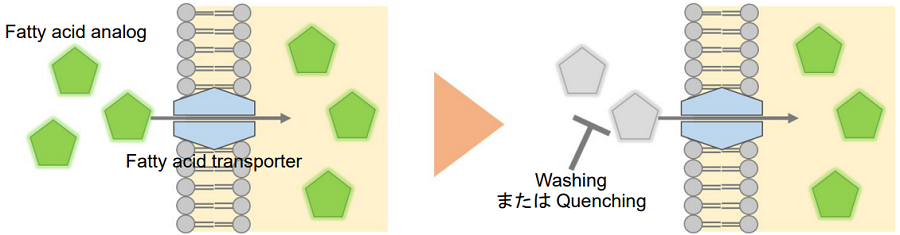
図1 Fatty Acid Uptake Assay Kit の測定原理
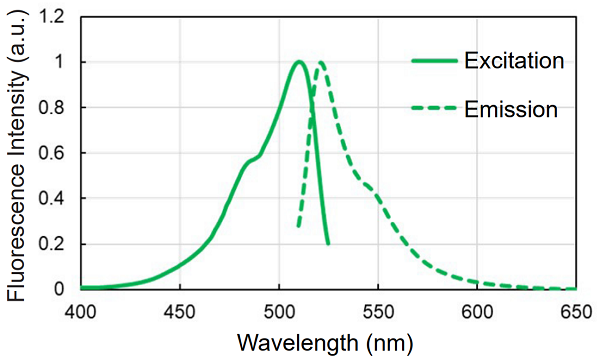
図2 Fatty Acid Uptake Probe の蛍光特性
キット内容
| Fatty Acid Uptake Probe | × 1 |
| Quenching Buffer ( 赤キャップ ) | 11 ml × 1 |
| Washing Buffer (10×) | 11 ml × 1 |
保存条件
0-5℃ で保存して下さい。
必要なもの (キット以外)
- 無血清培地
- 蛍光検出器( 蛍光顕微鏡、蛍光プレートリーダー、フローサイトメーター )
- 20-200 μl のマルチチャンネルピペット
- 100-1000 μl、20-200 μl、2-20 μl マイクロピペット
- Dimethyl sulfoxide (DMSO)
- 1.5 ml マイクロチューブ
- コニカルチューブ
使用上のご注意
- キットの中の試薬は、室温に戻してからご使用下さい。
- 輸送中の振動等により、内容物がチューブ壁面やキャップ裏面に付着している場合がありますので、内容物を底面に落とした後に開封して下さい。
- 検出器毎の推奨測定波長は表 1 を参照して下さい。
表1 検出器別の推奨測定波長
| 蛍光プレートリーダー | 蛍光顕微鏡 | フローサイトメーター |
| 励起波長 480-520 nm 蛍光波長 515-560 nm |
共焦点レーザー顕微鏡: 励起波長 488 nm 蛍光波長 500-550 nm 落射型蛍光顕微鏡: GFPまたはFITCフィルター |
励起波長 488 nm FITCフィルター |
測定方法の選択
表 2 を参照し、細胞種や実験系に応じて Washing Buffer (10×) または Quenching Buffer のいずれかを選択して下さい。
表 2 Washing Buffer (10×) または Quenching Buffer の選択ガイド
〇:測定可能、×:測定不可、△:注釈参照
| Washing Buffer (10×) | Quenching Buffer | ||||
| 付着細胞 | 浮遊細胞 | 付着細胞 | 浮遊細胞 | ||
| 洗浄操作の必要性 | 必要 | 不要 | |||
| プレートリーダーの使用 | ボトムリーディング (透明底プレート) |
〇 | 〇 | △※1 | |
| トップリーディング | 〇 | × | |||
| 落射型蛍光顕微鏡 | 〇 | 〇 | |||
| 共焦点レーザー顕微鏡 | 〇 | △※2 | |||
| フローサイトメーター | 〇 | × | |||
- 細胞がプレートの底を覆う程度(目安:3×105 cells/well) に播種し、しばらく静置させて細胞をプレートの底に沈めることで測定することは可能です。
- 共焦点レーザー顕微鏡で透過光観察を行う場合、488 nm レーザーを用いた透過光観察はできません。透過光観察を行う場合は Quenching Buffer を Washing Buffer solution で 10 倍希釈してご使用いただくか、640 nm レーザーを用いて透過光観察を行って下さい。
- 詳細については製品Webページに掲載しています。
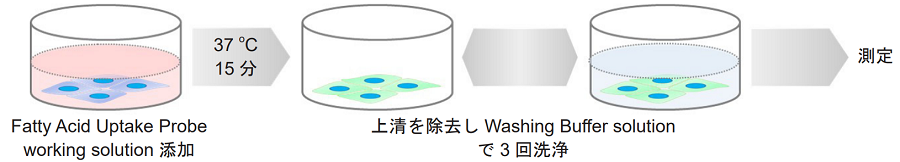
(a) Washing Buffer (10×) を使用する場合
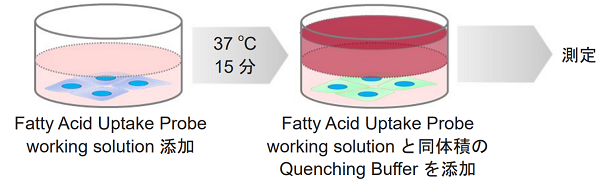
(b) Quenching Buffer を使用する場合
溶液調整
Fatty Acid Uptake Probe stock solutionの調製
Fatty Acid Uptake ProbeにDMSO 24 μlを加え、ピペッティングにより溶解する。
- Fatty Acid Uptake Probe stock solutionは冷凍保存(-20℃)して下さい(1ヶ月間安定)。
- Fatty Acid Uptake Probeの性質上、保管や輸送の条件により色素がチューブに沈着する場合がありますが、キットの性能や結果 には影響を与えませんのでそのままお使い下さい。
Fatty Acid Uptake Probe working solutionの調製
Fatty Acid Uptake Probe stock solutionを無血清培地で500倍希釈する。
- Fatty Acid Uptake Probe working solutionの調製は表3を参照して下さい。
- 調製後のFatty Acid Uptake Probe working solutionは保存できません。その日のうちにお使い下さい。
表 3 Fatty Acid Uptake Probe working solution (1ウェルあたり)の調製例
| 付着細胞 | 浮遊細胞 | ||||
|
培養器材 |
6-well (1.5 ml/well) |
24-well (0.3 ml/well) |
96-well |
35-mm dish (1.5 ml/well) |
1.5-ml microtube |
| 無血清培地量 | 1500 μl | 300 μl | 100 μl | 1500 μl | 500 μl |
| Fatty Acid Uptake Probe stock solution |
3 μl | 0.6 μl | 0.2 μl | 3 μl | 1 μl |
Washing Buffer solutionの調製
Washing Buffer (10×)を超純水で10倍希釈する。
- Washing Buffer solutionの調製は表4を参照して下さい。
- 希釈したWashing Buffer solutionは使用する当日に必要な分量を調製し、その日のうちにお使い下さい。
表 4 培養器材別Washing Buffer solutionの推奨使用量
| 付着細胞 | 浮遊細胞 | ||||
|
培養器材 |
6-well | 24-well |
96-well |
35-mm dish |
1.5-ml microtube |
| Washing Buffer solution 必要量 |
1.5 ml/well | 300 μl/well | 200 μl/well | 1.5 ml/well | 500 μl/tube |
操作
蛍光イメージング・プレートリーダー測定 -Washing Buffer solutionを用いる場合-
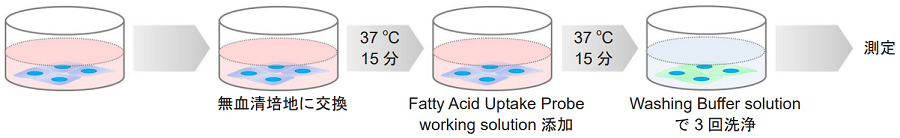
<付着細胞>
-
ディッシュまたはマイクロプレートに播種した細胞を準備する。
- 培地を除去し、無血清培地で2回洗浄する。
- 無血清培地を添加し、インキュベーター(37 ℃、5%CO2存在下)で15分間静置する。
- 上清を除去した後、Fatty Acid Uptake Probe working solutionを添加し、インキュベーター(37 ℃、5%CO2存在下)で15分間静置する。
- 上清を除去した後、Washing Buffer solutionで3回洗浄する。※
- Washing Buffer solutionを添加し、蛍光顕微鏡で観察またはプレートリーダーで測定する。
- バックグラウンドが高い場合は、再度Washing Buffer solutionで洗浄して下さい。
<浮遊細胞>
- マイクロチューブに細胞を準備する。
- 300×gで5分間遠心し、上清を除去する。
- 無血清培地を加え、ピペッティングにより懸濁後、300×gで5分間遠心し、上清を除去する。この操作を2回繰り返す。
- 無血清培地を添加し、ピペッティングにより懸濁後、インキュベーター(37 ℃、5%CO2存在下)で15分間静置する。
- 300×gで5分間遠心し、上清を除去する。
- Fatty Acid Uptake Probe working solutionを添加し、ピペッティングにより懸濁後、インキュベーター(37 ℃、5%CO2存在下)で15分間静置する。
- 300×gで5分間遠心し、上清を除去する。
- Washing Buffer solutionを加え、ピペッティングにより懸濁後、300×gで5分間遠心し、上清を除去する。この操作を3回繰り返す。※
- Washing Buffer solutionを添加し、蛍光顕微鏡で観察またはプレートリーダーで測定する。
- バックグラウンドが高い場合は、再度Washing Buffer solutionで洗浄して下さい
蛍光イメージング・プレートリーダー測定 -Quenching Bufferを用いる場合-
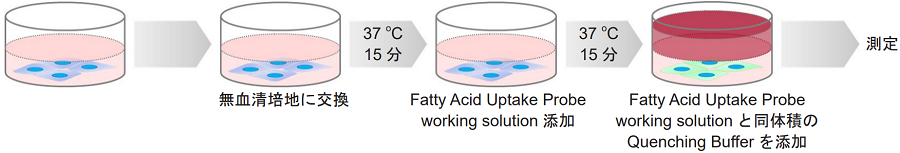
表5 培養器材別Quenching Bufferの推奨使用量
| 付着細胞 | 浮遊細胞 | ||||
|
培養器材 |
6-well | 24-well |
96-well |
35-mm dish |
1.5-ml microtube |
| Quenching Buffer 必要量 |
1.5 ml/well | 300 μl/well | 100 μl/well | 1.5 ml/well | 500 μl/tube |
<付着細胞>
- ディッシュまたはマイクロプレートに播種した細胞を準備する。
- 培地を除去し、無血清培地で2回洗浄する。
- 無血清培地を添加し、インキュベーター(37 ℃、5%CO2 存在下)で15分間静置する。
- 上清を除去した後、Fatty Acid Uptake Probe working solutionを添加し、インキュベーター(37 ℃、5%CO2存在下)で15分間静置する。
- Fatty Acid Uptake Probe working solutionと同体積のQuenching Bufferを添加し、蛍光顕微鏡で観察またはプレートリーダー(ボトムリーディング)で測定する。
<浮遊細胞>
- マイクロチューブに細胞を準備する。
- 300×gで5分間遠心し、上清を除去する。
- 無血清培地を加え、ピペッティングにより懸濁後、300×gで5分間遠心し、上清を除去する。この操作を2回繰り返す。
- 無血清培地を添加し、ピペッティングにより懸濁後、インキュベーター(37 ℃、5%CO2存在下)で15分間静置する。
- 300×gで5分間遠心し、上清を除去する。
- Fatty Acid Uptake Probe working solutionを添加し、ピペッティングにより懸濁後、インキュベーター(37 ℃、5%CO2存在下)で15分間静置する。
- Fatty Acid Uptake Probe working solutionと同体積のQuenching Bufferを添加し、蛍光顕微鏡で観察する。
- 浮遊細胞を用いたプレートリーダーの測定は、「Washing Buffer solutionを用いる場合」の方法を推奨します。
フローサイトメーター測定
<付着細胞>
- ディッシュまたはマイクロプレートに播種した細胞を準備する。
- 培地を除去し、無血清培地で2回洗浄する。
- 無血清培地を添加し、インキュベーター(37 ℃、5%CO2 存在下)で15分間静置する。
- 上清を除去した後、Fatty Acid Uptake Probe working solutionを添加し、インキュベーター(37 ℃、5%CO2存在下)で15分間静置する。
- 上清を除去した後、Washing Buffer solutionで3回洗浄する。
- セルスクレーパーまたはトリプシン処理により細胞を剥離し、フローサイトメーターで測定する。
<浮遊細胞>
- マイクロチューブに細胞を準備する。
- 300×gで5分間遠心し、上清を除去する。
- 無血清培地を加え、ピペッティングにより懸濁後、300×gで5分間遠心し、上清を除去する。この操作を2回繰り返す。
- 無血清培地を添加し、ピペッティングにより懸濁後、インキュベーター(37 ℃、5%CO2存在下)で15分間静置する。
- 300×gで5分間遠心し、上清を除去する。
- Fatty Acid Uptake Probe working solutionを添加し、ピペッティングにより懸濁後、インキュベーター(37 ℃、5%CO2存在下)で15分間静置する。
- 300×gで5分間遠心し、上清を除去する。
- Washing Buffer solutionを加え、ピペッティングにより懸濁後、300×gで5分間遠心し、上清を除去する。この操作を3回繰り返す。
- フローサイトメーターで測定する。
実験例
脂肪酸トランスポーター阻害剤CB-2処理によるHepG2細胞の脂肪酸取り込み能変化の評価
<蛍光イメージングおよびプレートリーダー測定>
- HepG2細胞(1×104 cells/well、10% fetal bovine serum、1% penicillin-streptomycinを含むDMEM培地)を96穴ブラックプレート(透明底)に播種し、インキュベーター(37℃、5%CO2存在下)で一晩培養した。
- 培地を除去し、DMEM培地(serum-free) 200 μlで2回洗浄した。
- 0 μmol/lまたは20 μmol/l CB-2を含むDMEM培地(serum-free) 100 μlを添加し、インキュベーター(37℃、5%CO2存在下)で15分間静置した。
- 上清を除去した後、DMEM培地(serum-free)を用いて調製したFatty Acid Uptake Probe working solution 100 μlを添加し、インキュベーター(37℃、5%CO2存在下)で15分間静置した。
- Quenching Buffer 100 μlを添加し、蛍光顕微鏡(KEYENCE社 BZ-X800)観察およびプレートリーダー(TECAN社 Infinite M200 PRO、ボトムリーディング)測定を行った。
<フローサイトメーター測定>
- HepG2細胞(5×105 cells/well、10% fetal bovine serum、1% penicillin-streptomycinを含むDMEM培地)を6穴プレートに播種し、インキュベーター(37℃、5%CO2存在下)で一晩培養した。
- 培地を除去し、DMEM培地(serum-free) 1.5 mlで2回洗浄した。
- 0 μmol/lまたは20 μmol/l CB-2を含むDMEM培地(serum-free) 1.5 mlを添加し、インキュベーター(37℃、5%CO2存在下)で15分間静置した。
- 上清を除去した後、DMEM培地(serum-free)を用いて調製したFatty Acid Uptake Probe working solution 1.5 mlを添加し、インキュベーター(37℃、5%CO2存在下)で15分間静置した。
- 上清を除去した後、Washing Buffer solution 1.5 mlで3回洗浄した。
- セルスクレーパーで細胞を剥離し、フローサイトメーター(Becton Dickinson社 FACSCanto II)で測定した。
-
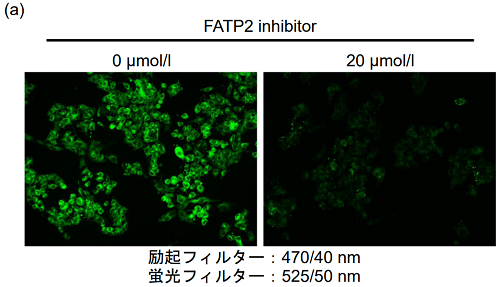
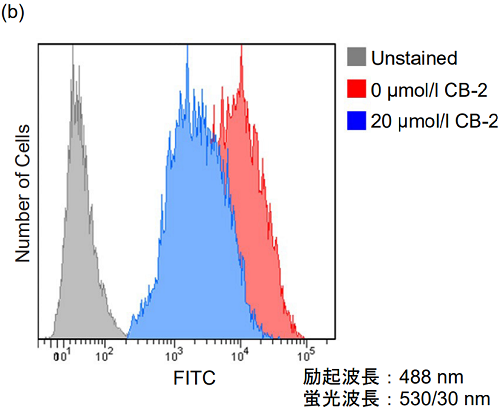
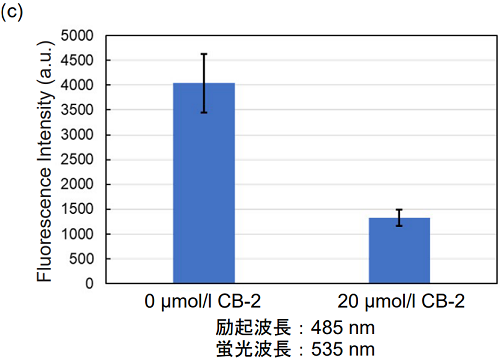
図3. 脂肪酸トランスポーター阻害剤によるHepG2細胞の脂肪酸取り込み能の変化
(a) 蛍光イメージング
(b) フローサイトメーター測定
(c) プレートリーダー測定CB-2処理によりHepG2細胞の脂肪酸取り込み能が低下することを確認した。
参考文献
1) M. Zaoui, et al., Cancers, 2019, 11, 2012.
よくある質問/参考文献
UP07: Fatty Acid Uptake Assay Kit
Revised Apr., 07, 2025


 を押して省略できます。
を押して省略できます。