はじめに
近年、硫黄原子が連結したパースルフィドやポリスルフィドのようなサルフェン硫黄 (Sulfane Sulfur) を含む分子種が生体内に多く存在していることが明らかにされています。このような分子種は、硫化水素の産生や貯蔵、放出だけでなく、S-スルフヒドリル化などのタンパク質内チオールをターゲットとしたシグナル伝達にも関与していることが示唆されており、非常に注目されています。SSP4 (Sulfane Sulfur Probe 4) は、サルフェン硫黄と特異的に反応して強い蛍光 (λex=482 nm, λem=515 nm)を発する試薬であり、サルフェン硫黄含有分子種の蛍光検出や細胞内解析に有用です。
- 本試薬を細胞内サルフェン硫黄含有分子の解析に利用する場合、試薬を細胞内に導入するためカチオン性界面活性剤であるCetyltrimethylammonium bromide (CTAB)を使用してください。
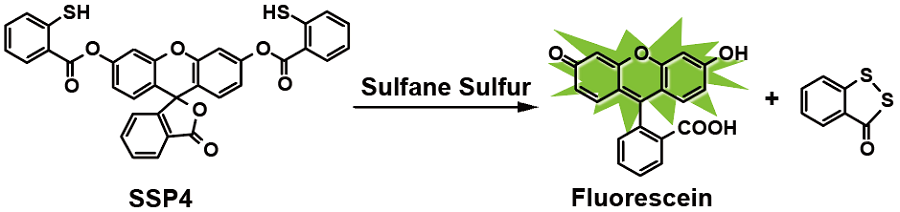
Fig. 1 SSP4とサルフェン硫黄の反応
-
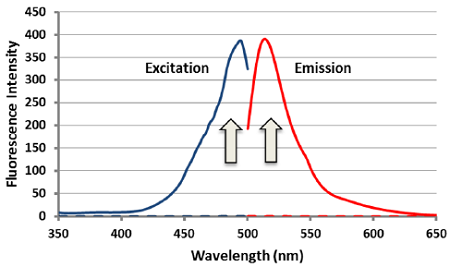
Fig. 2 サルフェン硫黄との反応に伴う
SSP4の励起および蛍光スペクトル変化
-
Fig. 3 サルフェン硫黄 (Sulfane Sulfur) を含む分子種
内容
| SSP4 | 1 mg x 1 |
保存条件
遮光、-20℃以下で保存してください。
必要なもの
- Dimethyl sulfoxide (DMSO)
- 無血清培地
- PBS
- Cetyltrimethylammonium bromide (CTAB)
- マイクロピペット
溶液調製
- 10 mmol/l SSP 4 Stock Solution
SSP4 1mgを含むチューブにDMSO 165 μlを添加し、ピペッティングにより溶解する。- この溶液を少量小分けし、-20 ℃以下で保存してください。約2ヶ月間は安定です。
- 0.5 mmol/l CTABを含む無血清培地
CTAB 36.4mgを1.5ml遠心チューブに秤量し、超純水1 mlを添加する。ドライヤーなどで加温溶解し、100 mmol/l CTAB水溶液とする。この水溶液を無血清培地で200倍希釈し、0.5 mmol/l CTABを含む無血清培地とする。 - SSP4 Working Solution
終濃度が5-20 μmol/lとなるように10 mmol/l SSP4 Stock Solutionを、0.5 mmol/l CTABを含む無血清培地に添加する。
例:10 mmol/l SSP4 Stock Solution 10 μlを0.5 mmol/l CTABを含む無血清培地 5 mlに添加すると、20 μmol/l SSP4 Working Solutionとなる。
操作
- 蛍光顕微鏡観察が可能なプレートあるいはディッシュに細胞を播種し、培養する。
- 上清を除去した後、細胞を無血清培地で洗浄する。
- 調製したSSP4 Working Solutionを細胞に添加し、CO2インキュベーター (37℃)内で15分間静置する。
- 上清を除去した後、PBSで2回洗浄する。
- PBSを添加し、蛍光顕微鏡で観察する。
実験例1
サルフェン硫黄ドナーおよびサルフェン硫黄消去剤添加による細胞内サルフェン硫黄量変化の解析
- 96-well black clear bottom plateにCHO細胞 を血清入り培地(DMEM)104 cells/well となるように播種し、CO2インキュベーター(37℃)内で一晩培養した。
- 上清を除去した後、無血清培地(DMEM)で細胞を2回洗浄した。
- 100 μmol/lサルフェン硫黄ドナーNa2S3 (Sodium trisulfide) 、あるいは1 mmol/lサルフェン硫黄消去剤NaCN (Sodium cyanide)を含む無血清培地(DMEM)100 μlを各ウェルに添加し、CO2インキュベーター(37℃)内で15分間静置した。
- 上清を除去した後、無血清培地(DMEM)で細胞を2回洗浄した。
- 20 μmol/l SSP4 Working Solution 100 μlをウェルに添加し、CO2インキュベーター(37℃)内で15分間静置した。
- 上清を除去した後、PBSで細胞を2回洗浄した。
- PBS 100 μlをウェルに添加した後、蛍光顕微鏡を用いて細胞を観察した。
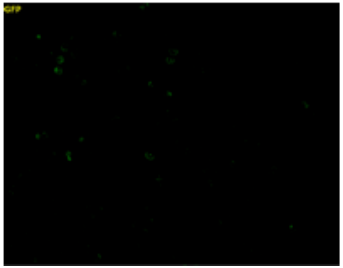 未処理 |
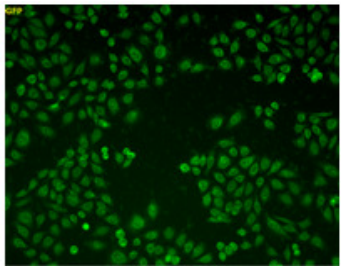 100 μmol/l Na2S3処理 |
| (露光時間 1000 msec) | |
Na2S3(サルフェン硫黄ドナー)で処理した細胞内に強い蛍光が観察された。
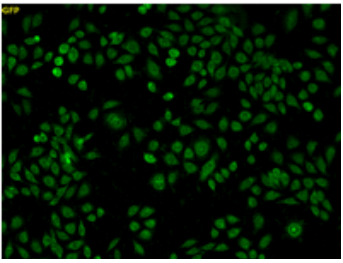 未処理 |
 1 mmol/l NaCN処理 |
| (露光時間 2000 msec) | |
NaCN(サルフェン硫黄消去剤)で処理した細胞内には、未処理の細胞(内因性のサルフェン硫黄)で観察された蛍光が観察されなかった。
実験例2
硫化水素(H2S)と活性酸素(窒素)種との反応によるサルフェン硫黄含有物質の生成確認
- 100 μmol/l活性酸素(窒素)種と100 μmol/l Na2Sを含む溶液 (PBS)を室温で10分間静置した。
- 操作1.の溶液に、終濃度が10 μmol/lとなるように10 mmol/l SSP4 Stock Solutionを添加し、室温で30分間静置した。
- 操作2.の溶液の515 nm蛍光強度 (λex=482 nm) を、蛍光分光光度計を用いて測定した。
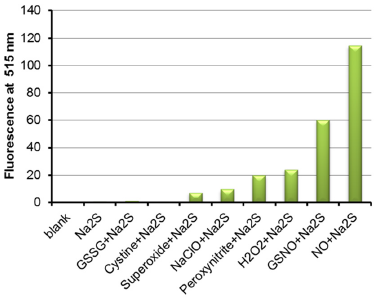
硫化水素(H2S)と各活性酸素(窒素)種との反応によってサルフェン硫黄含有分子が生成されることが確認された。また、その中でも硫化水素(H2S)と一酸化窒素(NO)の反応は非常に効率が高いことが示された。
本試薬は、サルフェン硫黄含有分子の生成解析にも有用である。
参考文献
- W. Chen, C. Liu, B. Peng, Y. Zhao, A. Pacheco and M. Xian, Chem. Sci., 2013, 4, 2892.
- T. Ida, T. Sawa, H. Ihara. Y. Tsuchiya, Y. Watanabe, Y. Kumagai, M. Suematsu, H. Motohashi, S. Fujii, T. Matsunaga, M. Yamamoto, K. Ono, N. O. Devarie-Baez, M. Xian, J. M Fukuto, and T. Akaike, Proc. Natl. Acad. Sci. USA., 2014, 111, 7606.
- E. Marutani, M. Sakaguchi, W. Chen, K. Sasakura, J. Liu, M. Xian, K. Hanaoka, T. Nagano, and F. Ichinose, Med. Chem. Commun., 2014, 5, 1577.
- M. Sakaguchi, E. Marutani, H-S. Shin, W. Chen, K. Hanaoka, M. Xian, and F. Ichinose, Anesthesiology. 2014, 121, 1248.
よくある質問/参考文献
SB10: -SulfoBiotics- SSP4
Revised Aug., 10, 2023


 を押して省略できます。
を押して省略できます。

