はじめに
ROS (Reactive oxygen species)は主にミトコンドリアでのATP合成過程で発生する反応性の高い酸素種です。情報伝達のシグナル物質としての役割や、マクロファージなどの免疫機能の一部として重要である一方、DNAやタンパク質に対し酸化剤として作用することで様々な疾病や老化を引き起こす要因となります。
最近の研究では、二価鉄を触媒とし誘発するフェントン反応によって起こる新しい細胞死 (フェロトーシス)の分野においてもROSが注目されてきており、ROSを検出する意義はますます高まってきています1)。ROSを測定する色素としてDCFH-DAが広く使われますが、感度が低くバックグラウンド蛍光との差が明瞭ではありません。本キットはROSを高感度に検出でき、キット付属のBufferを使って染色することで、より細胞にダメージを与えにくい状態でROSを検出することができます。
キット内容
| Highly Sensitive DCFH-DA Dye | 10 μl×1 |
| Loading Buffer (10x) | 1 ml×1 |
保存条件
-20℃ にて保存して下さい。
必要なもの (キット以外)
- 蛍光検出器 (蛍光顕微鏡、蛍光プレートリーダーもしくはフローサイトメーター)
- インキュベーター(37℃)
- マイクロピペット(100–1000 μl, 0.5–10 μl)
- コニカルチューブ
- Hanks' Balanced Salt Solution (HBSS)
使用上のご注意
- キット中の試薬は使用前に室温に戻して融解してからご使用下さい。
- 輸送中の振動等により、内容物がスクリューキャップマイクロチューブ壁面やキャップ裏面に付着している場合がありますので、開封前に内容物を底面に落としてからご使用ください。
- 検出器毎の推奨測定波長は表1を参照してください。
表1 検出器別の推奨測定波長
| 検出器 | 蛍光プレートリーダー | 蛍光顕微鏡 | フローサイトメーター |
| 測定波長 | Excitation: 490–520 nm Emission: 510–540 nm |
・共焦点レーザー顕微鏡 Ex/Em: 488/500–550 nm ・落射型顕微鏡 GFPもしくはFITCフィルター |
FITCフィルター |
溶液調製
Loading Buffer solutionの調製
Loading Buffer (10x)を超純水を用いて10倍に希釈する。容器毎の必要量は表2を参照してください。
- 希釈したLoading Buffer solutionは使用する当日に必要な分量を調製し、その日の内にご使用ください。 残ったLoading Buffer (10x)は4℃で保存してください。
表2 容器別 Loading Buffer solutionの推奨使用量
| 容器 | 35-mmdish | ibidi 8-well plate | 96-well black plate (clear bottom) |
Sample tube (Flow Cytometor) |
| 必要量 | 2 ml/dish | 200 μl/well | 100 μl/well | 0.5 ml/sample |
Highly Sensitive DCFH-DA Working solutionの調製
Highly Sensitive DCFH-DA DyeをLoading Buffer solutionで1000倍希釈し、Working solutionを調製する。
- Working solutionは保存できません。調製したその日の内にご使用ください。
操作
- 表3を参考に細胞をディッシュまたはプレートに播種し、5% CO2存在下、37℃設定のインキュベーター内で 一晩培養する。
表3 検出器別 細胞播種容器 検出器 蛍光プレートリーダー 蛍光顕微鏡 フローサイトメーター 容器 96-well black plate (clear bottom) 96-well black plate (clear bottom)
ibidi 8-well plate
35 mm dish6-well plate - 培地を取り除き、HBSSを用いて細胞を2回洗浄する。
- 上澄みを液を除去し、調製したWorking solutionを添加し、インキュベーター(37℃, 5% CO2存在下)で30分間インキュベートする。
- Working solutionを除去し、HBSSを用いて細胞を2回洗浄する。
- 上清除去後、薬剤等で処理する。
- 上清を吸引除去しHBSSを用いて細胞を2回洗浄後、HBSSを加え検出器で測定する。
- 操作5.の薬剤処理時間が2時間以上となる場合は操作3.と操作5.の順番を逆にしてください。
- 接着細胞の種によっては染色後の洗浄操作により細胞が剥がれやすくなる場合があります。その場合は細胞を播種後の培養時間を延ばしてください。
実験例1
過酸化水素処理したHeLa細胞の細胞内過酸化水素検出
- 96 well Black plateもしくは6 well plateにHeLa細胞 (1×104 cells/ml, MEM, 10% fetal bovine serum,1% penicillin-streptomycin)を播種し、インキュベーター内 (37℃、 5% CO2存在下)で二晩培養した。
- 培地を取り除きHBSSで細胞を2回洗浄後、DCFH-DAもしくは、Highly Sensitive DCFH-DA Dye workingsolutionを添加し、インキュベーター内 (37℃、 5% CO2存在下)で30分間インキュベートした。
- Working solutionを除去し、HBSSを用いて細胞を2回洗浄した。
- 上清除去後、100 μmol/lの過酸化水素/HBSS溶液を加えインキュベーター内 (37℃、5% CO2存在下)で30分間インキュベートした。
- 上清を吸引除去しHBSSを用いて細胞を2回洗浄後、HBSSを加え各検出器で測定した。
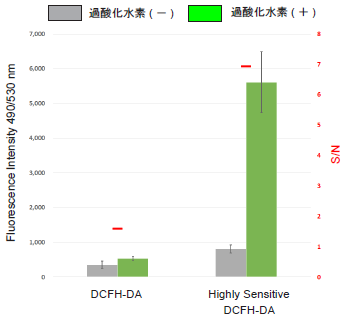
図1 蛍光プレートリーダーによるHeLa細胞
の細胞内過酸化水素の検出
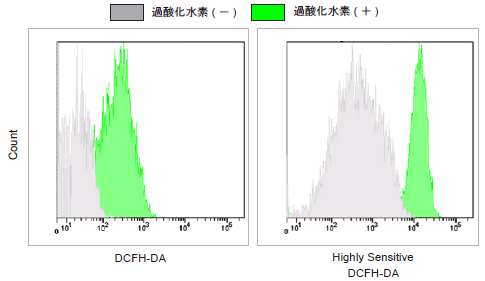
<検出条件>FITCフィルター
図2 フローサイトメーターによるHeLa細胞
の細胞内過酸化水素の検出
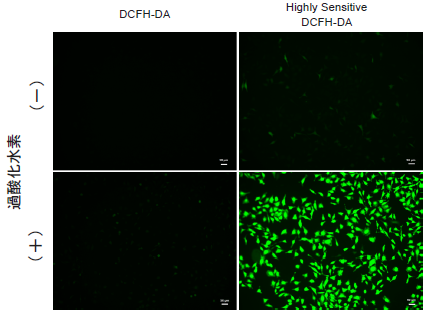
<検出条件>GFPフィルター
図3 蛍光顕微鏡によるHeLa細胞内の過酸化水素検出
実験例2
Lipopolysaccharide (LPS)処理したRAW264.7細胞の内在性ROS検出
- ibidi 8 well plateにRAW264.7細胞 (2×104 cells/ml, DMEM, 10% fetal bovine serum,1% penicillin-streptomycin)を播種し、インキュベーター内 (37℃、 5% CO2存在下)で一晩培養した。
- 培地を取り除き、DMEM培地で希釈した500 ng/ml濃度のLPS/DMEMを加え、インキュベーター内 (37℃、 5% CO2存在下)で20時間培養した。
- 上清を取り除きHBSSで細胞を2回洗浄後、Highly Sensitive DCFH-DA Dye working solutionを添加し、インキュベーター内 (37℃、 5% CO2存在下)で30分間インキュベートした。
- Working solutionを除去し、HBSSを用いて細胞を2回洗浄後HBSSを加え蛍光顕微鏡で観察した。
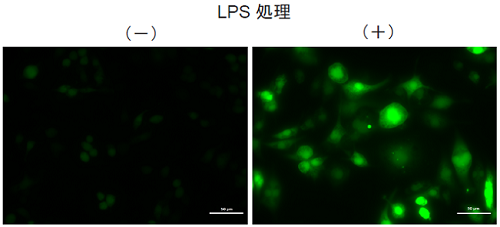
<検出条件>GFPフィルター
図4 LPS処理によるRAW264.7細胞内のROS検出
参考文献
- Li J., Cell Death. Dis., 2020, 88, 11
よくある質問/参考文献
R252: ROS Assay Kit -Highly Sensitive DCFH-DA-
Revised May., 31, 2023


 を押して省略できます。
を押して省略できます。