はじめに
一酸化窒素(NO)が情報伝達物質として多くの生理的現象に関与していることが明らかとなり、NOに関する研究が盛んに行われています。NO2- の定量法であるGriess法や、DAN (2,3-Diaminonaphthalene)を用いた蛍光法は、NOの間接的定量法として広く利用されています。
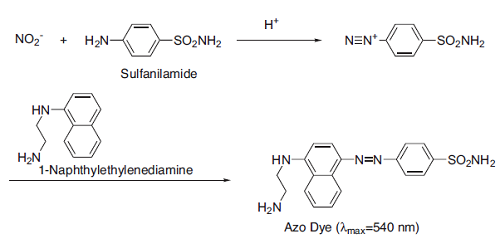
このうちGriess 法は NOが酸化されて生じる NO2- によるジアゾニウム塩化合物とナフチルエチレンジアミンのアゾカップリングを利用して検出する方法であるため、NOを直接測定するものではなく NOが変化した NO2- を測定するという間接的な方法ではありますが、特別な装置や技術を必要としないという利点があります。
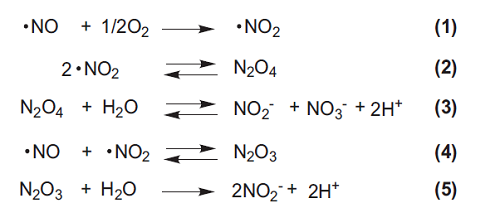
しかしながら、Griess法は NO2- としか反応できないのに対し、NOは水中で右記のように加水分解され最終的にNO2- と NO3- になります。発生した NOを測定するためにはNO2- と同時に NO3- についても測定する必要があるので、酵素等を用いて NO3- を NO2- に還元する必要があります。
本キットは還元酵素を含み、NO3- をNO2- に還元できるのでNO2- とNO3- 両方の濃度測定が可能です。本キットは10~100 μmol/l の濃度域に適しています。より低濃度の測定が必要な場合は「NO2/NO3 Assay Kit - FX」をご利用ください。
キット内容
| NaNO2標準溶液 (100 μmol/l) | x 1 |
| NaNO3標準溶液(100 μmol/l) | x 1 |
| 試薬A | x 1 |
| 試薬B | x 1 |
| 緩衝溶液(20 mmol/l, pH7.6) | x 1 |
| 補酵素(緩衝溶液1.2 ml を加え溶解して使用して下さい) | x 1 |
| 還元酵素(緩衝溶液1.2 ml を加え溶解して使用して下さい) | x 1 |
保存条件
冷蔵保存(0-5°C)して下さい。開封後も冷蔵保存して下さい。
キット以外に必要なもの
- マイクロプレートリーダー
(フィルターは540 nm のものが最適ですが、ない場合には 530 nm~580 nm のフィルターを使用してください。) - 96穴マイクロプレート ・マイクロピペット、チップ及びシリンジ
- 必要に応じて、除タンパク用の装置、試薬をご用意ください
使用上の注意
- 酵素溶液、補酵素溶液は氷浴上で使用して下さい。また、溶解後数回に分けて使う場合にはアシストチューブなどに分注し冷蔵保存して下さい。ただし、長期間保存すると高濃度域が測定できなくなることがありますので、2週間以内にご使用下さい。
- このキットは10~100 μmol/l の[NO2- + NO3- ] の測定に適しています。100 μmol/l以上の高濃度のサンプルは希釈して測定してください。サンプル が80 μl以下の場合には、緩衝溶液を加えて80 μlとして測定してください。
- [NO2- + NO3- ]の検量線は、酵素を用いるため感度が若干低下します。そのため、[NO2- ]の検量線とは一致しません。
- 還元酵素及び補酵素は使用前に混合しないでください。必ず、 別々の溶液として調製し、順次添加してください。
- 還元酵素及び補酵素は凍結乾燥品のため瓶内部が減圧になっています。減圧のまま開封すると中身が飛散する恐れがありますので、必ず緩衝溶液をシリンジで注入し、溶解後開封して下さい。
- NO2- 及びNO3- 標準溶液は、開封後は2ヶ月以内にご使用ください。
- 本キットには、ガラス製容器及びアルミキャップを使用しております。保護手袋を着用するなど取扱いにはご注意ください。
プロトコール
[NO2- ] 検量線の作成
- 96穴マイクロプレートに次のようにNaNO2標準溶液を調製する。
- 検量線作成のためのスポット数は、必要に応じて増やしてください (n=3以上)。
Well NaNO2標準溶液(μl ) 緩衝溶液(μl ) NO2- 濃度(μmol/l ) A1 0 80 0 B1 20 60 25 C1 40 40 50 D1 80 0 100 - 各ウェルに緩衝溶液20 μlを加え全量を100 μlとする。
- 試薬A 50 μlを加えよく混和し5分間放置する。試薬B 50 μlを加え混和し、室温で10分間反応後マイクロプレートリーダーで540 nmの吸光度を測定する (540 nmのフィルターがない場合は530 nm~580 nmの最も適当なフィルターを用いて測定する)。
- 得られた値とブランク値(A1の値)との差を求める。
- 横軸にNaNO2の濃度、縦軸に吸光度をとり、この結果をグラフ化する。
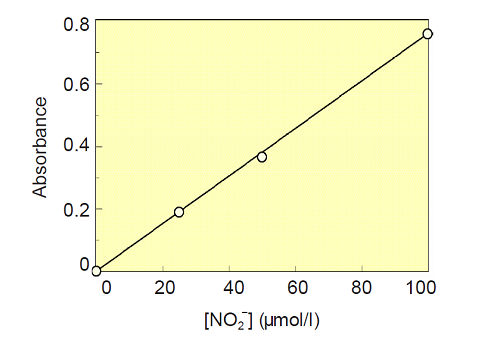
図1 [NO2- ] の検量線の例
[NO2- + NO3- ] 検量線の作成
- 96穴マイクロプレートに次のようにNaNO3標準溶液を調製する。
- 検量線作成のためのスポット数は、必要に応じて増やしてください(n=3以上)。
Well NaNO3標準溶液(μl ) 緩衝溶液(μl ) NO2- 濃度(μmol/l ) E1 0 80 0 F1 20 60 25 G1 40 40 50 H1 80 0 100 - 各ウェルに補酵素溶液10 μl、酵素溶液10 μlを入れ、よく混和する。
- そのまま室温(約25°C)にて2時間インキュベートする。
- 試薬A 50 μlを加えよく混和して5分間放置する。試薬B 50 μlを加え混和し、10分間反応後、マイクロプレートリーダーで540 nmの吸光度を測定する。
- 得られた値とブランク値(E1の値)との差を求める。
- 横軸にNaNO3の濃度、縦軸に吸光度をとり、この結果をグラフ化する。
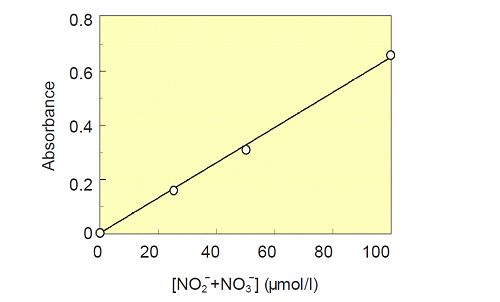
図2 [NO2- + NO3- ] の検量線の例
サンプル調製法
- 血清及び血漿などのタンパク質を含む試料は、除タンパクして測定に使用下さい。( Amicon Ultra-4 Centrifugal Filter Unit with Ultracel-10 membrane ([UFC801008], Millipore 社)などで除タンパク(例えば7,000 x g, 20分間, 4°C)して、測定試料として下さい。トリクロロ酢酸などを用いた除タンパクでも結構です。ただし、酸やアルカリで除タンパクした場合は、測定前に必ずpHを中性に戻してから使用して下さい。酵素反応が阻害をうける可能性があります。その他のタンパク質を含む試料も上記と同様に除タンパクを行って下さい。)
- 細胞培養液を測定に用いる場合は培養液を1,000 x g、15 分間、室温で遠心分離し、その上澄みを測定試料として使用して下さい。
- NO3- を多く含む培養液(RPMI1640など)では[NO2- + NO3- ] の測定はできませんのでご注意下さい。
- 濁りは、測定値に影響を及ぼします。サンプルに濁りがある場合は遠心分離、または濾過により濁りを除いてから測定にご使用下さい。
未知試料の[NO2- ] 測定
- 96穴マイクロプレートのA2~H12 の空いているウェルに各ウェルあたり80 μlのサンプルを入れる。
- 補酵素溶液10 μl、酵素溶液10 μlを入れ、よく混和する。
- そのまま室温(約25°C) にて2 時間インキュベートする。
- 試薬A 50 μlを加えよく混和し、5分間放置する。試薬B 50 μlを加え混和し、10分間反応させた後マイクロプレートリーダーで測定する。
- 得られた値とブランク値 (E1)との差を求める。
- 検量線より[NO2- + NO3- ] 濃度を求める。
未知試料の[NO3- ] 測定
本Kitでは[NO3- ]のみの値は直接的には得られません。測定試料中の[NO3- ]は[NO2- ]と[NO2- + NO3- ]を用いて、
下記の計算式により求めることができます。
[NO3- ] = [NO2- + NO3- ] - [NO2- ]
参考文献
- S. Archer, FASEB. J., 1993, 7, 349.
- W. R. Tracy, J. Linden, M. J. Prach, R. A. Johns, J. Pharmacol. Exp. Ther., 1990, 252, 922.
- J. S. Pollock, U. Forstermann, J. A. Mitchell, T. D. Warner, H. H. H. Schmidt, M. Nakane, F. Murad, Proc. Natl. Acad. Sci. U.S.A., 1991, 88, 10480.
- H. H. H. Schmidt, T. D. Warner, M. Nakane, U. Forstermann, F. Murad, Mol. Pharmacol., 1992, 41, 615.
よくある質問/参考文献
NK05: NO2/NO3 Assay Kit-C -(Colorimetric) -Griess Reagent Kit-
Revised Dec., 05, 2023


 を押して省略できます。
を押して省略できます。

