はじめに
核小体は膜を持たない核内構造体であり、リボソーム生合成の起点となる場所です。核小体にはリボソームを構 成するリボソーム RNA (rRNA) が多く存在し、rRNA の転写やプロセシングなどが行われております。タンパク質合 成の初期段階が核小体で行われているため、核小体の変化は多くの細胞内イベントに関わっていると考えられてい ます。これまで、核小体はがんの病理診断の指標の一つとして知られておりましたが、近年、核小体ストレスを含 め核小体と DNA 損傷 1)、オートファジー 2) ウイルス感染 3) 及び細胞老化 4), 5) との関連性が報告され、がんのみなら ず多くの研究分野で注目されております。Nucleolus Bright 色素は核小体中の RNA に結合し蛍光性となる低分子蛍 光色素であり、核小体を洗浄操作なしで明瞭に観察することができます。
本製品は、熊本大学発生医学研究所 細胞医学分野 中尾光善先生のご指導の下、製品化しました。
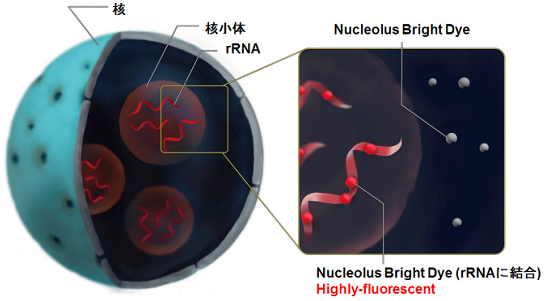
図1 Nucleolus Brightの細胞染色原理
内容
| N511 Nucleolus Bright Green | 60 nmol x 1 |
| N512 Nucleolus Bright Red | 60 nmol x 1 |
保存条件
| N511 Nucleolus Bright Green | 遮光、冷暗所にて保存してください。 |
| N512 Nucleolus Bright Red | 冷暗所にて保存してください。 |
必要なもの
- Dimethyl sulfoxide (DMSO)
- PBS
- マイクロピペット
補足資料
Nucleolus Bright の蛍光特性
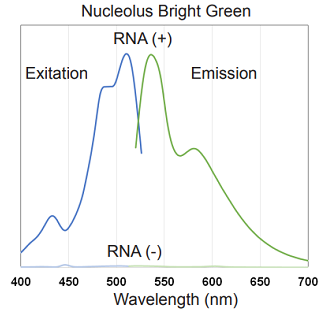
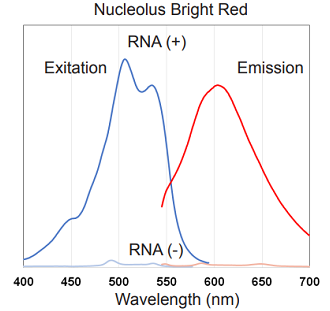
図2 Nucleolus Bright Green、Red の励起、蛍光スペクトル
溶液調製
Nucleolus Bright 1 mmol/l DMSO stock solution の調製
60 nmol の色素を含むチューブに DMSO 60 μl を加えピペッティングにより溶解し、1 mmol/l DMSO stock solution を調製する。
- 調製後は遮光、-20 oC で保存して下さい。調製後 1 ヶ月間は安定です。
Nucleolus Bright working solution の調製
DMSO stock solution を PBS で 200-2000 倍希釈し、0.5–5 μmol/l working solution を調製する。 35 mm dish: 30 枚分使用可能 ( 色素濃度 1 µmol/l で使用時 )。
- 調製後はその日の内にご使用下さい。
操作
- 細胞をディッシュまたはチャンバースライドに播種し、37 ℃、5% CO2 インキュベーター内で一晩培養する。
- 培地を取り除き、4% パラホルムアルデヒド (PFA)/PBS 溶液を添加し、室温で 5 分間インキュベートし細胞を固定化する。もしくは、冷メタノールを添加し、室温で 1 分間インキュベートし細胞を固定化する。
- 上澄み液を除去し、PBS を用いて細胞を 3 回洗浄する。
- 1% Triton X-100/PBS 溶液を添加し、室温で 20 分間インキュベートする。
- 上澄み液を除去し、PBS を用いて細胞を 3 回洗浄する。
- 調製した Nucleolus Bright working solution を加え室温で 5 分間インキュベートする。
- 蛍光顕微鏡にて細胞を観察する。
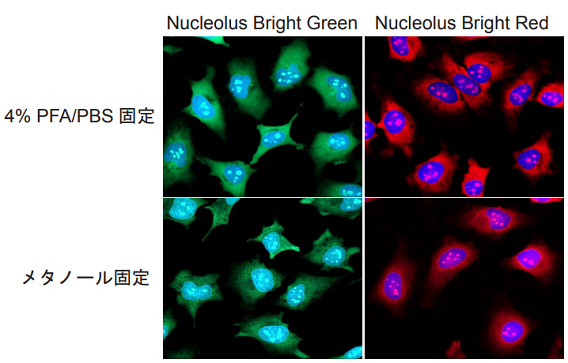
実験例 1
Nucleolus Bright による HeLa 細胞の核小体染色
- μ-Slide 8 well に HeLa 細胞を播種し、37 ℃、5% CO2 インキュベーター内で一晩培養した。
- 培地を取り除き、4% PFA/PBS 溶液を添加し、室温で 5 分間インキュベートし細胞を固定化した。 もしくは、冷メタノールを添加し、室温で 1 分間インキュベートし細胞を固定化した。
- 上澄み液を除去し、PBS を用いて細胞を 3 回洗浄した。
- 1% Triton X-100/PBS 溶液を添加し、室温で 20 分間インキュベートした。
- 上澄み液を除去し、PBS を用いて細胞を 3 回洗浄した。
- 調製したNucleolus Bright working solutionとDAPIの混合溶液200 μlを添加し、室温で5分間インキュベートした。
- 蛍光顕微鏡にて観察した。
-
Nucleolus Bright Green
(染色濃度: 1 μmol/l)
(励起波長: 488 nm、蛍光波長: 500–600 nm)
Nucleolus Bright Red
(染色濃度: 1 μmol/l)
(励起波長: 561 nm、蛍光波長: 565–650 nm)
DAPI
(染色濃度: 3.6 μmol/ml)
(励起波長: 405 nm、蛍光波長: 450–495 nm)
図 3 HeLa 細胞の核小体染色
( 青 : DAPI、緑:Nucleolus Bright Green、赤:Nucleolus Bright Red)
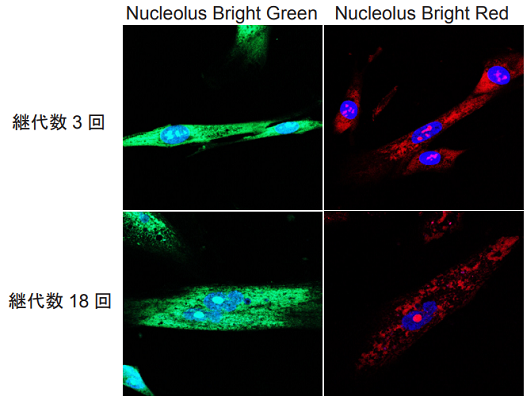
実験例 2
Nucleolus Bright を用いた細胞老化に伴う核小体の形態変化
- 継代数 3 回及び 18 回の WI-38 細胞懸濁液 (5×104 cells/ml, 10% fetal bovine serum, 1% penicillin-streptmycin を含む MEM 培地 ) を、それぞれ μ-Slide 8 well に播種し、37 ℃、5% CO2 インキュベーター内で一晩培養した。
- 培地を取り除き、4% PFA/PBS 溶液を添加し、室温で 5 分間インキュベートし細胞を固定化した。
- 上澄み液を除去し、PBS を用いて細胞を 3 回洗浄した。
- 1% Triton X-100/PBS 溶液を添加し、室温で 20 分間インキュベートした。
- 上澄み液を除去し、PBS を用いて細胞を 3 回洗浄した。
- 調製した Nucleolus Bright working solution と DAPI の混合溶液 200 μl を添加し、室温で 5 分間インキュベートした。
- 蛍光顕微鏡にて観察した。
-
Nucleolus Bright Green
(染色濃度: 1 μmol/l)
(励起波長: 488 nm、蛍光波長: 500–600 nm)
Nucleolus Bright Red
(染色濃度: 1 μmol/l)
(励起波長: 561 nm、蛍光波長: 565–650 nm)
DAPI
(染色濃度: 3.6 μmol/ml)
(励起波長: 405 nm、蛍光波長: 450–495 nm)
図4 細胞老化に伴うWI-38 細胞の核小体形態変化
( 青 : DAPI、緑:Nucleolus Bright Green、赤:Nucleolus Bright Red)
参考文献
- Greenberg, R. A. et al., Cell Reports, 2015, 13, 251–259.
- Kimura, K. et al., Scientific Reports, 2015, 5, 8903.
- Hiscox, J. A. et al., Cellular Microbiology, 2006, 8, 1147–1157.
- Nakao, M. et al., Cell Reports, 2017, 18, 2148–2161.
- Antebi, A. et al., Trends in Cell Biology, DOI: 10.1016/j.tcb.2018.03.007.
よくある質問/参考文献
N511_N512: Nucleolus Bright Green/ Red
Revised Jun., 26, 2023


 を押して省略できます。
を押して省略できます。